地霉菌对发酵药渣中残余林可霉素的生物降解
2022-06-14刘苏瑶雷绳尾张宏鑫牛秋红
刘苏瑶,雷绳尾,张宏鑫,牛秋红
南阳师范学院生命科学与农业工程学院(南阳 473061)
环境中的抗生素被认为是新型污染物。据报道,我国抗生素年使用量约为15~20万 t[1],它可影响污水生物处理系统的功能[2-4],导致微生态失衡。林可霉素可广泛抑制大多数革兰阳性菌和某些厌氧的革兰阴性菌[5-6]。林可霉素及其复方抗生素被广泛应用于食用动物的疾病治疗及控制,由此产生的耐药菌具有交叉耐药性[7]。这种多药耐药性对人类和生态系统健康造成了严重威胁。因此,减少林可霉素的释放及降解环境中的残余林可霉素至关重要。
林可霉素类药物是由链霉菌产生的林可酰胺类抗生素,结构稳定,经常在环境中可检测到[8-9]。Kuchta等[10]研究发现来自农田的融雪径流样品中林可霉素质量浓度为0.008~0.84 μg/L,在土壤中含量可达2.5~240 μg/L。此外,发酵废渣中残留的林可霉素含量高且不易降解,对环境造成极大危害。因此,寻找可降解林可霉素的菌株进行生物降解环境及发酵药渣中残余的林可霉素,可能是新型林可霉素减排利用的双赢策略,也是将发酵废渣实现废物利用的关键步骤。
基于此,此次试验从林可霉素生产药厂的大量废水废渣中筛选到一株对林可霉素具极高降解活性、对环境有益的酵母菌菌株,对其进行分类鉴定,并对该菌株的降解因子初步探究,找到了其降解分子机制,研究结果为后续的研发提供理论借鉴。
1 材料与方法
1.1 样品
菌种分离样品,来源于南阳普康药业有限公司林可霉素生产药厂的废水废渣。
指示菌藤黄八叠球菌,来源于南阳普康药业有限公司林可霉素生产药厂的废水废渣。
1.2 培养基与培养条件
筛选培养基:0.1 g磷酸二氢钾、0.05 g硝酸钾、0.01 g硫酸镁、0.01 g硫酸亚铁、0.6 g林可霉素和1.5 g琼脂,定容100 mL。
试管种培养基:0.5%酵母粉、0.5%蛋白胨、1%葡萄糖、琼脂1.5%;pH 3~6。将菌体接种到培养基上,25 ℃下培养3 d,获得试管种。
液体扩大培养基:0.5%酵母提取物、0.5%蛋白胨、1%葡萄糖;pH 3~6。
培养条件:将试管种接种到500 mL三角瓶液体培养基中,每瓶装200 mL,在25 ℃下摇床培养,培养时间3 d,转速为250 r/min。
1.3 降解菌株筛选
初筛:从林可霉素生产药厂的废水废渣中收集、取样,稀释到合适倍数,接种到仅用林可霉素(1.2 g/mL)作为唯一碳源的筛选培养基中,获得了一些能够在无机盐和林可霉素固体琼脂平板上生长的菌株。后续长出的酵母菌进行复筛,选取降解活性最大的菌株用于后期试验。
复筛:使用杯碟法测定各菌株对林可霉素的降解效果。以藤黄八叠球菌作为指示菌,将初筛获得的菌株分别加入药渣中,通过测定抑菌圈的大小差异来检测发酵液中残留林可霉素的含量,进而计算出各菌株的降解能力,按式(1)计算。每个处理重复3次。

1.4 降解活性测试
使用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)方法定量复筛菌株对林可霉素的降解率。在微孔板包被有林可霉素偶联抗原,加入林可霉素标准品或样品,游离林可霉素与微孔条上预包被的林可霉素偶联抗原互相竞争抗林可霉素抗体酶标记物,用TBM底物显色,加入终止液后颜色由蓝色变为黄色,用酶标仪在450 nm波长下进行检测,吸光度与样品中林可霉素含量呈反比,通过标准曲线计算样品中林可霉素的含量,从而获得菌株对林可霉素的降解效果。
1.5 降解菌株鉴定
对筛选菌株的菌落及细胞形态、繁殖方式进行观察[17]。通过糖发酵试验、碳源同化试验、氮源同化试验、类淀粉化合物生成试验、产酯试验、产酸试验等生理生化特征对筛选菌株进行鉴定[11-12]。利用通用引物NL1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)与NL4(5’-GGTCCGTGTTTCAAGACGG-3’),以酵母菌基因组为模板,扩增26S rDNA D1/D2区序列,将其克隆到载体中再转化到大肠杆菌感受态细胞,筛选阳性克隆提交至生工生物工程(上海)股份有限公司测序[13]。将测定的序列提交至GenBank数据库,使用BLAST程序与已有菌株的26S rDNA D1/D2区序列进行相似性比较,确定该菌株的分类地位。
1.6 降解基因克隆
通过DNA文库构建及功能筛选的方法获得酵母菌中可降解林可霉素的目的基因。酵母菌菌株基因组提取按照参考文献[14]进行。文库构建使用Epicentre公司pWEB::TNC Cosmid Cloning Kit试剂盒(方法参照其说明书)。取0.5 μg纯化的总DNA,补平DNA末端,然后在低熔点琼脂糖上进行电泳并回收DNA。补平并回收的DNA与试剂盒中的载体pWEB::TNC连接,连接产物经包装蛋白包装后侵染宿主菌EPI100并涂布在含有氨苄青霉素的LB平板上。
用平板影印法将文库影印到降解活性测试平板上,将平板倒置于28 ℃培养24~48 h后,筛选阳性克隆。将阳性克隆复测活性验证后,提取质粒进行基因亚克隆操作,提取质粒送交大连宝生物公司进行测序。
1.7 降解基因表达及活性测定
构建降解基因的酵母表达载体ehS1/pWX530,在宿主酿酒酵母细胞中表达,用离子交换层析纯化表达产物。利用上述方法对基因表达产物测试降解能力,PBS作为阴性对照,S1菌液作为阳性对照。
2 结果和分析
2.1 降解林可霉素酵母菌的筛选和分离
从林可霉素制药厂附近采来5份水样和10份土样,在以林可霉素为唯一碳源的培养基上分离,获得了6株酵母菌,分别为M4、M8、G6、S1、N2、N3。对这6株酵母菌纯化后,进行林可霉素降解活性测试。结果表明:在发酵7,10和15 d后,在装有无菌水的牛津杯上,阴性对照的抑制圈分别为29.98,30.05和30.17 mm,而6种酵母菌株的抑制圈直径范围17.79~25.51 mm(表1),这6株酵母菌均显示对林可霉素的降解能力。其中,编号为S1的菌株显示最弱的抑菌圈,这一结果表明菌株S1表现出最强的林可霉素降解活性,用于后续试验对象。

表1 林可霉素降解菌株的筛选结果
2.2 酵母菌S1的降解活性测试
所获得的每个浓度的标准溶液和样本吸光度的平均值(B)除以第一个标准(0标准)的吸光度(B0)再乘以100%,即百分吸光度。其中:B表示标准溶液或样本溶液的平均吸光度;B0表示0 μg/L标准溶液的平均吸光度。
以林可霉素质量浓度为X轴,抑菌圈直径为Y轴,绘制林可霉素标准样品质量浓度与抑菌圈直径间线性关系的标准曲线图,如图1所示。
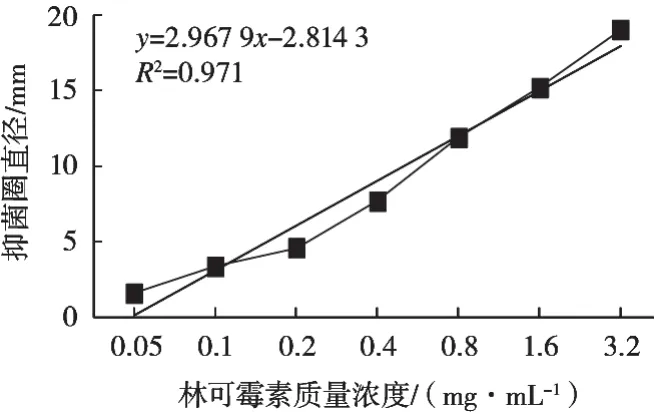
图1 林可霉素浓度与抑菌圈直径关系线型图
酵母菌S1菌株液体发酵产物对林可霉素发酵药渣中的残余林可霉素具有较好的降解效果。处理废渣7,10和14 d的降解率分别达到27.2%,31.6%和33.8%(表2)。在同样条件下,对照处理废渣,其中林可霉素的浓度几乎不变,从而进一步证明了酵母菌S1菌株对废渣中残余林可霉素的降解功能。

表2 酵母菌S1菌株对林可霉素的降解率测定结果
2.3 酵母菌S1菌株的鉴定
酵母菌S1菌株在平板上光滑,饱满圆润,后期呈现雪花状,颜色为白色,呈薄层状,表面比较干燥,四周有绒丝状物质,中间没有突起(图2A);该菌的菌落直径约4~5 cm;细胞体积大小为(1.60~2.36 μm)×(1.6~4.9 μm);光学显微镜下观察S1大多数细胞的形态呈椭圆形、肾形、圆柱形,有些细胞与其子代细胞连在一起成为链状细胞的生殖方式为裂殖(图2B)。

图2 菌株S1的菌落和细胞形态特征

注:发育树节点的数字表示Bootstrap值;括号中的数字为序列登录号。
以S1菌株的基因组为模板,以NLI和NL4为引物做PCR,菌株的26S rRNA 扩增得到特异性条带,测序后,将序列分别与GenBank中的序列进行比对,菌株S1与Galactomyces candidumstrain CBS 606.85 26S rRNA(JN974267.1)的同源性达到99.1%。选择同源性高的前12条序列,构建系统发育树,发现S1与G.candidumCBS 606.85聚在同一个分支(图3)。
通过对S1菌株进行形态学及分子鉴定,最终确定为白地霉酵母菌Galactomyces。
2.4 降解基因的克隆与分析
提取了该菌株S1的总DNA,以柯斯质粒为载体构建了1个含约9 600个克隆的宏基因组文库,对文库进行活性筛选,获得1个具有降解林可霉素活性的克隆。根据对这些突变文库的筛选,获得一个能够高效降解林可霉素的突变株。经过亚克隆及测序分析发现该突变株编码1个潜在的降解林可霉素相关基因,全长1 200 bp,将其命名为dgs1基因,该基因共编码399个氨基酸的ORF(Open Reading Frame),其氨基酸序列与1个来源于Cryptococcus gattiiWM276的epoxide hydrolase 1基因(XP 003197630)的同源性最高,两者的一致性为99%,相似性为86.47%。
根据氨基酸Blast结果,选取前12个与Dgs1蛋白同源性最高的序列,建立系统发育树,结果显示Dgs1蛋白与来自于C.gattiiWM276环氧化物水解酶基因聚在一个分支(图4),该结果与前面Blast结果一致。

图4 菌株S1中环氧化物水解酶Dgs1的系统发育分析
以上结果表明,酵母菌S1中的环氧化物水解酶基因dgs1可能参与了该菌株降解林可霉素的过程。
2.5 降解基因表达产物及活性
为了进一步验证dgs1基因的功能,将其连接酵母表达载体ehs9/pWX530,进行异源表达,表达产物在酿酒酵母细胞中分泌表达,用离子交换层析纯化表达产物,得到分子量大小为45 kDa的电泳纯条带(图5)。

图5 dgs1基因表达纯化SDS-PAGE电泳
对纯化得到的重组蛋白Rm-Dgs1进行降解活性验证,结果如图6所示。PBS对照、S1菌液和重组蛋白Rm-Dgs1作用药渣14 d后,抑菌圈直径分别是13.1,7.7及1.2 mm。Rm-Dgs1的降解能力达到33.95%。结果表明Rm-Dgs1对林可霉素有明显的降解作用。

图6 重组蛋白Rm-Dgs1的降解活性的平板测试结果
3 讨论
在我国大部分采用微生物发酵法制备抗生素。发酵过程中产生的废渣尽管富含粗蛋白、氮磷钾无机盐、氨基酸和维生素等丰富的营养物质,但是由于其残留林可霉素药效成分而导致其成为难以治理和综合利用的危险废弃物[15],同时,林可霉素发酵相关企业每年投入大量的资金用于运输和处理这些菌渣。因而,如何将林可霉素菌渣变废为宝、减少对周围环境的污染,成为摆在抗生素生产企业面前函待解决的一个难题。
目前,对林可霉素的降解有物理、化学和生物等多种方法。Liu等[16]通过土地利用粪便热解产生的生物炭进行粪便管理,利用粪污生物炭将水中残余的林可霉素吸附出来,实现抗生素减排。最近,Morsi等[17]采用固定化大豆过氧化物酶耦合生物催化剂来实现各种新兴污染物的有效降解,他们的研究结果证实与游离酶相比,TiO2和ZnO固定化大豆过氧化物酶对林可霉素等新兴污染物的降解效率更高。Mariusz等[18]认为土壤中残余的抗生素经历不同的生物或非生物的降解过程,包括转化降解、吸附解离、植物吸收或光催化降解等。他们认为抗生素也可能通过还原性或氧化性降解转化,而关于这些过程的数据仍然很少。
国内有关林可霉素发酵药渣中残留抗生素降解技术的研究报道甚少。有关林可霉素降解的报道也屈指可数。任省涛[19]以林可霉素菌渣为研究对象,研究了堆肥过程中林可霉素降解产物以及降解机制,结果表面堆肥化方式处理林可霉素菌渣可以实现其无害化和资源化。王莹等[20]从环境中筛选获得高效降解林可霉素的菌株寡养单胞菌属LD25#,并对其降解特性进行了研究,但其降解机制仍不清楚。
此次试验对林可霉素的降解提出了一种创新的双赢战略:利用酵母菌降解废渣中高浓度的林可霉素,这不仅变废为宝,还能解决环境污染问题,可谓一举两得。酵母菌是单细胞真核微生物,菌体蛋白质含量高,富含多种维生素,能够用作饲料,可利用工厂排出的有机废料、废水生长繁殖。在微生物家族中,酵母菌是食品、饲料等工业化生产技术最成熟的种类,研究开发酵母菌药渣饲料有着重要的意义。
4 结论
研究从生产药厂的大量废水废渣中筛选到可降解林可霉素的地霉菌属酵母菌S1菌株,该菌株可在林可霉素为唯一碳源的培养基上生长。对S1菌株降解林可霉素作用机理研究发现,其降解功能主要源于发酵液中的某种代谢物质成分,主要作用机理是菌株产生的某种代谢物质作用于林可霉素结构中的某个关键化学键,从而使其分解成小分子物质。进一步通过构建基因文库,活性筛选获得1个具有降解林可霉素活性的环氧化物水解酶基因dgs1,对该基因异源表达后,重组蛋白具有显著的降解功能,从而证明了S1菌株中环氧化物水解酶基因dgs1在降解林可霉素过程中发挥重要作用。
此次研究结果为今后林可霉素高效降解工程菌的构建、林可霉素药渣环保处理及资源化利用奠定基础,研究意义在于对于去除生产废渣中抗生素在环境中的残留、提高环境质量、保护生态平衡及对抗生素生产行业的可持续发展均具有重要的科学意义和应用价值。
