湖南岳阳猪沙门氏菌分离鉴定及耐药性分析
2022-06-13彭娜娜宁慧敏邓瑞德
彭娜娜,宁慧敏,王 文,邓瑞德,董 伟
(湖南农业大学动物医学院,湖南 长沙 410128)
猪沙门氏菌病又称为猪副伤寒,该病是由沙门氏菌引起仔猪的一类传染性疾病。该病主要侵袭6月龄以下的仔猪,尤其对1~4月龄仔猪敏感;仔猪感染该疾病后,通常临床上以急性、亚急性、慢性形式呈现[1],主要表现为体温升高、腹痛、下痢、呼吸困难,耳根、胸前和腹下皮肤有紫红色出血斑,多以死亡告终[2]。该疾病一年四季均可发生,但在阴雨潮湿季节较为多发;主要传染源为病猪和隐性带病猪,此外还有携带病菌的人类或其它动物,可通过排泄物、饮水、日常管理使用的工具等传播,主要经消化道感染该疾病[3]。猪沙门氏菌病对我国养猪业危害重大,威胁着人类食品安全及动物生命健康。
目前,随着养殖场逐渐规模化、集约化,生物安全防控措施的实施,以及疫苗的预防注射,因此猪场发生疫病的概率不断下降;但是在猪类养殖过程中,由于沙门氏菌本身存在很强的抗药性,加上抗生素滥用的现象比比皆是,导致沙门氏菌在猪类养殖场中层出不穷,诱发了大量疾病,严重威胁养殖业的安全。2021年5月,湖南岳阳某猪场部分仔猪发生腹泻且粪便呈现灰绿色,笔者通过分析临床症状及借助实验室诊断技术,分离培养鉴定得到一株沙门氏菌,确定此病是由沙门氏菌感染所引起的,且在药敏试验结果中得知沙门氏菌对大部分大环内酯类、林可酰胺类抗生素有一定的耐药性。本试验对该疾病的防控提供了一定的科学依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 病死仔猪来源于湖南岳阳某猪场,通过剖检病死仔猪,无菌采集肺脏、脾脏、肝脏以及肠系膜淋巴结,低温送检至湖南农业大学动物医学院进行病原学诊断。
1.1.2 主要试剂 细菌基因组DNA抽提试剂盒、2×Taq master mix、DL 2 000 DNA Marker等试剂均购自于TakaRa公司;药敏纸片购自于上海源叶生物科技有限公司;葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖和果糖等购自于国药集团化学试剂有限公司。
1.2 方法
1.2.1 细菌分离培养与革兰氏染色鉴定 按照无菌操作的方法,用高温灼烧后的手术刀将病变部位的组织切开,再用灭菌过后的接种环蘸取组织内部,接种至普通肉汤培养基中,37 ℃摇床培养12 h;待液体浑浊后,用灭菌后的接种环蘸取浑浊液体划线于普通琼脂培养基表面,37 ℃恒温箱过夜培养;平板划线得到单个菌落后,进行革兰氏染色并进行纯培养,以备后续的生化鉴定及细菌16S rRNA基因序列扩增。
1.2.2 生化鉴定 将分离的菌株接种于普通培养基进行培养,其后将单一菌落分别接种在葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖、果糖等微量生化鉴定管,37 ℃培养48 h,统计并分析试验结果。
1.2.3 分离菌株16S rRNA基因序列扩增及测序 根据参考文献[4]合成用于PCR扩增细菌16S rRNA基因序列通用引物,16S rRNA-27F:5'-AGAGTTTGATCCTGGCTCAG- 3';16S rRNA-1492R:5'-GGCTACCTTGTTACGACTT-3',并将该引物送至北京擎科生物科技有限公司长沙分公司合成。将分离纯化好的菌液用DNA提取试剂盒提取细菌基因组DNA,将其作为PCR扩增的模板,其PCR体系(50.0 µL)包括2×PCR Taqmaster mix 25µL、上下游引物各1 µL、DNA模板3 µL及双蒸水20µL,并同时设置阳性对照和阴性对照,其模板分别为已知沙门氏菌DNA和双蒸水;扩增条件为94℃ 3 min;95 ℃ 15 s,56 ℃ 15 s,72 ℃ 60 s,共35个循环;72 ℃延伸10 min。PCR反应结束后取8 µL产物进行凝胶电泳跑胶,将PCR阳性产物送至北京擎科生物科技有限公司长沙分公司双向测序。
1.2.4 小鼠致病性试验 将12只5周龄雄性昆明小鼠随机分为2组,每组6只,其中试验组小鼠腹腔注射分离菌原液0.2 mL/只,对照组小鼠腹腔注射等体积灭菌的生理盐水。对各组小鼠攻毒后观察其临床症状等,并记录相应的结果。
1.2.5 药敏试验 采用药敏纸片扩散法对分离的致病菌进行药敏试验:将分离纯化菌稀释至1×108CFU/mL,取100 µL稀释菌液均匀涂布于普通琼脂培养基表面,取不同药敏纸片贴于培养基表面,置于37 ℃恒温培养24 h后测定不同药敏纸片抑菌圈,根据该产品相关判定标准对结果进行分析。
2 结果
2.1 细菌分离鉴定及生化试验结果
无菌条件下接种至普通琼脂培养基表面,37 ℃恒温箱培养12 h后,可观察到表面光滑且为圆形整齐的白色菌落;通过挑取单个菌落革兰氏染色,发现菌体呈现两端钝圆的红色短小杆菌,为革兰氏阴性菌(图1)。将单一菌落分别接种在葡萄糖、乳糖、麦芽糖、甘露醇、蔗糖等微量生化鉴定管,37 ℃培养48 h后,结果显示葡萄糖、麦芽糖、甘露醇、枸橼酸盐、硫化氢试验和MR试验为阳性,乳糖、蔗糖、吲哚试验、V-P试验显示均为阴性(表1)。此结果符合鼠伤寒沙门氏菌的生化特性。
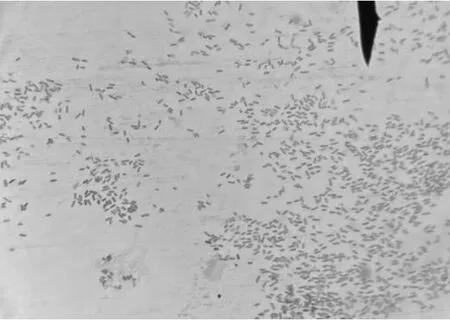
图1 分离菌革兰氏染色镜检

表1 分离菌生化试验结果
2.2 PCR扩增结果及序列分析结果
以分离纯化后提取的细菌基因组DNA作为模板,通过细菌通用引物对其16S rDNA序列进行PCR扩增,凝胶电泳结果如图2。该菌株16S rDNA基因序列PCR扩增产物大小约为1 600 bp,且阴性对照、阳性对照均成立。进一步测序结果分析得到该菌株16S rDNA基因序列与已知鼠伤寒沙门氏菌分离株(登录号:CP070302)同源性最高,为99.87%;与其它细菌性病原对应序列同源性相对较低,因此推断本试验获得的菌株属于猪源鼠伤寒沙门氏菌。
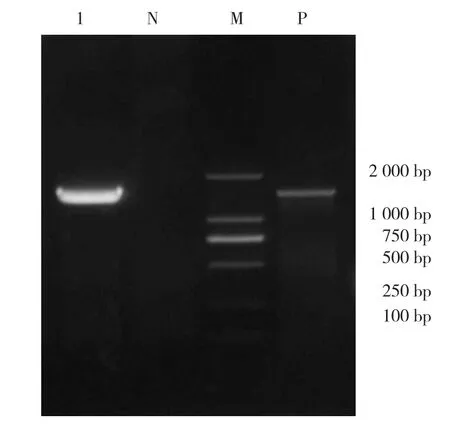
图2 分离菌株16S rDNA扩增PCR产物凝胶电泳结果
2.3 小鼠致病性试验结果
为进一步分析该菌株的致病性,对试验组与对照组昆明小鼠分别注射菌液与无菌生理盐水,结果发现试验组小鼠均出现体温升高、走路不稳等不适症状,在接种的20 h内出现死亡,而对照组小鼠未出现异常情况。对死亡小鼠进行剖检,取肝脏、肠道等脏器进行细菌分离培养鉴定,最终发现其革兰氏染色特点与16S rDNA基因序列扩增及测序结果符合鼠伤寒沙门氏菌。
2.4 药敏试验结果
药敏试验结果如表2所示,该试验分离得到的菌株对头孢曲松、罗红霉素、氟苯尼考、头孢噻肟敏感,对氨苄西林、阿米卡星、头孢噻吩、阿莫西林/克拉维酸、多西环素、新霉素中度敏感,而对克拉霉素、青霉素G、红霉素、林可霉素、克林霉素耐药。
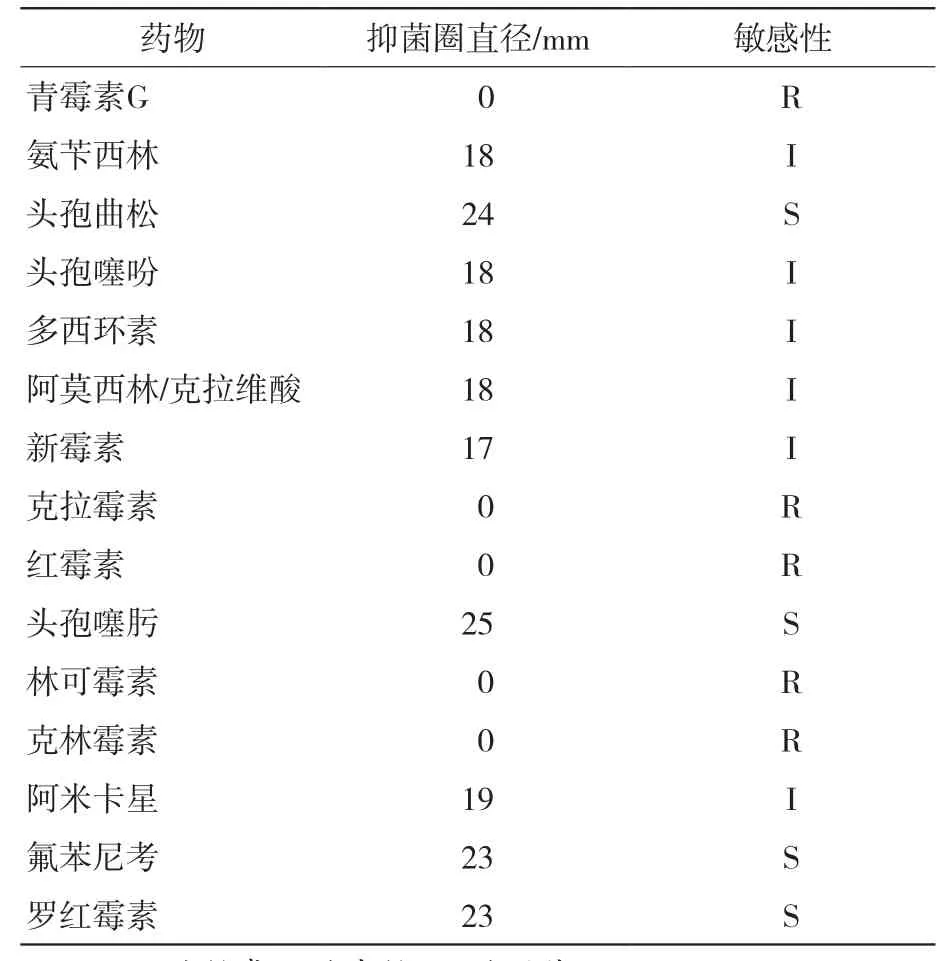
表2 分离菌株耐药性分析结果
3 讨论
沙门氏菌是一种重要的人畜共患病原菌和食源性病原菌,对养殖业和人类的健康危害巨大[5],其发病形式通常会以散发性或地方流行性呈现,广泛分布于自然界中,是在养殖过程中较为常见的传染性疫病。沙门氏菌血清型分型是根据沙门氏菌菌体表面的抗原成分进行分型;沙门氏菌具有复杂的抗原结构,一般沙门氏菌具有菌体(O)抗原、鞭毛(H)抗原、表面(Vi)抗原和菌毛抗原4种抗原[6]。本试验从湖南岳阳某猪场部分死亡仔猪的病理组织中分离出一株病原菌,我们通过细菌分离培养鉴定及16S rDNA基因序列扩增与分析得知该病原菌为鼠伤寒沙门氏菌;进一步探究沙门氏菌的致病性,结果显示对小鼠具有一定程度的致病性。
目前,由于沙门氏菌本身存在一定的抗药性,随着养殖业的日新月异,人类滥用抗生素的现象屡教不改,因此导致沙门氏菌对于大多数抗生素敏感性较差。夏宇飞等[7]对湖南部分地区生猪养殖场、屠宰场的猪肛门拭子和鸡盲肠样本采样进行沙门氏菌分离鉴定及耐药性分析,结果显示69株猪源和鸡源沙门氏菌对四环素、氨苄西林、磺胺异唑的耐药率在62%以上,对阿莫西林/克拉维酸、氟苯尼考的耐药率在40%左右。王大春等[8]发现沙门氏菌分离株对头孢菌素类和链霉素、环丙沙星较为敏感,但对四环素类、青霉素类和磺胺类药物具有较高的耐药性。本文所分离出来的菌株对头孢菌素类、青霉素类、氟苯尼考等较为敏感,而对大部分大环内酯类、林可酰胺类抗生素耐药,与夏宇飞等[7]和王大春等[8]研究结果略有差异,因此针对不同的分离菌株进行药敏试验分析是具有重大参考意义的,严格筛选合适的抗生素是进行防治的有效手段。
