二氧化硅纳米花固定化酶及其有机磷农药降解性能
2022-06-12李霆李强强姜艳军马丽
李霆 李强强 姜艳军 马丽
摘要:有机磷农药在蔬菜、水果及土壤中的残留严重影响了环境和人类的身体健康。有机磷水解酶(organophosphate pesticides,OPH)能高效降解有机磷类化合物残留,利用具有开放孔道的二氧化硅纳米花固定有机磷水解酶,可以优化固定化条件,固定化OPH的最适温度为45 ℃,最适pH值为8,与游离OPH相比,在温度为35~55 ℃、pH值为7.5~9.0的范围内均能保持较高的催化活性。与游离有机磷水解酶相比,固定化有机磷水解酶具有更好的热稳定性、pH值稳定性和重复使用性。研究结果表明,固定化酶在保证降解效率的同时,可有效降低有机磷水解酶的使用成本,是一种具有发展前景的固定化酶降解有机磷农药技术。
关键词:有机磷降解酶;有机磷农药;二氧化硅纳米花;固定化酶;降解
中图分类号: S482.3+3;S188+.3 文献标志码: A
文章编号:1002-1302(2022)10-0104-06
有机磷农药(organophosphate pesticides,OPs)是我国乃至世界范围内使用最广泛的一类用于农作物和蔬果的杀虫剂,由于其与生物体内的乙酰胆碱具有相似的结构,从而会影响生物体内正常的神经系统传递过程,达到消灭害虫的目的[1-3]。但在自然界中,有机磷农药会持续存在很长时间,给环境和人类健康带来严重威胁[3-7]。因此,开发可以在水体、农作物、土壤中应用的高效降解有机磷农药技术十分必要。
目前,针对有机磷农药的降解方法主要分为热降解法、化学降解法和生物酶降解法,由于生物酶法具有反应专一性强、反应条件温和、绿色环保的优势而受到广泛关注[8-13]。有机磷水解酶(organophosphate pesticides,OPH)是一种广泛存在于生物体内的酯酶,能够高效催化有机磷农药的降解。2020年,白俊岩等利用OPH降解甲基对硫磷,在优化的试验条件下,OPH对有机磷类化合物的降解率达到98%以上[14]。用OPH降解有机磷类毒剂时,通常需要将OPH固定在载体上,与直接使用游离酶相比,在保证酶催化性能的同时,解决了游离酶难分离、重复使用的缺陷。固定化酶的方法和载体的选择是影响固定化酶效果的关键因素。因此,开发适合OPH固定的良好载体,并通过合适的固定化方法维持酶的活性与稳定性是目前亟待解决的问题。
本研究制备了具有开放孔道结构的二氧化硅纳米花作为载体固定化OPH。二氧化硅纳米花具有独特的孔道结构,可以提高OPH的负载量,同时可为OPH提供适宜的微环境,有利于保持酶分子的活性构象,使固定化酶表现出良好的催化活性。通过单因素和正交试验对固定化酶的条件进行优化,考察固定化酶的酶学性能,并对固定化OPH在真实样品中的降解能力和重复使用性进行了测定。褶皱二氧化硅纳米花不仅为固定化酶提供了一种良好载体,同时该技术也为在蔬果中实现有机磷农药的降解提供了新方法。
1 材料与方法
1.1 试验试剂
OPH,购于西格瑪奥德里奇(上海)贸易有限公司;十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)、正丁醇、环己烷、乙醇、尿素、碳酸钠(Na2CO3)和正硅酸乙酯(tetraethyl orthosilicate,TEOS),购于天津市大茂化学试剂厂;甲基对硫磷、对硝基苯酚(p-nitrophenol,PNP)、三氯乙酸、三羟甲基氨基甲烷(Tris)、二甲基亚砜(dimethyl sulfoxide,DMSO),购于上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
集热式恒温加热磁力搅拌器(DF-101S),购自河南予华仪器有限公司;管式炉(KRG-9-12),购自洛阳科热炉业有限公司;紫外可见分光光度计(UV-1100),购自上海仪电分析仪器有限公司;扫描电子显微镜(NanoSEM450)和透射电子显微镜(TalosF200s),购自美国FEI公司;漩涡振荡器(XW-80A),购自上海青浦泸西仪器厂。
1.3 试验方法
1.3.1 褶皱二氧化硅纳米花的制备方法 将CTAB(1.0 g)、正丁醇(1.0 g)和尿素(30 g,0.4 mol/L)置于单口烧瓶中,搅拌至完全溶解,向上述溶液中加入12 g环己烷,待完全溶解后缓慢滴加2 g 正硅酸乙酯,搅拌30 min,于70 ℃、恒温条件下磁力搅拌反应20 h,用蒸馏水、95%乙醇洗涤,在煅烧炉中于550 ℃空气煅烧5 h,除去未反应的CTAB,得到褶皱二氧化硅纳米花颗粒(SiO2NF)。
1.3.2 固定化酶的制备方法 取一定量褶皱二氧化硅,在水浴振荡下使其均匀分散在1 mL Tris-HCl缓冲液(50 mmol/L,pH值为8.0)中,加入OPH,在一定温度下孵育一定时间,离心分离后收集沉淀,用去离子水清洗3次,真空干燥后得到固定化酶(OPH@SiO2NF)。
1.3.3 载体及固定化酶的表征方法 通过扫描电子显微镜(scanning electron microscope,SEM) 和透射电子显微镜(transmission electron microscope,TEM)对OPH@SiO2NF的形貌和结构进行表征。
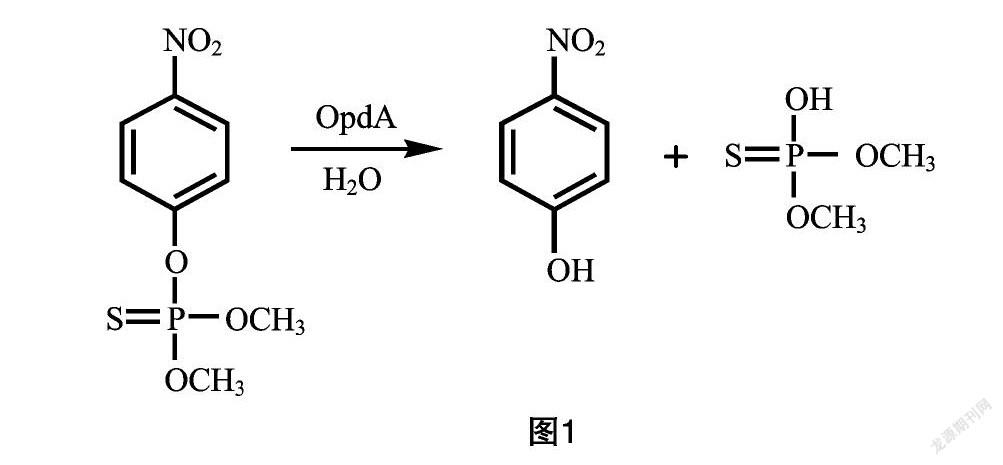
1.3.4 游离OPH和OPH@SiO2NF活性的测定 通过比色法测定游离OPH和OPH@SiO2NF的活性。OPH可将甲基对硫磷降解为对硝基苯酚(PNP),与Na2CO3会发生颜色变化,反应方程见图1。根据颜色变化来衡量游离OPH和OPH@SiO2NF的活性。
具体测定条件:取适量游离OPH或固定化OPH@SiO2NF,加入至含有甲基对硫磷(5 μL 10 mg/mL)的Tris-HCl缓冲液(50 mmol/L,pH值为8.0)中,于37 ℃反应5 min,立即加入1 mL终止剂三氯乙酸(10%)终止反应,再加入1 mL碳酸钠(10%)显色,测定其在410 nm处的吸光度。根据PNP标准曲线得到PNP产量并计算酶活性。1个酶活性单位(U)定义:37 ℃反应1 min产生1 μmol PNP所需的酶量。54C17866-9329-4820-953F-6EF8ACE3D55B
1.3.5 OPH@SiO2NF和OPH的酶学性质分析
1.3.5.1 固定化酶的最适温度 取一定量OPH@SiO2NF和OPH,在不同温度的Tris-HCl缓冲液中孵育10 min后,测定其活性。
1.3.5.2 固定化酶的最适pH值 取一定量OPH@SiO2NF和OPH,在不同pH值的缓冲液中孵育 10 min 后,在37 ℃测定其活性。
1.3.5.3 有机溶剂耐受性的分析 取一定量OPH@SiO2NF和OPH,在不同浓度的甲醇和DMSO溶液中孵育10 min后,在37 ℃、最适pH值下测定其活性。
1.3.5.4 热稳定性和pH值稳定性的分析 分别将一定量的OPH和OPH@SiO2NF置于Tris-HCl缓冲液(pH值为8.0)中,于50、60 ℃水浴条件下孵化,每隔一定时间测其剩余活性。分别将一定量的OPH和OPH@SiO2NF置于不同pH值的缓冲液(pH值为8.0)中,在50、60 ℃水浴条件下孵化,每隔一定时间测其剩余活性。
1.3.5.5 储藏稳定性分析 分别将一定量的OPH和OPH@SiO2NF置于Tris-HCl缓冲液(pH值为8.0)中,在37 ℃水浴条件下孵化,每隔一定时间测其剩余活性。
1.3.6 OPH@SiO2NF和OPH在实际蔬果中对甲基对硫磷的降解能力测定 在天津市本地蔬菜市场购买苹果和卷心菜,摘除腐败叶片后,用清水清洗泥污后晾干。取2 g苹果与卷心菜,喷洒上2 mL 1×10-5 mol/L甲基对硫磷,静置1 h后,将苹果与卷心菜置于5 mL含有5%丙酮的缓冲溶液中,于 25 ℃ 反应1 h,再于8 000 r/min离心5 min,取上清于410 nm处测定吸光度,计算酶降解活性。
1.4 正交试验优化固定化条件
在单因素试验的基础上,以蛋白负载量和降解活性为评价标准,利用正交试验对固定化过程进行优化,试验因素和水平见表1。
2 结果与分析
2.1 SiO2NF的表征
利用SEM考察SiO2NF的外部形貌 由图2-a可以看出,SiO2NF为高度分散、尺寸均一(粒径为 80~120 nm)的花状纳米颗粒,表面分布着开放的孔道。SiO2NF的TEM(图2-b)与SEM表征的纳米颗粒尺寸一致。由TEM结果可以看出,SiO2NF表面的枝状孔道深嵌入纳米颗粒的中心位置。因此可见,SiO2NF的放射状孔道结构可为后面固定化酶修饰提供较大的比表面积,并且在反应体系中有利于传质。
2.2 SiO2NF固定化OPH条件的筛选
为筛选出最佳固定化OPH条件,通过单因素试验研究不同初始酶浓度和吸附时间2个关键因素对固定化OPH酶活性的影响。由图3可见,随着初始酶浓度的增大,蛋白负载量也呈现出不断上升的趋势,但当初始酶浓度超过55 mg/mL时,蛋白负载量增大不明显,而且在吸附16 h时,所有酶浓度固定化OPH均可达到吸附平衡。
由图4可见,当初始酶浓度达到55 mg/mL后,降解活性不再上升,反而表现出降低趨势。这是由于当初始酶活性过高时,酶分子在载体内部的聚集程度增大,造成酶分子之间活性位点相互遮盖,减少了底物、产物与活性位点接触的机会,导致降解活性降低[15-17]。
在单因素试验的基础上,选取不同初始酶浓度、吸附时间、摇床转速和固定化温度4个因素,通过正交试验对固定化条件进行优化,取4因素4水平,设计L16正交试验,试验结果如表2所示。根据正交试验法对固定化条件的优化结果及极差分析可知,上述4个因素对固定化酶蛋白负载量的影响顺序依次为初始酶浓度>吸附时间>固定化温度>摇床转速,获得蛋白负载量最优的试验设计方案是A4B3C2D2,上述4个因素对降解活性的影响顺序依次为初始酶浓度>吸附时间>固定化温度>摇床转速,获得降解活性最优的试验设计方案是A3B4C2D4,综合考虑蛋白负载量和降解活性,后续固定化酶试验选择初始酶浓度为55 mg/mL,吸附时间为16 h,摇床转速为100 r/min,固定化酶的温度为35 ℃,此时的降解活性为 320 U/g,蛋白负载量为51 mg/g。
2.3 游离OPH和OPH@SiO2NF酶学性能的分析
2.3.1 游离OPH和OPH@SiO2NF的最适温度 分别对游离OPH和OPH@SiO2NF的最适温度进行研究,由图5可见,游离OPH在40 ℃时表现出最高的相对活性,而固定化后的OPH@SiO2NF在45 ℃时的酶活性最高。OPH@SiO2NF的最适温度要高于游离OPH,因为OPH被固定于SiO2NF上后,限域作用的影响使其展现活性所需的活化能比游离OPH高。而当温度继续升高时,游离的OPH和固定化OPH的相对活性都有不同程度的降低,这是由于酶分子在过高的温度下会产生不可逆的构象变化[18-20],使酶丧失活性。
2.3.2 游离OPH和OPH@SiO2NF的最适pH值 对游离OPH和OPH@SiO2NF的最适pH值进行研究,由图6可见,游离酶在pH值为8.5时的相对活性最高,达到95%,相比较而言,OPH@SiO2NF在pH值为7.5~9.0之间均表现出较高的相对活性,OPH@SiO2NF的最适pH值为8。从图6还可以看出,通过固定化后的OPH在较宽的pH值范围内均能保持较高的酶活性,这是由于将OPH固定于SiO2NF的孔道中,为酶分子提供了良好的微环境,其酶活性中心得到保护[21],从而表现出稳定的酶活性。
2.4 游离OPH和OPH@SiO2NF稳定性能的分析
2.4.1 有机溶剂耐受性 OPH降解的有机磷农药及神经毒剂等,通常需要丙酮、乙腈等有机溶剂对其进行溶解,但此类极性较强的有机溶剂会引起OPH失活,因此选择乙腈和丙酮溶剂对游离OPH和OPH@SiO2NF的有机溶剂耐受性进行研究。由图7可以看出,在25%乙腈溶液中,OPH@SiO2NF仍然可以保留80%的剩余活性,而游离OPH仅有50%的剩余活性。同样的,在不同浓度的丙酮溶液中 OPH@SiO2NF的稳定性也优于游离OPH 这是因为当游离OPH直接接触有机溶剂时,其内部蛋白质的高级结构中的非极性基团与极性溶剂作用,导致酶高级结构构象发生变化,使酶失活,而固定化的OPH、SiO2NF有效保护了酶分子,可以防止其构象发生变化,从而有效保持酶活性[22]。54C17866-9329-4820-953F-6EF8ACE3D55B
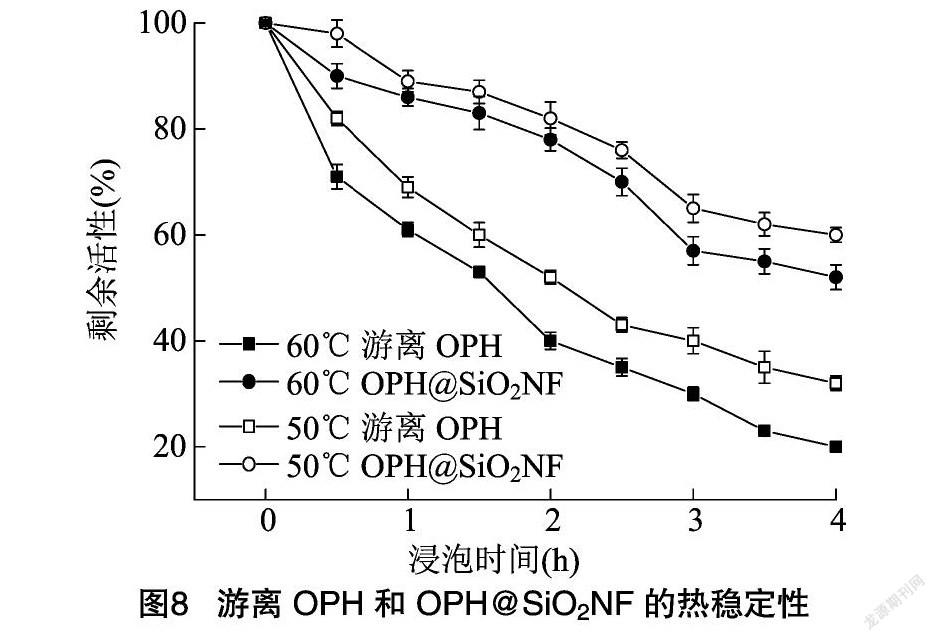
2.4.2 热稳定性 为了研究游离OPH和OPH@SiO2NF的热稳定性,将游离和固定化酶分别在50、60 ℃下孵育一段时间,再研究其剩余酶活性。由图8可见,在50、60 ℃下孵育4 h后,OPH@SiO2NF分别可以保持60.08%、52.91%的初始酶活性,而游离OPH在相同条件下分别仅能保持初始酶活性的32.83%、21.65%。试验结果表明,在高温操作条件下,固定化酶的稳定性比游离酶强,OPH@SiO2NF可以抵抗高温引发的酶分子构象变化,这可能是由于OPH酶分子与二氧化硅纳米花载体之间的静电作用[22],使酶分子长时间在高温条件下仍能保持其原有构象,从而维持较高的酶活性。
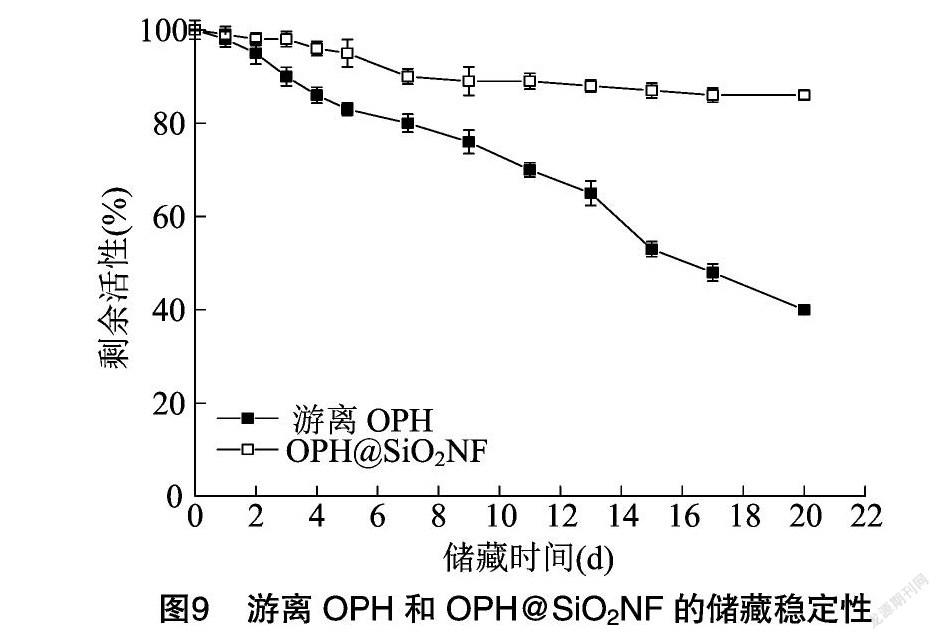
2.4.3 储藏稳定性 对游离OPH和OPH@SiO2NF的储藏稳定性进行研究,由图9可见,游离酶储藏至12 d时,仅剩余初始酶活性的50%左右;而OPH@SiO2NF储藏至20 d时,仍可保持80%以上的初始酶活性。说明固定化后的OPH稳定性得到了明显提升,这可能是由于固定在合适的载体上后,为OPH酶分子提供了适宜的微环境,并且可以抵御外界环境引发的酶构象变化,从而使OPH在较长时间内仍能维持较高的催化活性。
2.5 OPH@SiO2NF用于蔬果有机磷农药的降解性能
由于固定化酶方便回收分离再重复使用,可以有效降低酶的使用成本,因而受到广泛关注,笔者对OPH@SiO2NF在实际蔬果中的应用及重复使用性进行了研究。由图10、图11可见,OPH@SiO2NF用于苹果、卷心菜中有机磷农药的降解,在重复使用10次后,剩余酶活性都保持在65%以上,降解率保持在60%以上。说明OPH@SiO2NF具有良好的降解能力,而且重复使用性良好,多次重复使用后酶活性下降,可能由于在多次使用过程中对固定化酶回收的损失造成的。
3 结论
本研究成功制备了粒径均一、高度分散的二氧化硅纳米花,其表面分布着明显的孔道结构。利用吸附法固定化OPH,对固定化条件及固定化酶的酶学性能进行研究发现,初始酶浓度为55 mg/mL,吸附时间为16 h,酶活性为320 U/g,蛋白负载量为 51 mg/g。固定化OPH的最适温度为45 ℃,最适pH值为8,与游离OPH相比,在温度为35~55 ℃、pH值为7.5~9.0的范围内均能保持较高的催化活性,同时表现出良好的热稳定性、pH值稳定性和储藏稳定性,在真实样品中重复使用10次后,仍能保持初始活性的65%以上。由此可见,OPH@SiO2NF具有在有机磷农药降解方面的应用潜力,同时这种表面分布开放的孔道结构的二氧化硅纳米花是一种良好的固定化酶载体,为保护酶分子的高级结构提供了良好的保护,是一种十分具有发展潜力的固定化载体,可以应用于工业催化、药物递送、气体吸附等更多的领域。
参考文献:
[1] 汪德生. 微生物抗菌、降解有机磷农药研究进展[J]. 环境保护与循环经济,2015,35(5):33-36,47.
[2]贺茂芳,秦 蓓,张 博,等. 固定金属亲和磁性吸附剂对有机磷农药残留的固相萃取性能[J]. 分析科学学报,2021,37(3):351-355.
[3]Uniyal S,Sharma R K. Technological advancement in electrochemical biosensor based detection of organophosphate pesticide chlorpyrifos in the environment:a review of status and prospects[J]. Biosensors & Bioelectronics,2018,116:37-50.
[4]Zhao F N,Wu J,Ying Y B,et al. Carbon nanomaterial-enabled pesticide biosensors:design strategy,biosensing mechanism,and practical application[J]. Trends in Analytical Chemistry,2018,106:62-83.
[5]李陳娟. 浅析食用农产品农药残留检测技术应用及优化措施[J]. 食品安全导刊,2019(34):42-43.
[6]林 瑾. 果蔬中农药残留检测技术及其条件优化研究[J]. 江西化工,2019(4):118-120.
[7]毛金竹,肖淑玲,杨智淳,等. 合成生物学在农残检测领域的应用[J]. 化工学报,2021,72(5):2413-2425.
[8]高熳熳,白俊岩,孙 磊,等. 有机磷水解酶对不同有机磷农药降解功效的评价[J]. 江苏农业科学,2019,47(8):217-220.
[9]潘玉娟,尹 芳,张无敌,等. 有机磷降解剂对生菜农残降解效果分析[J]. 安徽农业科学,2015,43(32):136-138.
[10] 王丽红,张 林,陈欢林. 有机磷农药酶生物传感器研究进展[J]. 化学进展,2006,18(4):440-452.
[11]金 潇,颜冬云,秦文秀. 有机磷农药的微生物降解技术[J]. 湖南农业科学,2011(9):93-97.
[12]聂司宇,孟 昊,王淑红. 微生物对有机磷农药残留的降解[J]. 环境保护与循环经济,2020,40(3):44-49.
[13]全 爽,李 晔,金丽华,等. 有机磷水解酶及其在传感器应用中的研究进展[J]. 生态科学,2015,34(1):198-204.
[14]白俊岩,高熳熳,孙 磊,等. 有机磷水解酶对甲基对硫磷的快速降解及检测[J]. 江苏农业科学,2020,48(4):186-191.54C17866-9329-4820-953F-6EF8ACE3D55B
[15]韩 玉,瞿成良,王亚斌,等. 超小孔径树枝状介孔二氧化硅纳米球的制备和表征[J]. 人工晶体学报,2020,49(4):684-688,704.
[16]Li R,Yang J,Xiao Y Z,et al. In vivo immobilization of an organophosphorus hydrolyzing enzyme on bacterial polyhydroxyalkanoate nano-granules[J]. Microbial Cell Factories,2019,18(1):166.
[17]Wang Y B,Du X,Liu Z,et al. Dendritic fibrous nano-particles (DFNPs):rising stars of mesoporous materials[J]. Journal of Materials Chemistry A,2019,7(10):5111-5152.
[18]Jaquish R,Reilily A K,Lawson B P,et al. Immobilized glucose oxidase on magnetic silica and alumina:beyond magnetic separation[J]. International Journal of Biological Macromolecules,2018,120(A):896-905.
[19]項 云,陈 强,许 杪,等. 介孔二氧化硅纳米球孔结构及其酶固定性能[J]. 中国粉体技术,2020,5(9):66-71.
[20]庞乾辉,吴一鑫,俞丽萍,等. 整体型大孔/介孔PDA/SiO2复合材料固定化漆酶及其在染料降解中的应用[J]. 化工进展,2019,38(2):1018-1026.
[21]Nakayama K,Ishikawa S,Ohmori T,et al. Immobilization of organophosphorus hydrolase for the degradation of organophosphorus nerve agents[J]. The Journal of General and Applied Microbiology,2016,62(1):38-41.
[22]Sharifi M,Robatjazi S M,Sadri M,et al. Covalent immobilization of organophosphorus hydrolase enzyme on chemically modified cellulose microfibers:statistical optimization and characterization[J]. Reactive & Functional Polymers,2017,124:162-170.54C17866-9329-4820-953F-6EF8ACE3D55B
