红外光谱结合元素分析法研究SRB对煤的降解
2016-12-08赵广秀刘硕漆春程健明
赵广秀++刘硕++漆春++程健明


摘要:利用傅里叶红外光谱(FTIR)技术,对淮南潘二煤层煤样在接种硫酸盐还原菌(SRB)前后煤样组分的结构变化特征及规律进行研究,同时结合元素分析技术进行进一步分析。结果表明,煤样经过SRB细菌降解后,S元素、N元素均有不同幅度变化,其中,S元素均有减小的趋势,N元素有小幅度的增加趋势。C、H元素变化不明显,同时SRB细菌将煤中能降解利用的有机物降解后,煤样中含氧官能团相对含量下降、羟基官能团含量有所上升。SRB细菌的降解利用改变了煤中有机物成分含量及物质结构。
关键词:硫酸盐还原菌;煤;降解;傅里叶红外光谱;元素分析
中图分类号:TQ533.6 文献标识码:A 文章编号:0439-8114(2016)18-4671-03
DOI:10.14088/j.cnki.issn0439-8114.2016.18.013
煤炭是重要的化石燃料,在全世界的储量远大于石油。但是煤炭直接利用会引起一系列环境问题,如煤直接燃烧时会释放大量的氮化物和硫化物等有毒气体。使用传统的物理化学方法对煤进行处理后再利用,虽然可以降低煤在燃烧时释放的一些有害气体,但处理过程本身也会带来许多环境问题。因此,开发新的煤处理转化工艺非常重要。已有的研究表明,相对于物理化学方法,微生物降解煤的方法具有很多优点,如不需要高温高压、不产生环境污染等,具有很重要的意义[1]。硫酸盐还原菌(Sulfate reducing bacteria,SRB)是煤系地下水中常见的细菌类型[2-4],是一类能够通过异化作用将硫酸盐、亚硫酸盐、硫代硫酸盐等硫氧化物以及元素硫还原生成硫化氢的细菌的统称[5]。SRB是一种重要的媒介,可将环境中的硫加入到煤中,在转换过程中许多金属元素得到富集和沉淀,大量的研究也揭示了SRB在煤中元素的富集和高碳质黑色岩系金属矿床成矿的过程中具有十分重要的作用[4]。煤系地下水中SRB的生长碳源可来自对煤中一些大分子有机化合物的厌氧降解,也可以是煤自身的有机组分[6]。
傅里叶红外光谱(FTIR)是一种有效的研究煤及显微组分结构的方法,目前已被广泛应用于煤显微组分和烃源岩中干酪根化学结构的研究[7,8],是一种微区分析技术,其测试样品不受晶质和非晶质限制,在煤显微组分的研究中,依据对红外光谱图上吸收带的分析,可从中了解煤中有机质的化学结构及其变化[9]。由于红外光谱法具有分析时间短、耗样量少、不破坏样品、制作简便、测试样品不受晶质和非晶质限制等优点,所以在煤的化学结构研究中,根据红外光谱图上吸收带的分析,可从中了解煤中有机质的化学结构及其变化[10]。Rubiera等[11]采用红外法发现煤的化学结构对其燃烧特性具有极其重要的影响。在碳材料的低温氧化过程中,Koch等[12]采用红外光谱法研究发现碳材料的化学结构呈现一定的变化规律。而在中国,研究者主要借助FTIR来研究分析煤的煤化程度、煤岩组成和煤的成因类型等[10,13-17]。
本试验运用FTIR结合元素法对经SRB厌氧降解与未经SRB厌氧降解的煤样组分的结构变化特征及规律进行研究,为煤系地下水中SRB如何利用大分子有机物提供理论依据。
1 材料与方法
1.1 样品采集与预处理
1.1.1 样品采集 水样取自淮南潘北煤矿530 m深井下东一采区灰岩泄水巷内E8-2水平探水孔(终孔层位:C31-3石炭系太原组含小溶洞石灰岩层),实测涌水量0.014 L/s,水温38.4 ℃,水发臭且钻孔口密布黑色菌席。先用灭菌小塑料勺挖取孔内菌席,置于已高温灭菌的250 mm磨口玻璃瓶中,接取钻孔自流水充满后,盖紧并以PTFE胶带缠封瓶口,通过便携保温箱冰袋冷敷携带,当天送至实验室,4 ℃冷藏,其水样作为菌源。煤样取自潘二煤矿,置于HDPE袋内封口保存。
1.1.2 煤样预处理 将采集的潘二煤晾干,研碎,过200目筛,置于HDPE袋内,封口保存,待用。
1.2 仪器与试剂
1.2.1 主要仪器 Nicolet 67傅里叶红外光谱(美国Thermo Nicolet分析仪器公司),光谱范围400~12 000 cm-1,分辨率为0.09 cm-1,样品扫描次数为32 次,同时对比空白KBr片32次的背景扫描,以获得扣除背景影响的高质量光谱;元素分析仪(德国Elementar分析仪器公司);FW-4A型压片机(天津光学仪器厂);JP-150A-8高速粉碎机(永康市久品工贸有限公司);SU8020场发射扫描电子显微镜(日本日立分析仪器公司)。
1.2.2 主要试剂 KBr(光谱纯、天津光复精细化工研究所);KH2PO4、MgSO4·7H2O、FeSO4·7H2O(广东汕头市西陇化工厂);NH4Cl(天津市博迪化工有限公司);Na2SO4(上海中试化工总公司);CaCl2·6H2O、L-半胱氨酸、酵母膏、乳酸钠(国药集团化学试剂有限公司)。
1.3 SRB的富集与分离
1.3.1 培养基 常用SRB富集培养基[18]:0.5 g/L KH2PO4、1 g/L NH4Cl、4.5 g/L Na2SO4、0.06 g/L CaCl2·6H2O、2.0 g/L MgSO4·7H2O、0.5 g/L FeSO4·7H2O、 0.2 g/L L-半胱氨酸、1.0 g/L酵母膏、3 mL/L乳酸钠。
1.3.2 SRB细菌的富集与分离 采用250 mL医用盐水瓶,取200 mL SRB富集培养基,pH为7.2±0.2,置于手提式压力蒸汽灭菌锅内,0.1 MPa、121 ℃灭菌30 min,冷却至室温,其中FeSO4·7H2O、L-半胱氨酸耐热性差,采用紫外灭菌并经微孔过滤除菌加入培养基。接种10 mL水样,继续加入已灭菌的富集培养基至充满状态,用聚四氟乙烯密封,置于35 ℃电热恒温箱培养。约7 d后,培养液呈墨黑色,瓶口处散发出H2S臭鸡蛋味,表明硫酸盐还原菌已大量繁殖,即可进行单菌落厌氧分离,取单菌落重复进行稀释,为确保厌氧条件,顶部空间用N2置换后迅速用橡胶塞盖紧,并用特氟龙胶带密封,反复进行10次,获得纯菌落,作为接种源。
为观察细菌形态,对富集菌液进行离心、戊二醛固定、乙醇脱水等显微成像步骤[19],采用电子显微镜(SEM)对SRB进行拍照,获得的细菌扫描电镜照片如图1所示。
1.4 方法
1.4.1 试验组SRB的培养 常用SRB富集培养基,采用两个300 mL盐水瓶,分别取250 mL培养液至盐水瓶,调pH为7.2±0.2,置于手提式压力蒸汽灭菌锅内,0.1 MPa、121 ℃灭菌30 min,冷却至室温,其中FeSO4·7H2O、L-半胱氨酸耐热性差,采用紫外灭菌并经微孔过滤除菌加入培养基。加入10 g煤粉,接种10 mL水样,继续加入已灭菌的SRB富集培养基至充满状态,用聚四氟乙烯密封,置于35 ℃电热恒温箱培养30 d。培养完毕后取出部分煤样,在50 ℃条件下烘干,备用。
1.4.2 红外光谱测定 进行接种SRB前后煤样的傅里叶红外光谱分析,取溴化钾载体100 mg,置于玛瑙乳体中,加入少许未经SRB厌氧培养的煤样,样品与载体质量比为1∶100,充分研磨,混匀,将装好样品粉末的模具置于压片机上抽真空2 min,然后加压至90 000 N/cm3,受压10 min,将样品压成0.1~1.0 mm厚的透明薄片,用样品架固定薄片,置于红外光谱仪的样品室进行测试,则得到未经SRB厌氧培养的煤红外光谱图。
同理,取溴化钾载体100 mg,置于玛瑙乳体中,加入少许经SRB厌氧降解的煤样,样品与载体质量比为1∶100,重复上述处理步骤,则得到经SRB厌氧培养的煤红外光谱图。
1.4.3 元素分析 分别取未接种SRB煤原样、接种SRB后煤样各两份,分别编号为煤原样1、煤原样2、降解煤样1、降解煤样2,进行元素分析。使用Vario EL c元素分析仪分析煤中C、H、N、P 4种元素,结果见表1。
2 吸收峰归属及参数选择
2.1 吸收峰归属
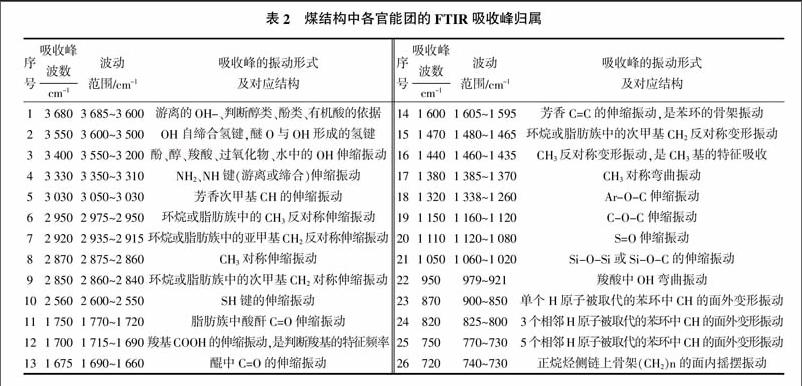
红外光谱通常以1 500 cm-1处为界将谱图分成高频区和低频区,高频区是化学键和官能团的特征频率区,而低频区反映了整个分子由于振动、转动所引起的整个分子的特征吸收峰,显微组分红外光谱特征的吸收峰主要分布在低频区。根据红外光谱学和有机化学原理,煤显微组分红外光谱主要存在3种类型吸收峰[20,21]:①脂族烷链结构吸收峰,主要有1 380~1 460、2 860、2 920、2 950 cm-1;②芳香烃结构吸收峰,主要有1 600 cm-1;③含氧、氮、硫等杂原子基团的吸收峰,主要有1 680、1 705、1 730~ 1 740 cm-1。煤结构中各官能团的FTIR吸收峰归属见表2[9]。
2.2 参数选择
根据煤(干酪根)热演化过程中的成烃特征,结合各官能团的成烃演化规律,选择以下3个红外光谱参数[22]:①富氢程度参数AM(CH2)+AM(CH3)/AM(C=C),表征脂肪烃含量多少及生烃潜力。因为2 960、2 870、2 920、2 850 cm-1就是类脂结构CH3和CH2的伸缩振动吸收峰。具体计算方法为(A2 960+A2 920+A2 870+ A2 850)/A1 600。②脂肪结构参数AM(CH2)/AM(CH3),表征脂肪链长度,此值越大,则脂肪链越长。具体计算方法为(A2 920+A2 850)/(A2 960+A2 870)。③芳构化程度参数AM(CH2+CH3)/AM(C=C),表征有机质热演化程度,此值越小,说明有机质热演化程度越高。具体计算方法为A1 460/A1 600。此处1 460 cm-1为CH2和CH3的共同贡献,反映的是芳核上的脂族结构。
3 结果与分析
3.1 红外光谱图分析
经过傅里叶红外光谱分析后,比较煤原样与接种SRB降解煤样的红外光谱见图2。
根据红外定量分析的朗伯比尔定律:
A=lg(1/T)=Kbc
式中,A为吸光度,c为吸光介质的物质浓度,b为吸收层厚度(即吸光度A与含有吸光介质的物质浓度c及吸收层厚度b呈正比),从定性分析的角度来看,FTIR谱峰的相对强度在某种程度上反映了其所含有的物质(官能团)的浓度[9]。从图2可以看出,潘二矿煤样在720~730、750~760、1 100~1 200、 1 250~1 400、1 600~2 200、3 000~3 800 cm-1等波数范围内均有较强的吸收峰,分别主要对应于正烷烃侧链上骨架(CH2)n的面内摇摆振动、5个相邻H原子被取代的苯环中CH的面外变形振动、C-O-C伸缩振动、Ar-O-C伸缩振动、羧基COOH的伸缩振动及脂肪族中酸酐C=O伸缩振动、酚、醇、羧酸、过氧化物、水中的OH伸缩振动。
为了对各种煤样4 000~400 cm-1波数区进行具体的分析,把整个红外光谱图划分为4个部分,分别为煤中的羟基吸收峰(3 600~3 000 cm-1)、脂肪烃吸收峰(3 000~2 700 cm-1)、含氧官能团吸收峰(1 800~1 000 cm-1)和芳香烃吸收峰(900~700 cm-1)。
经过SRB细菌降解30 d后,在610~630、750~800、1 125~1 450、1 600~1 630、3 000~3 200 cm-1等波数范围内吸光度有所下降,其中1 125~1 450 cm-1波数范围下降最为明显。而在3 300~3 500 cm-1波数范围内吸光度有所上升,表明SRB细菌将煤中能降解利用的有机物降解后,煤样中含氧官能团相对含量下降、羟基官能团含量有所上升。SRB细菌的降解利用改变了煤中有机物成分含量及物质结构。
3.2 元素分析
从表1可以看出,煤样经过SRB细菌降解后,S元素从均值0.904%下降到均值0.706%,平均降幅达到0.2个百分点,有减小的趋势,N元素从均值0.98%上升到均值1.02%,有小幅度增加的趋势,C、H元素变化不明显,由于样品数目偏少,需要更多的试验进行验证。
4 小结与讨论
接种SRB细菌的煤样,培养后培养基明显变黑(有FeS的生成)。
应用傅里叶红外光谱分析煤样经SRB降解前后变化,发现经SRB细菌降解的谱图其吸光度基本呈降低趋势,但降低程度有所不同,部分波段吸光度升高。
傅里叶红外光谱结合元素分析法发现,SRB降解煤样前后,元素含量有所变动,S元素有小幅度减小趋势,N元素有小幅度增加趋势,C、H等元素变动趋势尚不明显,有待进一步探究,SRB降解利用煤样后其含氧官能团相对含量下降、羟基官能团含量有所上升,初步得出SRB的降解改变了煤中有机物成分含量及物质结构,关于SRB如何利用煤炭中大分子有机物作为代谢碳源及其利用机理需进一步探究。
参考文献:
[1] 王 琴,傅 霖,辛明秀.微生物降解煤的研究及其应用[J].煤炭加工与综合利用,2009(3):38-41.
[2] WENTZEL A,LEWIN A,CERVANTES F J,et al. Deep subsurface oil reservoirs as poly-extreme habitats:A current review[J].Polyextremophiles,2013,27:439-466.
[3] HAMILTON-BREHM S D,GIBSON R A,GREEN S J,et al. Thermodesulfobacterium geofontis sp.nov.,a hyperthermophilic, sulfate-reducing bacteria isolated from Obsidian Pool,Yellow-stone National Park[J].Extremophiles,2013,17(2):251-263.
[4] 葛晓光,杨 柳,彭申华,等.一株煤矿地下水硫酸盐还原细菌的分离、鉴定及性质研究[J].合肥工业大学学报(自然科学版),2011,34(3):420-423.
[5] 蔡 靖,郑 平,张 蕾.硫酸盐还原菌及其代谢途径[J].科技通报,2009,25(4):427-431.
[6] 葛晓光,程健明,杨 柳,等. Desulfovibrio sp.厌氧代谢淮南煤中>C12有机组分的实验研究[J].地学前缘,2015,22(1):328-334.
[7] LIS G P,MASTALERZ M,SCHIMMELMANN A,et al. FTIR absorption indices for thermal maturity in comparison with vitrinite reflectance R0 in type-II kerogens from Devonian black shales[J].Organic Geochemistry,2005,36:1533-1552.
[8] 廖泽文,耿安松.沥青质傅里叶变换红外光谱(FT—IR)分析及其在有机地球化学研究中的应用[J].地球化学,2001,30(5):433-438.
[9] 李庆钊,林柏泉,赵长遂,等.基于傅里叶红外光谱的高温煤焦表面化学结构特性分析[J].中国电机工程学报,2011,31(32):46-52.
[10] 琚宜文,姜 波,侯泉林,等.构造煤结构成分应力效应的傅里叶变换红外光谱研究[J].光谱学与光谱分析,2005,25(8):1216-1220.
[11] RUBIERA F,ARENILLAS A,PEVIDA C,et al. Coal structure and reactivity changes induced by chemical demineralization[J].Fuel Processing Technology,2002,79(3):273-279.
[12] KOCH A,KRZTON A,FINQUENEISEL G,et al. A study ofcarbonaceous char oxidation in air by semi-quantitative FTIR spectroscopy[J].Fuel,1998,77(6):563-569.
[13] 张 蕤,孙旭光.新疆吐哈盆地侏罗纪煤生烃模式的红外光谱分析[J].光谱学与光谱分析,2008,28(1):61-66.
[14] 余海洋,孙旭光.江西乐平晚二叠世煤成烃机理红外光谱研究[J].光谱学与光谱分析,2007,27(5):858-862.
[15] 石金明,孙路石,向 军,等.兖州煤气化半焦表面官能团特征试验研究[J].中国电机工程学报,2010,30(5):17-22.
[16] 张守仁.造山带外缘煤的演化特性研究及应用[D].北京:中国矿业大学,2001.
[17] SUN Q L,LI W Q,CHEN H H,et al. The variation of structural characteristics of macerals during pyrolysis[J].Fuel,2003,82(6):669-676.
[18] POSTGATE J R. The Sulphate Reducing Bacteria[M].2nd Edition.UK:Cambridge University Press,1983.
[19] 谢家仪,董光军,刘振英.扫描电镜的微生物样品制备方法[J].电子显微学报,2005,24(4):440.
[20] 查 明,赵永军,毛超林. A study on hydrocarbon-generating potential and kinetics of source-rock pyrolysis[J].中国地球化学学报(英文版),1995,14(3):256-263.
[21] SARKANEN K V,LUDWIG C H. Lignins:Occurrence,Formation,Structure and Reactions[M].New York:John Wiley & Sons Inc,1971.
[22] LIN R,RITZ P G. Reflectance FT-IR microspectoroscopy of fossil algae contained in organic-rich shales[J].Applied Spectroscopy,1993,47(3):265-271.
