“模型认知”指引下的“原子结构”一课深度学习教学实践
2022-06-12陆卫星吴境柳
陆卫星 吴境柳


摘要:“原子结构”教学容易成为陈述性课堂,师生之间只进行知识的传递,缺乏学生思维的参与,无法实现深度学习。依据已有的原子结构模型知识引发学生认知冲突,激发学生进一步探索原子结构的兴趣,引导学生构建新的原子结构模型去进一步探索原子结构,实现化学素养的提升。
关键词:模型认知;原子结构
文章编号:1008-0546(2022)06x-0043-04 中图分类号:G632.41 文献标识码: B
doi:10.3969/j.issn.1008-0546.2022.06x.011
一、教材分析及教学现状
人教版《选修三》“原子结构”在编排教学内容时充分考虑了初中化学和《必修二》中原子结构知识的基础,注意知识的衔接与深化。教材不再重复建立原子结构的概念,直接建立核外电子的能层和能级的概念,给出构造原理,并依据构造原理进行核外电子排布。教材的选取注重对学生进行科学方法、科学态度的教育,利用“科学史话”中的素材激发学生的学习兴趣。但当前不少教师在进行教学设计时,由于受到高考试题的影响,主观认为学生只要学会书写基态原子的核外电子排布式即可,教学内容的处理趋于简单化,常把构造原理和能层、能级的概念直接作为知识进行讲授,学生缺乏概念的形成过程,思维参与程度低,属于低水平加工的浅层学习。
二、学情分析
经过初中与高一相关原子结构的学习,学生对于原子结构已经有了初步的认识:初步了解了原子结构与元素性质之间的关系,知道了原子核外电子是分层排布的,电子按能量由低到高的原则进行填充,会书写1-20号元素原子结构示意图。把化学作为选修科目的学生,多数对化学比较感兴趣,对于未知的原子结构知识也充满了好奇,有较强烈的探索欲望。所以教师在教学设计时,应充分考虑学生已经具有的原子结构模型知识,要让学生的原有认知和即将学习的内容之间形成一个较完整的逻辑顺序,才能使学生实现有意义的学习。
三、设计思路
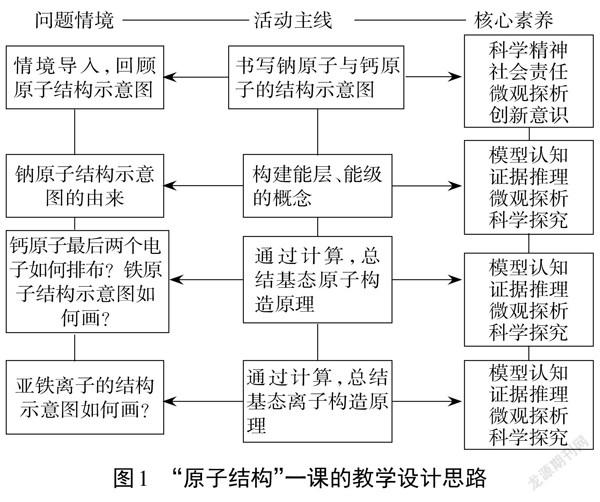
本节课以《普通高中化学课程标准2017年版2020年修订》提出的“能认识化学现象与模型之间的联系,能运用多种认知模型来描述和解释物质结构、性质和变化,预测物质及其变化的可能结果;能依据物质及变化的信息建构模型,建立解决复杂化学问题的思维框架[1]”为指导思想,以学生原有的原子结构(原子结构示意图)模型知识为起点,设计问题引发认知冲突,在教师的指导下构建新的原子结构模型来解决所遇到的新问题,然后以问题再次引发新的认知冲突,对新构建的原子结构模型进行修订,如此反复,使学生的认知水平呈螺旋式上升,实现知识的深度学习。具体设计思路见图1:
四、教学过程
活动1:情境导入,激发学习兴趣
[师]初中和高一我们已经学习过原子结构,为什么我们还要继续学习呢?我们对原子结构的了解处于什么样的水平呢?
播放“原子结构秘密”的视频。
[生]观看视频,感悟人类对微观粒子的研究还处于初级阶段,原子结构中好多秘密还没有解开,对人类来讲原子核外电子如何运动还是个迷。
[师]结合初中及高一所学,请你思考人类对原子结构的认识经历了哪些过程?
[生]通过阅读、合作讨论整理现代原子学说的发展史。
[师]1913年波尔提出原子结构模型,认为核外电子是分层排布的,在此基础上,将原子的核外电子用原子结构示意图来表示,请书写Na、Ca原子结构示意图,并思考书写的依据?
[生]展示书写的原子结构示意图,并解释书写的理由:
(1)原子核外各电子层最多容纳2n2个电子。
(2)原子最外层电子数目不能超过8个。
(3)次外层电子数目不能超过18个,倒数第三层電子数目不能超过32个。
(4)电子由内而外进行排布,能量低的排在内层。
[师]肯定学生的回答,提出 Na原子为什么第一层只能排2个电子、第二层排8个电子?根据你们熟悉的规律,Ca 原子如右所示20Ca +202891可不可以?你能书写出Fe原子的原子结构示意图吗?
[生]合作讨论,并尝试书写Fe 的原子结构示意图(几乎都错)。
[师]依据现在排布规律,我们无法解释每一层为什么排这么多的电子,也无法解释20Ca +202891为什么不这样排,也不能书写出Fe原子结构示意图,为什么呢?
[生]感觉所学的原子结构知识并不能解释遇到的问题,反思自己对原子结构的认识还不足。
[师]显然我们前面学习的核外电子排布规律并不完善,这种规律仅仅是对一些数据的总结,对原子核外电子的排布认识还不够深入,核外电子排布遵循能量最低原理进行排布是最基本的原则。
设计意图:学生原有核外电子排布规律知识是基于多电子原子核外电子排布表面现象的归纳,不能反映核外电子依据能量最低原理进行排布的原则,为了让学生认识到这种规律的局限性,设计了三个问题进行追问,引发学生的认知冲突,认识到原有的原子结构模型的不足,激发学生探究的欲望,为下面能层、能级概念的引入做铺垫。
活动2:类比学段,拨开电子层
[师]刚才提出的问题无法解决的原因是我们对原子核外电子排布的认识还不深,同一电子层电子所具有的能量一样吗?
[生]学生猜测一样或不一样。
[师]展示学段图(图2),让学生感受学段→年级→班级的层级关系。
[师]不同学段中的同一年级教师所授知识水平是否相同?相同学段的不同年级教师所授知识水平是否相同?
[生]联想与原子核外电子排布的关系。
[师]原子核外电子的排布与学段的分布非常相似。展示原子核外排布的层级关系(见图3)。87DBD9CC-F6E5-4DFA-A89F-F45BFD53A12C
[生]感受与学段相似的能层→能级→轨道的层级关系。
[师]著名科学家泡利在1925年研究得出,每个原子轨道只能容纳两个电子,请依据能层、能级、轨道的关系图,将各能级最多能填充的电子数写在下方的表格中(见表1)。
[生]合作讨论完成。
[师]现在我们再来看一下,钠原子11个电子在核外从内而外怎么排布的?
[生]学生从轨道→能级→能层排布电子,解释钠原子结构示意图的由来(见图4)。
[生]每个能层最多排多少个电子与核外电子的能级和轨道数有关。
[师]引入核外电子排布式书写方法。
[生]尝试掌握核外电子排布式的书写方法。
设计意图:利用能层、能级、轨道与学段、年级、班级的相似性,通过类比让学生初步认识原子核外电子能层→能级→轨道的层级关系,以泡利不相容原理中的每个原子轨道只能容纳两个电子为基础,学生就容易从轨道数推导出能级容纳的电子数,再从能级的角度推导能层容纳的电子数,学生在原有的基础上构建了核外电子排布——能层、能级、轨道,这一新的原子核外电子排布模型,从而顺利解释钠原子结构示意图的来源。
活动3:遵循能量最低原理,再识原子核外电子排布
[师]以推导钠原子核外电子排布的相似的方法解释钙原子的核外电子排布。
[生1]最后两个电子应填充在3d能级上,理由是电子都是由内而外进行排布的,遵循能量最低原理。
[生2]最后两个电子应填充在4s能级上,理由是如
果填充在3 d上,钙原子结构示意图为20Ca +202810,而填充在4s能级上,钙原子结构示意图为20Ca +202882。
[师]肯定学生的分析。电子填充的主要依据就是要遵循能量最低原理,电子在填充时,是3d 能级电子能量低,还是4s 能级电子能量低呢?我国著名的化学家徐光宪院士依据前人的研究成果和光谱实验数据,总结出评价原子各能级能量高低的近似规则。
展示资料卡片,让学生通过计算总结各能级高低顺序(见图5)。
[生]计算总结得出原子核外电子按1s-2s-2p-3s-3p-4s-3d-4p……各能级能量高低顺序。
[师]这就是核外电子构造原理,依据构造原理你能推出钙原子最后两个电子填充的能级吗?依据构造原理你能推出铁原子的结构示意图吗?
[生]依据构造原理解释钙原子核外电子排布,并推导出铁原子的结构示意图(见图6)
[师]你认为Fe2+的原子结构示意图应该怎么画?
[生1]认为失电子应该失去最外层电子,Fe2+的原子结构示意图26Fe2++262814。
[生2]能量高的电子活泼性强,根据刚才所学,失去的应该是3d能级上的电子,所以Fe2+的原子结构示意图26Fe2++2628122。
[师]肯定学生的分析。电子填充的主要依据要遵循能量最低原理,离子核外电子排布时,是3d能级电子能量高,还是4 s 能级电子能量高呢?徐光宪院士也总结出评价离子各能级能量高低的近似规则。
展示资料卡片(见图7)。
[生]计算总结得出离子核外电子按1s-2s-2p-3s-3p-3d-4s-4p……各能级能量高低顺序,顺利解释 Fe2+的原子结构示意图。
[师]两位同学书写24号Cr元素的核外电子排布式:甲同学:24Cr 1s22s22p63s23p63d44s2。
乙同学:24Cr 1s22s22p63s23p63d54s1。
[生]绝大多数同学认为甲同学正确。
[师]书写正确是乙同学。为什么Cr元素的核外电子排布式与构造原理不相符呢?我们将在下一课继续探讨。
设计意图:在学生已经构建原子核外能层→能级→轨道模型的基础上,用钙原子的最外层两个电子如何排布引发学生的认知冲突,使其迫切需要构建新的模型来进行解释,给出资料让学生利用原子各能级能量高低的近似规则计算得出构造原理,用构造原理构建的原子核外电子排布模型顺利解释钙原子核外电子排布和铁原子结构示意图。然后以 Fe2+的原子结构示意图书写再次引发学生的认知冲突,引导学生利用离子各能级能量高低的近似规则计算得出离子核外电子排布构造原理,顺利完成 Fe2+的原子结构示意图。最后以 Cr 元素的核外电子排布作为下一课的起点,激发学生继续探索原子核外电子排布的欲望。
五、总结反思
1.真实的问题情境使深度学习成为可能
通过呈现真实的问题情境,让学生在前概念基础上不断探究,像科学家一样进行知识建构、问题解决和反思改进,从而实现概念的改变和知识的迁移[2]。好的问题情境符合学生的认知水平,把解决问题作为外观主线的同时,还能将知识落实和能力发展作为暗线[3]。本节课设计时将原子结构示意图的由来和书写作为问题主线,在这个大问题的背景下,又设计了三个小问题,将本节课三个核心概念作为暗线(见图8),在解决这三个问题的过程中进行落实。将原子结构示意图作为问题的主线建立了新旧知识间的联系,促进学生高阶思维能力的运用,从而实现化学素养的提升。
2.基于“模型认知”的问题解决使学习走向深度
运用认知模型解决问题的过程是一个高级输出的过程,外显在认知模型中的认识方法可以内化为学生的元认知,提升学生自觉调用认识角度、自动检索思维方法、自我监控问题解决的能力[4]。本节课利用结构化的问题不断引發学生的认知冲突,激发学生构建原子核外电子模型并不断进行修正,完成从已知的原子结构示意图模型→能级轨道模型→原子构造原理模型→离子构造原理模型的构建,并能用构建的模型解决所遇到的问题。基于“模型认知”的问题解决是学生主动参与的学习,是聚焦学科本质和学科思想方法的学习,不仅能掌握学科核心知识,还能形成批判性思维,使学习走向深度。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020.
[2]刘月霞、郭华主编.深度学习:走向核心素养[M].北京:教育科学出版社,2019.
[3]陆卫星.基于“深度学习”的元素化合物的教学设计[J].中学化学教学参考,2020(6):41-43.
[4]陈进前.关于化学认识模型的思考[J].中学化学教学参考,2020(5):1-4.87DBD9CC-F6E5-4DFA-A89F-F45BFD53A12C
