黄蜀葵花总黄酮提取工艺优化及其对黄嘌呤氧化酶的抑制作用
2022-06-11徐国辉赵一灵王刚强朱湘玥黄赣辉
王 敏,徐国辉,赵一灵,王刚强,朱湘玥,黄赣辉,
(1.南昌大学食品科学与技术国家重点实验室,江西南昌 330047;2.江西省抚州市检验检测认证中心,江西抚州 344000;3.四川乐山天马晨达农业有限公司,四川乐山 614500)
黄蜀葵花(Abelmoschus Manihot(L.) Medic.)为锦葵科秋葵属草本植物黄蜀葵的花朵,原产地为我国南方的山谷草丛、田边或灌木丛旁,现除西北以及东北等地外,全国大部分地区均有分布[1]。现代研究表明,以金丝桃苷为代表的黄酮类物质是黄蜀葵花的主要功能成分[2],具有抗癌、抗疲劳、利尿等功效[3-5]。黄嘌呤氧化酶(xanthine oxidase,XOD)是人体内催化黄嘌呤和次黄嘌呤生成尿酸的关键酶[6]。人体内嘌呤含量过高会代谢产生大量尿酸,进而引发高尿酸血症,长期高尿酸血症还可诱发高血压、糖尿病、肾衰竭等疾病[7]。与一线西药相比,天然黄酮作为XOD抑制剂,更加安全、廉价。因此,提取黄蜀葵花中黄酮类物质作为保健食品或药品的原料具有较好的应用前景[8]。
目前,黄蜀葵花总黄酮的提取方法主要有乙醇回流法、超声波提取法、超临界提取等。如王鹏等[9]采用乙醇回流提取黄蜀葵花中金丝桃苷;宋健刚等[10]采用超声波法辅助提取黑果腺肋花楸果中金丝桃苷;刘可福[11]研究了超临界提取法提取银杏叶中的有效成分。但这些方法或存在能耗大,或存在提取效率不高等问题[12-14]。十二烷基硫酸钠(SDS)是一种加入少量就能显著降低液体表面张力的物质,可增加大分子有机物质的溶解渗出能力,具有良好的增溶效果。国内外已有部分科技工作者利用SDS的增溶作用,进行黄酮成分的提取研究[15-16]。如李娇等[17]研究了SDS强化柴胡皂苷的提取工艺;张馨心等[18]采用SDS强化超声波提取龙牙偬木中的齐墩果酸。但超声SDS辅助醇提取黄蜀葵花总黄酮鲜有报道。此外,黄蜀葵花提取液通常被用来研究其抗氧化、抗癌、抗疲劳等性能,目前还缺乏对其抑制XOD活性的研究。
因此,本文采用超声SDS辅助提取沐川县黄蜀葵花中的总黄酮,通过响应面优化设计,得出最佳提取条件;采用XOD体外抑制模型,测定提取液对XOD的抑制作用,为黄蜀葵花开发提供科学的数据支持。
1 材料与方法
1.1 材料与仪器
黄蜀葵花干制品 四川乐山天马山晨达农业有限公司提供,60 ℃烘干后粉碎过40目筛备用;芦丁标准品(AR) 上海源叶生物技术有限公司;亚硝酸钠(AR) 上海同试化工有限公司;无水乙醇(AR)上海振兴化工一厂;氢氧化钠(AR) 西陇化工股份有限公司;十二烷基硫酸钠 上海谱振生物科技有限公司;九水合硝酸铝(AR) 郑州派尼化学试剂厂。
FW-200高速万能粉碎机 永康市速锋工贸有限公司;SHZ-Ⅲ循环水真空泵 上海亚荣生化仪器厂;KQ-2200DP超声波清洗器 昆山市超声清洗仪器有限公司;722N紫外可见分光光度计 上海精密科学仪器有限公司。
1.2 实验方法
1.2.1 总黄酮提取工艺 黄蜀葵花→粉碎、过筛(40目)→SDS协同超声波强化提取→抽滤→减压浓缩→离心(4000 r /min)→上清液定容→测定吸光度→计算总黄酮含量
操作要点:将粉碎好的粉末分级过筛以保证粉末大小的均一性,直至得到40目的黄蜀葵花粉末。准确称取2.50 g该粉末于锥形瓶中,并加入70%乙醇溶液和适量SDS,经搅拌均匀后进行超声提取。抽滤时,应尽量使待过滤物质处于布氏漏斗中央,防止其未经过滤,直接通过漏斗和滤纸之间的缝隙流下。将抽滤所得浓缩液用60%乙醇定容至50 mL容量瓶中,再用移液枪吸取5 mL样液于25 mL容量瓶中测定总黄酮含量。
1.2.2 单因素实验 以总黄酮含量为指标,依次改变料液比、超声波功率、十二烷基硫酸钠(SDS)浓度、提取温度和提取时间。确定黄蜀葵花总黄酮提取的最适范围,计算总黄酮含量[12,19]。单因素实验设计如下:
1.2.2.1 不同料液比对总黄酮含量的影响 设置料液比1:20、1:30、1:40、1:50、1:60 g/mL,超声波功率320 W,SDS浓度为0.04 g/mL,提取温度50 ℃,提取时间50 min提取黄蜀葵花中总黄酮。将提取液抽滤、减压浓缩、离心(4000 r/min)后,用60%乙醇定容到50 mL容量瓶中。用移液枪吸取5 mL样液于25 mL容量瓶中,计算总黄酮含量。
1.2.2.2 不同超声波功率对总黄酮含量的影响 设置超声波功率240、280、320、360、400 W,料液比1:40 g/mL,SDS浓度为0.04 g/mL,提取温度50 ℃,提取时间50 min提取黄蜀葵花中总黄酮,计算总黄酮含量。
1.2.2.3 不同SDS浓度对总黄酮含量的影响 设置SDS浓度为0.02、0.03、0.04、0.05、0.06 g/mL,料液比1:40 g/mL,超声波功率320 W,提取温度50 ℃,提取时间50 min提取黄蜀葵花中总黄酮,计算总黄酮含量。
1.2.2.4 不同提取温度对总黄酮含量的影响 设置提取温度30、40、50、60、70 ℃,料液比1:40 g/mL,超声波功率320 W,SDS浓度为0.04 g/mL,提取时间50 min提取黄蜀葵花中总黄酮,计算总黄酮含量。
1.2.2.5 不同提取时间对总黄酮含量的影响 设置提取时间30、40、50、60、70 min,料液比1:40 g/mL,超声波功率320 W,SDS浓度为0.04 g/mL,提取温度50 ℃提取黄蜀葵花中总黄酮,计算总黄酮含量。
1.2.3 响应面优化黄蜀葵花总黄酮的提取工艺 依据单因素实验结果,固定提取温度60 ℃,提取时间60 min,选取料液比、超声波功率、SDS浓度3个因素为自变量(分别用A、B、C表示),以黄蜀葵花总黄酮含量为评价指标进行分析,根据中心组合(Box-Behnken)试验设计原理,采用三因素三水平的响应面分析方法设计实验,因素与水平编码表见表1[20-25]。
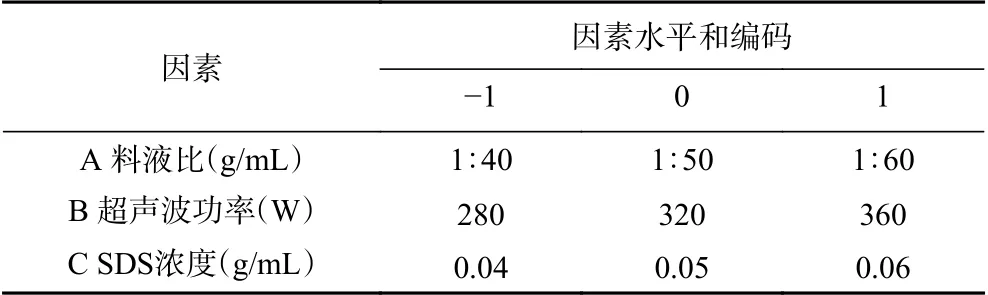
表1 响应面试验因素水平设计Table 1 Response surface test factor level design
1.2.4 标准曲线绘制 精确称量芦丁标准品12 mg,60%乙醇溶解后定容于50 mL容量瓶,摇匀备用。用移液枪精确吸取0、1.0、2.0、3.0、4.0、5.0 mL标准溶液,分别置于25 mL容量瓶中,加水至5 mL,分别加入1.0 mL 5% NaNO2溶液,摇匀静置6 min;加入1.0 mL 10% Al(NO3)3溶液,摇匀静置6 min;加入10.0 mL 10% NaOH溶液;最后用60%乙醇定容至刻度,摇匀放置15 min,510 nm处进行吸光度测定[26]。以吸光度(A)作为纵坐标,芦丁的质量浓度(C,mg/mL)作为横坐标,绘制标准曲线,得回归方程A=2.4693C-0.0071,R2=0.99932。
1.2.5 总黄酮含量的测定和计算 用移液枪吸取5 mL不同条件下所得的样液于25 mL容量瓶中,参照绘制标准曲线的步骤测定吸光度,结合标准曲线方程和公式(1),即可得到总黄酮含量[16]。
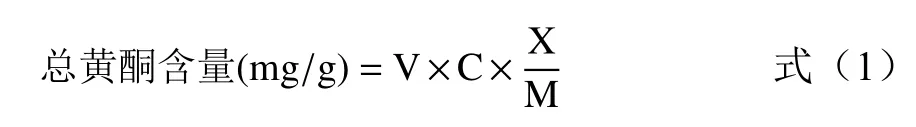
式中:V—提取液的体积,mL;C—总黄酮测定样品溶液浓度,mg/mL;X—总黄酮提取液稀释的总倍数;M—每次提取加入的样品质量,g。
1.2.6 总黄酮对XOD的抑制作用 参照Yan等[8]的方法,并作适当修改。将稀释后的不同浓度梯度的黄蜀葵花提取液与黄嘌呤(2 mmol/L)和XOD(50 μL,0.5 U/mL)进行混合。孵育10 min后加入NaOH(100 μL,1.0 mol/L)终止反应。利用紫外分光光度计在295 nm处测定吸光值。抑制率为计算公式(2):

式中:A1—空白体系;A2—样品组。
1.3 数据处理
根据Design-Expert 8.0.6软件,设计响应面试验方案、建立数学模型并进行多元回归分析,选择最佳提取工艺参数,并使用SPSS软件对实验数据进行ANOVA方差分析。
2 结果与分析
2.1 单因素实验
2.1.1 料液比对总黄酮含量影响 料液比对黄蜀葵花总黄酮含量的影响见图1,考察料液比范围为1:20~1:60 g/mL,结果表明,料液比对黄酮含量的影响较显著(P<0.05)。当料液比低于1:50 g/mL时,随着料液比的增大,总黄酮含量不断增加。这是因为料液比增加使得溶液与黄蜀葵花接触面积增大,黄酮类物质溶解更加充分[27]。而当料液比大于1:50 g/mL时,随着料液比的增大,总黄酮含量反而下降。这是因为料液比过高时溶液中微粒样品受到超声波的热效应和空化作用会减弱[28]。因此,料液比选择1:50 g/mL为宜。

图 1 料液比对总黄酮含量的影响Fig.1 Effect of solid/liquid ratio on the content of total flavonoids
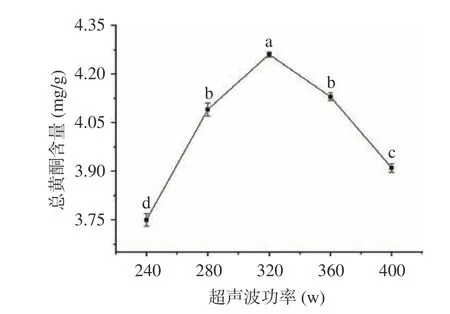
图 2 超声波功率对总黄酮含量的影响Fig.2 Effect of ultrasonic power on the content of total flavonoids
2.1.2 超声波功率对总黄酮含量的影响 超声波功率对黄蜀葵花总黄酮含量的影响见图2,考察超声波功率范围为240~400 W,结果表明,超声波功率对总黄酮含量有影响,且不同小写字母间表示影响极显著(P<0.01)。随着超声波功率的增大,总黄酮含量呈先上升后下降的趋势。当超声波功率为320 W时,总黄酮含量达到最大,因此选择最佳的提取功率为320 W。总黄酮含量随超声波功率增加先升高后降低,原因可能是由于超声波功率增加,超声所产生的机械振动作用导致植物组织细胞破碎越来越完全,故总黄酮含量随着超声波功率的增加而升高,但是,超声波功率过大时,因热效应和空化效应,破坏了黄蜀葵花总黄酮的结构,造成含量下降[14]。
2.1.3 SDS浓度对总黄酮含量的影响 SDS浓度对黄蜀葵花总黄酮含量的影响见图3,考察SDS浓度范围为0.02~0.06 g/mL,结果表明,SDS浓度对黄酮含量有影响,且不同小写字母间表示影响极显著(P<0.01)。当SDS浓度小于0.05 g/mL,总黄酮含量随SDS浓度增大而增加,其原因可能是SDS浓度太小未达到临界胶束浓度[12],造成提取不完全。当SDS浓度大于0.05 g/mL时,总黄酮含量随SDS浓度增大反而减小,原因可能是过量的SDS产生较粗大的乳液泡沫,对提取及过滤操作产生了反作用[29]。因此SDS浓度选取0.05 g/mL为宜。

图 3 SDS浓度对总黄酮含量的影响Fig.3 Effect of SDS concentration on the content of total flavonoids
2.1.4 提取温度对总黄酮含量的影响 提取温度对黄蜀葵花总黄酮含量的影响见图4,在30~70 ℃的升温考察过程中,提取温度为40 ℃时黄酮含量变化较大,大于40 ℃时曲线总体比较平缓,说明提取温度对黄酮含量的影响不明显。当提取温度低于50 ℃时,随温度升高总黄酮含量增加较快,这可能是因为高温使溶剂粘度降低,分子运动加快,从而加快黄酮类物质的溶出[15]。在提取温度50~60 ℃时,随温度升高总黄酮含量缓慢增加,当提取温度高于60 ℃时,随温度升高总黄酮含量反而有下降的趋势,原因可能是温度过高使得黄酮类化合物氧化,破坏了黄酮类化合物结构[16]。因此选择60 ℃为最适温度。
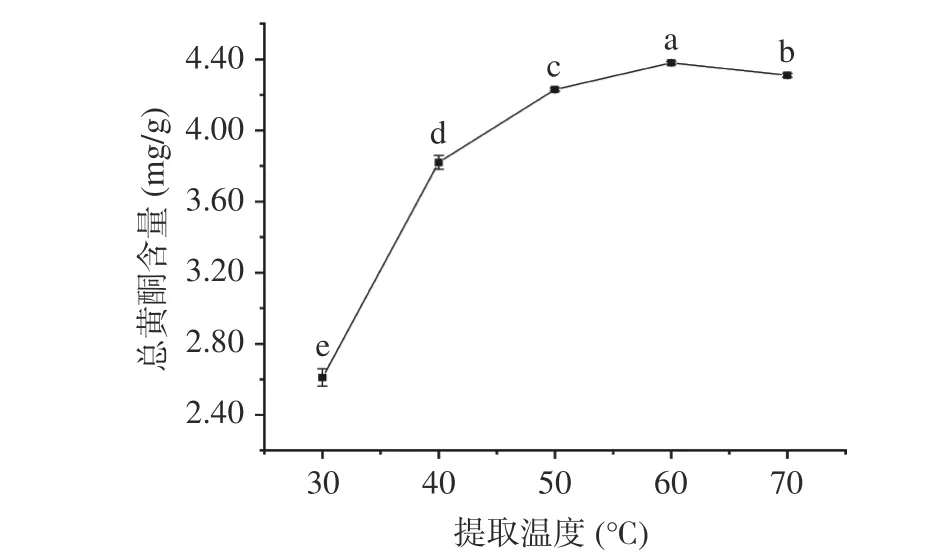
图 4 提取温度对总黄酮含量的影响Fig.4 Effect of extraction temperature on the content of total flavonoids
2.1.5 提取时间对总黄酮含量的影响 提取时间对黄蜀葵花总黄酮含量的影响见图5,考察时间为30~70 min,提取时间为40 min时黄酮含量变化较大,大于40 min时曲线总体比较平缓,说明提取时间对黄酮含量的影响不显著。当提取时间小于60 min时,随着提取时间的增加总黄酮含量不断增大。当提取时间大于60 min时,总黄酮含量略有下降。原因可能是,过长的超声波时间会导致部分黄蜀葵花黄酮发生氧化作用,因损耗致使总黄酮含量略有下降[15]。因此,选择60 min作为最佳提取时间。
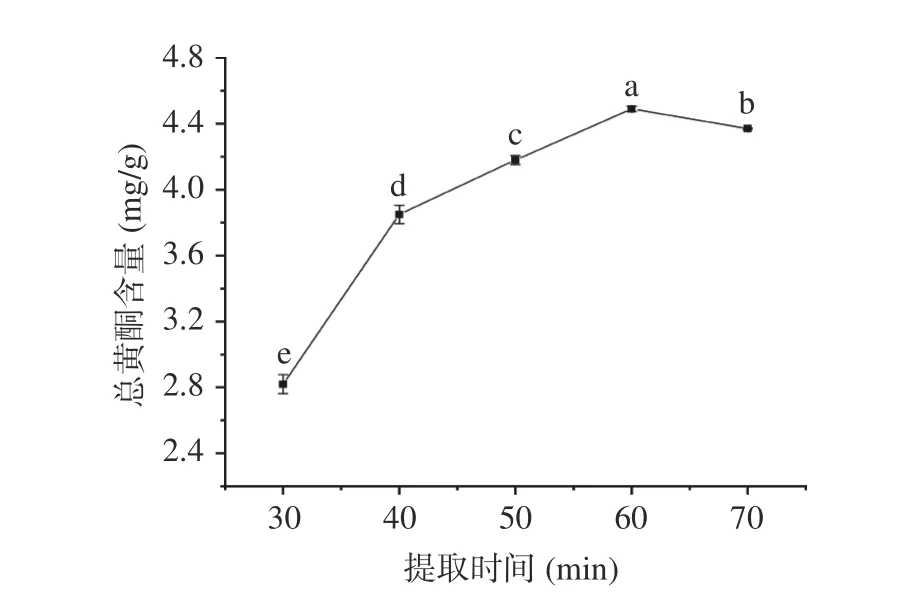
图 5 提取时间对黄酮含量的影响Fig.5 Effect of extraction time on the content of total flavonoids
2.2 响应面法优化黄蜀葵花总黄酮的提取条件
2.2.1 模型组合设计及方差分析 响应面的试验方案及结果见表2,方差分析结果见表3。采用软件Design-Expert 8.0.6进行多元回归拟合,得到总黄酮含量(Y)对各项因素的二次多项回归方程为:Y=4.58-0.087A+0.048B-0.12C+0.026AB+0.15AC+0.22BC-0.33A2-0.21B2-0.35C2。方程的模型显著性P<0.05,说明模型具有意义;失拟项P>0.05,说明失拟项差异不显著,试验无失拟因素存在。模型调整系数R2Adj=0.8935,决定系数R2=0.9534,响应值的变化有95.34%来源于所选因素,模型与试验拟合程度好,试验误差较小。因此,该模型对黄蜀葵花总黄酮的提取工艺是有意义的。由方差分析F值可知,对黄蜀葵花总黄酮含量影响因素的主次顺序为SDS浓度(C)>料液比(A)>超声波功率(B)。其中C、AC对总黄酮含量的影响显著(P<0.05),BC、A2、B2、C2对总黄酮含量的影响极显著(P<0.01),A、B、AB对总黄酮含量的影响不显著(P>0.05)。

表2 响应面试验设计及结果Table 2 Response surface test design and results
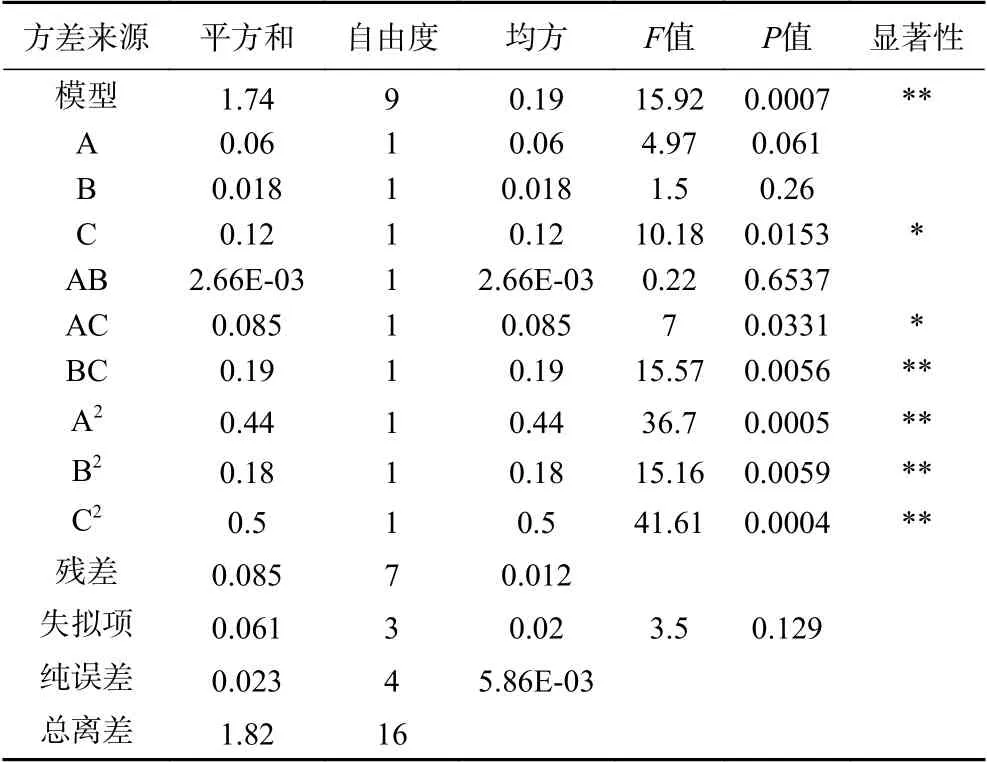
表3 响应面试验方差分析结果Table 3 Variance analysis of response surface test
2.2.2 交互作用分析 料液比和超声功率响应面及等高线见图6(A)和图6(B)。由图6(A)和图6(B)可知,料液比曲面比超声功率曲面坡度陡峭,即固定其他因素不变,改变料液比对黄蜀葵花总黄酮含量影响较超声功率大;料液比和超声功率等高线接近于圆形,表明两因素的交互作用不显著[30]。料液比和SDS浓度响应面及等高线见图6(C)和图6(D)。由图6(C)和图6(D)图可知,SDS浓度曲面比料液比曲面坡度陡峭,即固定其他因素不变,改变SDS浓度对黄蜀葵花总黄酮含量影响较料液比大;料液比和SDS浓度等高线图于椭圆,且椭圆与两轴之间略有角度,表明两因素的交互作用显著[30]。超声功率和SDS浓度响应面及等高线见图6(E)和图6(F)。由图6(E)和图6(F)可知,SDS浓度曲面比超声功率曲面坡度陡峭,即固定其他因素不变,改变SDS浓度对黄蜀葵花总黄酮含量影响较超声功率大;超声功率和SDS浓度等高线图趋于椭圆,且椭圆与两轴之间夹角较大,表明两因素的交互作用极显著[30]。以上结果与回归方程及方差分析结果一致。
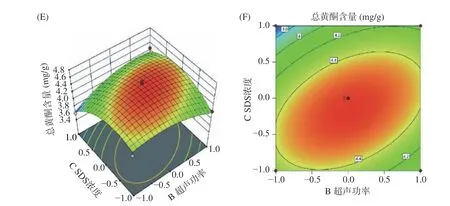
图 6 各因素对黄蜀葵花总黄酮的响应面三维图和等高线图Fig.6 Response surface plots showing influences of variables on the total flavonoid yield of Abelmoschus manihot
2.2.3 提取工艺条件的验证 采用响应曲面分析可得黄蜀葵花总黄酮最优提取条件:料液比1:48.16 g/mL,超声波功率319.51 W,SDS浓度0.05 g/mL,预测值为4.60 mg/g。将提取条件调整为:料液比1:48 g/mL,超声波功率320 W,SDS浓度0.05 g/mL。根据调整后的提取条件,进行5次验证试验,得出总黄酮含量为4.63 mg/g。

2.3 总黄酮对XOD的抑制作用
黄蜀葵花总黄酮提取液在稀释一定倍数后,与相同浓度下的SDS对照,所得提取液对XOD的抑制效果如图7所示。由图7可知,当抑制剂浓度为0.38~1.92 mg/mL时,总黄酮提取液对XOD的抑制作用明显大于仅含SDS的空白溶液,且随着抑制剂浓度的增加,总黄酮的抑制能力逐渐趋于平缓,最大抑制率可达98.35%。该实验结果可以推测出,黄蜀葵花中的黄酮类物质具有良好的抑制XOD活性的作用。
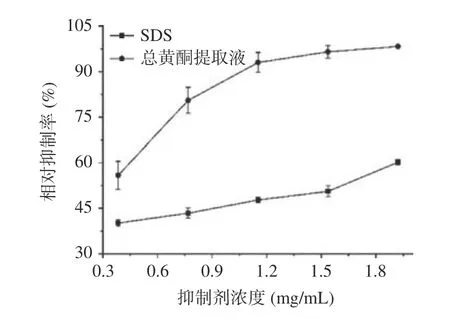
图 7 不同抑制剂浓度对XOD的抑制效果Fig.7 Inhibition effect of different inhibitors concentration on XOD
3 结论
本实验以SDS协同超声波提取黄蜀葵花总黄酮,在单因素基础上,用响应面分析法对其提取工艺参数进行优化。确定黄蜀葵花总黄酮的最佳提取工艺条件为:料液比1:48 g/mL,超声波功率320 W,SDS浓度0.05 g/mL。在此条件下对黄蜀葵花中总黄酮进行提取,含量为4.63 mg/g。SDS是一种阴离子表面活性剂,能使溶液的表面张力显著降低,对物料具有界面吸附和分散作用,可以增强溶剂对物料的润湿性和渗透性,加之超声波的空化作用、机械效应和热效应,从而增加了黄酮的溶出、提高了提取率、降低了提取时间,该方法操作简单可行,为黄蜀葵花总黄酮提取提供了一定的参考价值。此外,应用XOD体外抑制模型,总黄酮提取液对XOD的抑制率高达98.35%,由此可推测黄蜀葵花总黄酮具有良好的抑制XOD活性的作用,这为后期研究具体有效成分作为缓解高尿酸血症的膳食来源提供了理论基础。
