紫草素的抗癌作用机制研究进展
2022-06-11王俊玲李宏伟杨春菊高永刚高雁鸿
王俊玲,李宏伟,杨春菊,高永刚,高雁鸿
紫草素是传统中药紫草中一种重要的活性成分。近年来,国内外对紫草素抗癌作用机制的研究已逐渐深入,并取得了较大进展。本研究以“紫草抗癌”“shikonin anti-cancer”“zicao anti-cancer”等 为关键词,在PubMed和中国知网等数据库,检索时间为建库至2020年7月31日,共检索到有关文献714篇,其中有效文献205篇。以下从紫草素抑制细胞增殖和迁移,诱导细胞自噬、凋亡、坏死和细胞免疫等5个方面,综述其抗癌作用最新研究进展。
1 紫草素的来源及其衍生物
紫草是我国传统常用中药材,始载于《神农本草经·中品·草部》,用于治疗感染、炎症和出血性疾病已有两千多年历史[1]。据中国药典记载,紫草素提取自紫草科紫草属(Lithospermum)、软紫草属(Ar⁃nebia)以及滇紫草属(Onosma)植物的根部,其味甘、咸,性寒,归心、肝经,具有清热凉血、活血解毒,透疹消斑等功能,用于血热毒盛,斑疹紫黑,麻疹不透,疮疡,湿疹,水火烫伤[2]。《滇南本草》也载有“滇紫草”,为云南众多少数民族习用药物,被收录于《云南省中药材标准》中[3]。
现代药学研究发现紫草化学成分复杂,含有多种活性成分:萘醌类、单萜苯醌、有机酸、萜类、甾体类、香豆素、内酯、黄酮类、苯酚类和酚酸类以及多糖类等。萘醌类化合物是紫草中主要的活性成分,至今人们已从紫草根中分离到30余种,其中最具药用价值且报道最多的是以紫草素类(Shikonins)或其对映异构体阿卡宁类(Alkannins)为代表的萘醌类化合物,包括11种常见的紫草素类化合物:紫草素、去氧紫草素、甲基紫草素、乙酰紫草素、丙酰紫草素、异丁酰紫草素、异戊酰紫草素、β-羟基异戊酰紫草素、β-乙酰氧基-异戊酰紫草素、α-甲基-正丁酰紫草素、β-β'-二甲基丙烯酰紫草素。紫草素的生物活性多样,具有抗炎、镇痛、抗癌、抗病原微生物、抗血栓、抗氧化、创伤修复、降血糖、免疫调节、抗生育、止血、保肝等药理药效作用[4]。而紫草素及其衍生物的抗癌活性突出,是目前研究的热点和重点。
2 紫草素的抗癌作用机制
大量研究证实紫草素对多种癌症(例如:白血病、胃癌、胰腺癌、肺癌、乳腺癌、卵巢癌、黑色素瘤、鼻咽癌、肝癌、肾癌、宫颈癌和膀胱癌等)有强效的抑制作用[5],其作用机制主要包括:通过多种分子途径抑制细胞增殖、迁移和侵袭,诱导细胞凋亡、坏死以及细胞免疫,见图1。
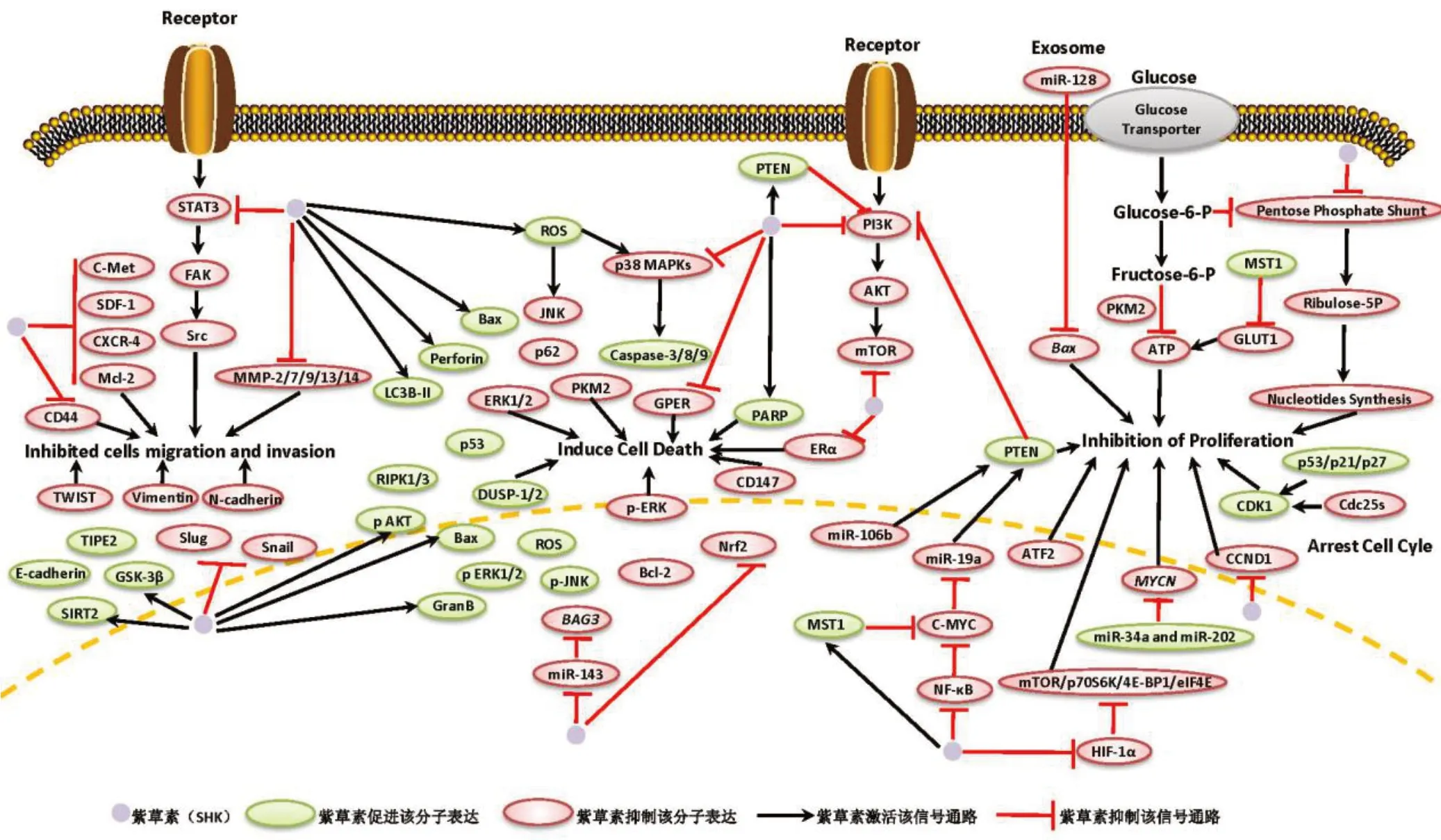
图1 紫草素抗癌分子机制信号通路
2.1抑制细胞增殖抑制细胞增殖是紫草素抗癌作用的主要机制,紫草素通过诱导细胞周期阻滞,抑制糖代谢、丙酮酸激酶M2(PKM2)、微小RNA(mi‐croRNA,miRNA/miR)、骨髓细胞瘤病毒癌基因(CMYC)和转录激活因子-2(ATF-2)等多种分子发挥其抗癌细胞增殖效应。
2.1.1诱导细胞周期阻滞 双特异性蛋白磷酸酶(Cdc25s)肩负激活其天然底物细胞周期蛋白依赖性激酶1(CDK1)的重大责任,在细胞周期进程中发挥重要作用,过量Cdc25s促进肿瘤生长和细胞恶性转化,分别在白血病细胞K562、乳腺癌细胞MCF-7和宫颈癌细胞HeLa中研究发现,紫草素对Cdc25s具有不可逆的抑制作用,进而诱导第15位酪氨酸磷酸化CDK1积累,将细胞阻滞在DNA合成后期(G2期)/有丝分裂期(M期),在K562荷瘤小鼠中紫草素也表现出较强的抑制肿瘤生长的活性[6]。磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)信号通路在肿瘤维持中起中枢调节作用,经紫草素处理的人肺成纤维细胞,磷酸化AKT水平显著降低,53 kDa的核内磷酸化蛋白(p53)、细胞周期蛋白依赖性激酶抑制因子(p21)和周期素依赖性激酶抑制蛋白(p27)等抑癌蛋白的水平显著升高,CDK1去磷酸化受到抑制,细胞周期阻滞于DNA合成前期(G1期)和G2/M期[7]。p38促分裂原活化的蛋白激酶(p38 MAPK)作用于多条信号通路,阻滞细胞于不同周期,抑制细胞增殖,紫草素衍生物通过激活p38/丝裂原活化蛋白激酶的激酶2(MK2)信号通路,诱导小鼠恶性黑色素瘤细胞周期阻滞,抑制癌细胞增殖[8]。
2.1.2抑制糖代谢途径 有研究认为癌症是一种代谢异常疾病[9],病人体内代谢物水平反映了癌细胞的基因变异、基因表达、代谢途径活性和酶动力学,近年来使用代谢组学研究紫草素抗癌机制成为一种新趋势,研究人员采用高通量筛选方法评估了136种天然化合物,确定二甲氨基-小白菊内酯(Di‐methylamino-parthenolide,DMAPT)和紫草素能有效抑制原代和永生化白血病细胞增殖,导致细胞死亡,而对正常细胞的影响微不足道[10]。进一步研究发现DMAPT和紫草素协同作用减少了糖酵解中间产物向磷酸戊糖途径的分流,抑制了谷氨酰胺及其衍生代谢物与嘌呤、嘧啶核苷酸的合成,阻碍白血病细胞增殖,减轻联合化疗药物的毒性和副作用。河马(Hippo)信号通路在器官生长、干细胞稳态、癌症发生发展等一系列过程中发挥重要作用,紫草素通过调节Hippo信号通路哺乳动物不育系20样激酶1(MST1)-Yes相关蛋白1(YAP1)-转录增强相关结构域1(TEAD1)轴,激活MST1,诱导YAP1的降解,减弱YAP1-TEAD1相互作用,抑制C-MYC和葡萄糖转运蛋白1(GLUT1)基因表达,减少乳酸产生,阻断癌细胞糖酵解途径,抑制细胞增殖[11]。
2.1.3PKM2 PKM2是肿瘤细胞有氧糖酵解的关键酶,Li等[12]报道抑制PKM2可导致胞内腺苷三磷酸(ATP)减少,调控细胞周期。在肝癌细胞LM3、SMMC-7721、Huh-7和HepG2中,紫草素通过抑制细胞周期蛋白D1(cyclin D1)/细胞周期蛋白依赖性激酶4(CDK4)/细胞周期蛋白依赖性激酶6(CDK6)表达和PKM2合成,减少ATP释放,阻滞细胞周期由G1期向DNA合成期(S期)转变,缩小荷瘤小鼠肿瘤体积,增强索拉菲尼抗肿瘤效果。缺氧诱导因子-1α(HIF-1α)在肿瘤细胞增殖调控中也起重要作用,可激活多个涉及肿瘤生物学关键环节的靶基因,包括血管生成、葡萄糖代谢、细胞增殖和凋亡,在食管癌细胞EC109和EC9706中研究发现,紫草素通过抑制HIF-1α/PKM2/cyclin D1信号通路控制食管癌细胞增殖[13]。在结直肠癌细胞中,紫草素也表现出对HIF-1α蛋白合成的抑制作用,减弱哺乳动物雷帕霉素靶蛋白(mTOR)/p70核糖体蛋白S6激酶(p70S6K)/真核翻译起始因子4E结合蛋白1(4EBP1)/真核翻译起始因子4E(eIF4E)信号通路下游激酶的活性,阻滞细胞周期于G1/S期[14]。在乳腺癌细胞MCF-7和MDA-MB-231中,紫草素降低PKM2激酶活性,在荷瘤小鼠中也证实紫草素作为佐剂缩小了肿瘤体积,延长了患癌小鼠存活时间[15]。
2.1.4miRNA miRNA是一种非编码的单链RNA,具有18~24个核苷酸,能在转录后水平上调节基因表达,已有研究证明,许多miRNA在各方面均与肿瘤的发生和发展有关[16]。原癌基因MYCN(编码转录因子N-MYC)的扩增是造成视网膜母细胞瘤的原因之一,miR-34a和miR-202与特定3′非翻译区(3′-UTR)序列结合下调MYCN基因表达,有效抑制癌细胞增殖,Su等[17]报道紫草素具有上调miR-34a和miR-202表达的效应。miR-106b在癌前病变发挥作用,有研究证实紫草素通过下调miR-106b表达阻断第10号染色体同源丢失性磷酸酶-张力蛋白(PTEN)/AKT/mTOR信号通路抑制子宫内膜样癌细胞增殖[18]。miR-128的靶基因是B细胞淋巴瘤-2(Bcl-2)相关X蛋白(Bax),为线粒体凋亡途径的关键效应因子,Wei等[19]的研究结果表明:紫草素通过抑制肿瘤来源外泌体中miR-128的释放,下调编码Bax基因表达,抑制乳腺癌细胞MCF-7增殖。
2.1.5C-MYC C-MYC是一种转录因子,可以与MYC关联因子X(MAX)二聚化,结合DNA并调节涉及细胞获取营养的基因表达,产生ATP以及合成细胞所需的原料。在癌症中,表观遗传的改变使得细胞周期和免疫检查点紊乱,促进了C-MYC对细胞生长和增殖的调控作用。伯基特氏(Burkitt)淋巴瘤(BL)的主要分子特征即是C-MYC原癌基因表达失控,紫草素能以剂量依赖的方式显著抑制Raji和Namalwa细胞中C-MYC表达。miR-19a是受C-MYC上调的癌基因,它能下调第10号染色体同源丢失性磷酸酶-张力蛋白9(PTEN9)导致PI3K/AKT通路激活,紫草素下调BL细胞中C-MYC和miR-19a表达,负向调控PTEN的表达,降低PI3K亚基p110α的表达,使AKT在丝氨酸(Ser)473位磷酸化,抑制PI3K活性。此外,紫草素还能抑制mTOR蛋白复合体1(mTORC1)Ser2448、p70核 糖 体 蛋 白S6激 酶(p70S6K)和mTOR蛋白复合体2(mTORC2)Ser2481位点的磷酸化作用,减少mTOR蛋白表达,促进癌细胞凋亡[20]。在白血病细胞NB4中,紫草素通过下调C-MYC表达诱导细胞周期阻滞抑制细胞增殖。在人结直肠癌细胞HCT116和SW480中,紫草素通过降低C-MYC和cyclin D表达诱导细胞周期阻滞于G1期,抑制肠癌细胞增殖。YAP1与MST1协同负向调节C-MYC,而紫草素则能激活MST1从而抑制C-MYC表达。Wiench等[21]研究发现,紫草素抑制C-MYC表达和转录活性与细胞外调节蛋白激酶(ERK)、c-Jun氨基末端激酶(JNK)、MAPK和AKT失活密切相关。
2.1.6ATF-2 ATF-2是一种序列特异性DNA结合蛋白,属于bZIP蛋白家族,能在应激条件下激活多个靶基因。尽管已有许多报道证明紫草素能够抑制PKM2的活性,但在化学制剂诱导的小鼠皮肤癌模型中,紫草素不具备抑制PKM2的作用,然而紫草素可通过抑制ATF-2及其下游分子CDK4和原癌基因Fos相关抗原1(Fra-1)的表达抑制细胞增殖和肿瘤生长[22]。紫草素在ATF-2中的作用鲜有报道,可以更进一步研究紫草素抑制ATF-2信号通路的分子机制,为紫草素抗癌机制提供新视野。
2.2诱导细胞死亡细胞死亡可以通过凋亡、坏死性凋亡和自噬3种途径发生。细胞凋亡或程序性细胞死亡是一种细胞自然死亡的方式。在癌症中,激活抑制细胞凋亡信号通路可使癌细胞逃逸细胞凋亡程序,从而导致癌细胞不受控制地增殖,继而引发肿瘤增大、治疗耐药和癌症复发。许多抗癌疗法通过诱导细胞死亡及其相关的信号通路网络发挥作用,紫草素也不例外,相关机制如下。
2.2.1抑制PI3K/AKT/mTOR信号通路 紫草素诱导癌细胞凋亡机制之一是通过抑制PI3K/AKT/mTOR信号通路来实现的,这是一条相对独立而复杂的途径:mTOR调节癌细胞合成代谢,驱动核糖体和核苷酸的生物合成,抑制这一过程会导致核苷酸耗尽、DNA损伤和细胞毒性。在鼻咽癌细胞中,紫草素能有效抑制细胞葡萄糖摄取和ATP产生,使PI3K/AKT/mTOR信号通路相关蛋白表达减少。紫草素还能下调人结肠癌细胞HT29和DLD-1中PI3K、磷酸化磷酸肌醇3激酶(p-PI3K)、AKT、磷酸化蛋白激酶B(p-AKT)(Thr308)和mTOR蛋白的表达,促进细胞凋亡;在DLD-1荷瘤小鼠体内紫草素同样能降低PI3K/AKT/mTOR信号通路相关蛋白表达,减轻肿瘤组织重量[23]。PI3K/AKT信号通路的异常激活导致阿法替尼耐药,紫草素通过负向调控PI3K/AKT激活凋亡信号通路,抑制非小细胞肺癌耐药细胞株增殖,诱导其凋亡。在慢性粒细胞白血病K562细胞中,紫草素升高K562细胞中PTEN水平,导致PI3K/AKT信号通路失活,Bax表达上调,促进中性粒细胞凋亡[24]。
2.2.2MAPKs信号通路 促分裂原活化的蛋白激酶(MAPKs)信号可以保护或增强细胞凋亡的敏感性,MAPKs家族由3个成员组成:细胞外信号调节激酶(ERK)、c-Jun氨基端蛋白激酶(JNK)和p38MAPKs。p38 MAPK和JNK与细胞凋亡有关,ERK与细胞生存有关。Shan等[25]研究表明:紫草素显著增加p38 MAPK和JNK磷酸化,抑制ERK磷酸化,调节MAPKs信号通路诱导癌细胞凋亡。在紫草素处理的乳腺癌细胞MCF-7、SK-BR-3、MDA-MB-231中使用转录组测序发现,紫草素可诱导双特异性磷酸酶(DUSP)-1和DUSP-2表达,诱导细胞周期阻滞和凋亡。紫草素还能上调磷酸化的JNK(pJNK)表达,启动胆囊癌细胞线粒体依赖性凋亡程序。在胆管癌细胞RBE中,紫草素诱导活性氧介导JNK活化[26]。在口腔癌细胞Ca9-22中,乙酰紫草素处理后诱导活性氧的产生,增强JNK和p38 MAPK磷酸化作用,诱导癌细胞凋亡[27]。
2.2.3活性氧 氧化应激对于肿瘤的发生发展来说是一把双刃剑。正常情况下,高水平的活性氧对细胞是有害的,然而癌细胞的氧化还原状态通常与正常细胞不同,由于代谢和细胞信号转导的异常,癌细胞通常表现出较高的活性氧水平,这会引起癌细胞凋亡和坏死。在乳腺癌细胞MCF-7和MDAMB-435S中,紫草素通过降低线粒体膜电位,提高细胞内活性氧水平,协同促进细胞凋亡。在胆管癌细胞RBE和口腔癌细胞Ca9-22细胞中,紫草素均能诱导活性氧产生[27]。在胃癌细胞AGS(p53野生型)和Kato 3(p53缺失型)中,紫草素处理后抑制转录因子NF-E2相关因子2(nuclear factor E2 related factor 2,Nrf2)表达,诱导p53表达和活性氧产生,使细胞内JNK活性显著升高,刺激胱天蛋白酶(caspase)-3依赖的细胞凋亡途径[28]。
2.2.4Bcl-2和Bax Bcl-2蛋白家族作为细胞生命的调节器,包括促进生存蛋白[如B细胞淋巴瘤/白血病-xL(Bcl-xL)]和促进凋亡蛋白[如Bax、Bcl-2同源拮抗剂抗体(Bak)],它们协同调节细胞凋亡,对癌症的发生和治疗起着至关重要的作用。Bcl-2/Bax比率代表凋亡活性,当比率降低时促进细胞凋亡,在胆囊癌细胞NOZ和EHGB-1及其荷瘤小鼠中,紫草素增加Bax表达,引起多腺苷二磷酸核糖聚合酶(PARP)、caspase-9和caspase-3被切割,下调Bcl-2表达,最终导致Bcl-2/Bax比率显著降低。紫草素作用于肝癌细胞SMMC-7721细胞后,Bax、p53和cas‐pase-3表达显著增加,Bcl-2表达显著降低,Bcl-2/Bax比值也降低[29]。在甲状腺癌细胞中,经紫草素处理后,蛋白质印迹法(Western blotting)显示促凋亡蛋白Bax和BH3结构域凋亡诱导蛋白(Bid)的表达水平明显升高,而抗凋亡蛋白Bcl-2、Bcl-xl和髓样细胞白血病-1(Mcl-1)的表达明显降低[30]。
2.2.5RIPK1和RIPK3 坏死性凋亡是一种依赖于受体相互作用蛋白激酶(RIPK)的调节性坏死,越来越多的证据表明,活化的RIPK1与RIPK3相互作用,能够促进RIPK1/RIPK3核小体的形成,使坏死复合体招募下游底物混合谱系激酶结构域样蛋白(MLKL),形成寡聚体,导致细胞膜渗漏引起细胞死亡。紫草素可以针对坏死性凋亡信号通路来治疗癌症。在乳腺癌(MCF-7)、胰腺癌和鼻咽癌(5-8F和CNE-2Z)细胞中,紫草素可显著增加RIPK1和RIPK3表达,上调MLKL,显微镜下观察到细胞质呈透明样,质膜完全丧失,提示紫草素引起细胞坏死性凋亡[31]。在骨肉瘤细胞143B荷瘤小鼠中,利用靶向多肽修饰的二硫键交联多肽纳米凝胶可以促进紫草素的细胞内给药,通过诱导依赖RIPK1和RIPK3的坏死性凋亡来杀伤骨肉瘤细胞,甚至可以消除体内癌细胞的肺转移现象。在小鼠乳腺癌细胞4T1中,紫草素可以诱导RIPK1和RIPK3依赖的细胞坏死性凋亡,并同时增强癌细胞自噬作用。紫草素(2~10 mol/L)还可以剂量依赖的方式诱导大鼠C6和人脑胶质瘤细胞系SHG-44、HG44、U87和U251细胞内活性氧的产生和坏死,上调胶质瘤细胞中RIPK1和RIPK3的水平,导致癌细胞核内DNA双链断裂,并加强它们之间的相互作用[32]。在紫草素治疗的肺癌荷瘤小鼠中,紫草素显著增加肿瘤组织中RIPK1蛋白的表达,并且观察到紫草素处理组肿瘤生长明显低于对照组,甲基腺嘌呤(3-MA)、自噬相关基因5(ATG5)小干扰RNA(siRNA)和巴菲霉素A等自噬抑制剂可增强紫草素诱导的坏死性凋亡,提示紫草素有望成为治疗肺癌的新策略[33]。
2.2.6诱导线粒体功能障碍 在肝癌细胞中,紫草素通过破坏线粒体膜电位和氧化应激状态影响线粒体功能,降低线粒体中PKM2表达、HCCLM3细胞耗氧率、三羧酸循环(TCA循环)中ATP和代谢物的水平,影响AMP活化蛋白激酶(AMPK)和过氧化物酶增殖激活受体γ共激活子-1(PGC1)蛋白酶解途径,加剧氧化应激和营养缺乏,通过PKM2-AMPKPGC1信号通路触发线粒体功能障碍[34]。
2.2.7诱导细胞自噬及细胞免疫 自噬是抑制癌细胞增殖的重要机制,据报道,紫草素具有诱导自噬和细胞免疫的作用。当自噬发生时,微管相关蛋白1轻链3B(LC3B)定位于隔离膜,导致自噬体膜的形成,微管相关蛋白1轻链3B-Ⅱ(LC3B-Ⅱ)是众所周知的自噬激活的标志物,紫草素可诱导微管相关蛋白1轻链3B-Ⅰ(LC3B-Ⅰ)转化为LC3B-Ⅱ。紫草素通过激活活性氧介导的内质网应激、p38信号通路、增加LC3B-Ⅱ和激活型PARP以及caspase-3的产生,诱导恶性黑色素瘤(A375)、肺癌(A549)和宫颈癌(HeLa)细胞凋亡和自噬[35]。在结直肠腺癌细胞SW620和HCT116中,紫草素诱导的半乳糖凝集素-1(Galectin-1)二聚化增加,形成自噬小体和空泡,激活肠癌细胞凋亡和自噬[36]。选择性自噬接头蛋白(p62)降解也是自噬的标志物,在结直肠癌细胞中,紫草素降低YAP蛋白表达,上调LC3B-Ⅱ表达形成自噬小体,并且随着紫草素浓度的增加或作用时间的延长,HCT116和SW620细胞中p62的显著降解。在恶性黑色素瘤细胞WM164、WM9和SBCL2中,紫草素也能上调p62基因表达,增强LC3B-Ⅱ表达[37]。程序性坏死和坏死性凋亡是一种高度的免疫原性活动,通常通过损伤的相关分子模式(DAMPs)的释放来介导,紫草素诱导的自噬可直接导致DAMPs的释放增加,分泌至胞外的DAMPs能够激活共培养的树突状细胞(DC),用紫草素预处理的肿瘤细胞与DC共培养能进一步抑制乳腺癌转移。紫草素通过提高穿孔素、颗粒酶B(GranB)、磷酸化的细胞外信号调节激酶1/2(p-ERK1/2)和磷酸化的蛋白激酶B(p-AKT)表达,使自然杀伤(NK)细胞增殖并强化细胞毒性,诱导细胞免疫[38]。
2.2.8其他 在乳腺癌细胞MCF-7和SK-BR-3中,紫草素下调雌激素受体α(ERα)、G蛋白偶联雌激素受体(GPER)、表皮生长因子受体(EGFR)和p-ERK的表达,对人乳腺癌细胞SK-BR-3细胞具有抗增殖效应。分化簇147(CD147)在人体各种肿瘤组织中广泛表达,并且在肿瘤细胞的生长增殖和转移浸润中具有非常重要的作用,在胶质瘤细胞U251和U87MG中,基因敲除CD147可抑制细胞生长,过表达CD147可促进细胞生长和抑制紫草素诱导的活性氧产生和线粒体膜电位水平的升高,提示紫草素诱导胶质瘤细胞凋亡与下调CD147和上调氧化应激有关,CD147可能是紫草素诱导胶质瘤细胞凋亡的选择性靶点[39]。Bcl2相关永生基因3(BAG3)为抗凋亡和前自噬因子,在人胶质母细胞瘤中,紫草素可诱导miR-143过表达降低凋亡调节因子BAG3表达导致细胞凋亡比例显著增加。在人乳腺癌细胞系MDA-MB-231中,紫草素能够有效地抑制信号转导及转录激活蛋白3(STAT3)的活性、核定位及其下游靶基因表达,导致细胞功能障碍阻止肿瘤的发生和恶性转化[40]。
2.3抑制癌细胞迁移和侵袭癌细胞的迁移和侵袭使癌症严重威胁人类健康,紫草素对防止癌细胞迁移和侵袭具有重要意义,机制如下。
2.3.1MMPs 基质金属蛋白酶(MMPs)是一类锌依赖的内肽酶家族,可促进细胞增殖、迁移和分化,已在癌症中检测到MMP水平升高与肿瘤进展和侵袭性有关。在恶性黑色素瘤细胞A375和A2058以及斑马鱼肿瘤模型中,紫草素呈剂量依赖性地降低Mcl-1、Bcl-2、MMP-2和MMP-9的蛋白水平。扭曲蛋白(Twist)是一种由STAT3直接调控的转录因子,能够诱导上皮细胞-间充质转化(EMT),这是上皮细胞的一种恶化变化,波形蛋白和神经钙黏素(N-cad‐herin)是EMT过程中的关键调节因子。蛋白质印迹法表明紫草素能下调Twist、波形蛋白和N-cadherin的表达[41]。紫草素呈剂量依赖性降低两株骨肉瘤细胞U2OS和SAOS-2中MMP-13水平,增加肿瘤坏死因子α诱导蛋白8样分子2(TIPE2)水平,显著抑制MMP-13水平和细胞侵袭力[42]。紫草素还可通过AKT/mTOR和活性氧/ERK1/2途径降低MMP-2/-9的表达,从而抑制前列腺癌和乳腺癌细胞的侵袭性迁移和侵袭。紫草素还通过下调锌指转录因子(slug)和MMP-14的表达抑制甲状腺癌细胞发生EMT[43]。
2.3.2catenin信号通路 细胞迁移和侵袭的必经过程包括EMT,在非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)乳腺癌荷瘤小鼠中,紫草素通过上调糖原 合酶激 酶3β(GSK-3β)的 水 平,抑 制连环 素(catenin)表达和核积累,靶向调节EMT相关基因的转录,显著抑制MDA-MB-231细胞肺转移[44]。
2.3.3其他 紫草素处理后miR-106b的表达降低,增强紫草素对肝癌细胞迁移和EMT的抑制作用。紫草素抑制甲状腺癌细胞TPC-1的DNA甲基转移酶1(DNMT1)表达,降低PTEN基因甲基化,增加PTEN蛋白表达[45]。沉默调节蛋白2(SIRT2)是表皮细胞生长因子(EGF)和ERK信号通路的下游分子,过表达可以抑制转移性结直肠癌细胞SW480增殖和转移,而紫草素恰恰可以增强SIRT2表达[46]。紫草素通过诱导上皮细胞钙黏蛋白(E-cadherin)表达,减少肝细胞生长因子受体(c-Met)活化、波形蛋白、锌指转录因子slug(snail2)和snail表达,抑制非小细胞肺癌细胞HCC827的迁移和侵袭活性[47]。肿瘤干细胞(CSCs)负责肿瘤的侵袭性生长和转移,STAT3、整合素/黏着斑激酶(FAK)和鸡肉瘤病毒基因(Src)信号通路有助于维持癌细胞的干细胞程序,紫草素通过抑制STAT3/FAK/Src信号通路的激活显著降低乳腺癌和卵巢癌细胞的侵袭和迁移。紫草素通过抑制MMP-7、整合素β1、Toll样受体2(TLR2)和p65核因子-κB(NF-κB)的表达水平能显著降低胃癌(MGC803)和肺癌(A549)细胞的存活、黏附、侵袭和迁移能力[48]。
3 展望
紫草素的抗癌活性在肺癌、白血病、淋巴瘤、胃癌、结直肠癌、肝癌、胰腺癌、妇科肿瘤(宫颈癌、乳腺癌、子宫内膜癌和卵巢癌)等多种系统的恶性肿瘤中得到了广泛的研究。越来越多的证据表明紫草素通过抑制癌细胞增殖、迁移和侵袭,诱导细胞凋亡、自噬和免疫发挥抗癌作用。进一步地分子机制研究表明,紫草素通过抑制CDK1去磷酸化、糖代谢途径、PKM2,调节miRNA,下调C-MYC表达和诱导细胞周期阻滞来抑制肿瘤细胞的增殖。紫草素诱导的癌细胞凋亡与活性氧生成增加、线粒体介导的凋亡通路激活、MAPKs通路的调控、PI3K/AKT通路的抑制有关。PTEN和miR106b作为PI3K/AKT通路的上游,在紫草素诱导的细胞凋亡中起重要作用。这些途径的调控导致促凋亡蛋白Bax增加,抗凋亡蛋白Bcl-2下调,凋亡相关蛋白剪切型PARP和caspase-3/8/9活性增强,最终导致多种肿瘤细胞死亡。这些途径之间又存在着交联,如紫草素诱导的活性氧积聚可激活p38 MAPK通路。此外,紫草素通过抑制NF-κB信号通路,降低MMP-2/7/9/13/14表达,调节PI3K/AKT、ERK1/2和CXC趋化因子受体4(CXCR4)/基质细胞衍生因子-1(SDF-1)信号通路在多种癌症中发挥抑制细胞迁移和侵袭的作用。更值得关注的是,通过对紫草素的萘醌环或侧链进行修饰,新衍生物表现出比紫草素更强的抗癌活性和更低的毒性。Huang等[49]为了开发高效、安全的抗肿瘤药物,合成了45个含硫紫草素肟衍生物,并对其体外抗人结肠癌(HCT-15)、胃癌(MGC-803)、肝癌(Bel7402)和乳腺癌(MCF-7)的活性进行了评价,结果表明,侧链取代基的结构和性质对紫草素体外抗肿瘤活性是非常重要的,紫草素肟衍生物9m通过下调Bcl-2和上调Bax、caspase-3和caspase-9,能使细胞周期阻滞在G1期,并诱导HCT-15细胞产生强烈的凋亡反应,同时细胞释放较少的一氧化氮,表明紫草素肟衍生物细胞毒性较低。在紫草素抗恶性黑色素瘤的研究中,研究人员合成了18个新的紫草素衍生物,研究了它们对各种黑色素瘤细胞系和皮肤成纤维细胞的细胞毒性,(R)-1-(1,4-二氢-5,8-二羟基-1,4-二氧萘-2-基)-4-甲基戊-3-烯基环丙基乙酸(环丙基乙酰紫草宁)显示了对两种来源于转移病灶的黑色素瘤细胞系(WM164和MUGMel2)强烈的抑制活性,进一步地研究表明,紫草素衍生物通过组蛋白2A变异体(H2AX)磷酸化作用导致双链DNA断裂,依赖caspase提高剪切型PARP蛋白水平诱导细胞凋亡[50]。然而,所有这些研究都是在癌细胞系或荷瘤动物模型中进行;加之,天然产物一般具有通过肠道菌群改善疾病的作用,但到目前为止,尚无文献报道紫草素对肠道菌群的影响,因此需要进一步地研究来验证紫草素及其衍生物临床应用的有效性和安全性。
