脑膜炎奈瑟菌核酸检测试剂国家参考品的研制
2022-06-11李江姣刘茹凤李康黄洋徐潇石继春王春娥梁丽陈驰叶强
李江姣,刘茹凤,李康,黄洋,徐潇,石继春,王春娥,梁丽,陈驰,叶强
·技术与方法·
脑膜炎奈瑟菌核酸检测试剂国家参考品的研制
李江姣*,刘茹凤*,李康,黄洋,徐潇,石继春,王春娥,梁丽,陈驰,叶强
脑膜炎奈瑟菌(,Nm),又名脑膜炎双球菌或脑脊髓膜炎双球菌,是一种革兰氏阴性菌,根据荚膜多糖可分为 A、B、C、D、X、Y、Z、29E、W135、L、H、I、K 等 13 个血清群,主要寄居在人体鼻咽部,可通过飞沫传播。人感染脑膜炎奈瑟菌可引起败血症或流行性脑脊髓膜炎(简称流脑)等急性呼吸道传染病,常伴随着较高的死亡率[1-3]。建立高效的 Nm 检测方法对流脑的临床诊断有重要的意义。
流脑的常规诊断方法是从脑脊液和血液中分离出病原菌,而传统的细菌培养法检测时间较长,Nm 易在标本运输过程中死亡,当患者接受抗菌药物治疗以及受其他非特异性因素的影响时,会引起细菌分离的失败,降低细菌培养法的准确性,因此采用敏感性更高的检测方法变得十分重要。近年来,核酸检测技术因其快速、灵敏等特点被广泛应用于临床检测。利用核酸检测技术检测 Nm 的敏感性和特异性高,经济成本低,为 Nm 的检测提供了重要的技术手段[4-6]。因各种检测试剂的取样量及选取的目的基因片段不同,其检测结果的准确性及灵敏度等存在差异。由于缺乏标准统一的国家参考品,使得该类检测试剂的质量控制和评价成为难题。本研究拟研制一套脑膜炎奈瑟菌国家参考品,提升对脑膜炎奈瑟菌核酸检测试剂的质量控制和评价水平。
1 材料与方法
1.1 材料
1.1.1 主要试剂及仪器 GC 基础培养基、血红蛋白粉均购自美国 BD 公司;中国细菌浊度国家标准品来源于中国食品药品检定研究院;脑膜炎奈瑟菌核酸检测试剂盒 A(批号:20200501)、试剂盒 B(批号:P20200701)和试剂盒 C(批号:20200601)分别来自 3 家脑膜炎奈瑟菌核酸检测试剂生产企业;培养箱 5810E 购自美国 Nuaire 公司;ABI 7500 实时荧光定量 PCR 仪购自美国 ABI 公司。
1.1.2 菌株 10 株阳性参考品菌株脑膜炎奈瑟菌均来源于中国医学细菌保藏管理中心,编号分别为:CMCC(B)29015、CMCC(B)29016、CMCC(B)29031、CMCC(B)29050、CMCC(B)29051、CMCC(B)29052、CMCC(B)29055、CMCC(B)29043、CMCC(B)29046、CMCC(B)29028;10 株阴性参考品菌株也来源于中国医学细菌保藏管理中心,分别为:流感嗜血杆菌 CMCC(B)58561、肺炎克雷伯 CMCC(B)46117、铜绿假单胞菌 CMCC(B)10104、金黄色葡萄球菌 CMCC(B)26001、肺炎链球菌 CMCC(B)31001、A 族链球菌 CMCC(B)32067、白喉棒杆菌 CMCC(B)38102、卡他布朗汉姆氏菌 CMCC(B)29118、百日咳 CMCC(B)58039、大肠杆菌 CMCC(B)44113。
1.2 方法
1.2.1 菌悬液制备 将各菌株接种于适宜生长的培养基上,于最适温度条件下进行培养和传代。取新鲜的固体培养物或液体培养物沉淀,用无菌生理盐水重悬制成菌悬液,采用比浊法或平皿计数法测定浓度,采用适宜温度进行热灭活,并对灭活效果进行验证。
1.2.2 参考品制备
1.2.2.1 阳性参考品 将 10 株脑膜炎奈瑟菌原菌液稀释至 1 × 106个/ml,定量分装,0.5 ml/管,–20 ℃以下保存,标记为 P1 ~ P10。
1.2.2.2 阴性参考品 流感嗜血杆菌原菌液稀释至1 × 106个/ml,其余 9 株阴性参考品原菌液稀释至 1 × 107个/ml,定量分装 0.5 ml/管,–20 ℃以下保存,标记为 N1 ~ N10。
1.2.2.3 重复性参考品和最低检出限参考品 将脑膜炎奈瑟菌原菌液(CMCC 29052)稀释至 1 × 106个/ml,定量分装,0.8 ml/管,–20 ℃以下保存,分别标记为 R 和 S。
1.2.3 均匀性检测 随机抽取阳性参考品、最低检出限参考品各 10 支,重复性参考品 15 支,用脑膜炎奈瑟菌核酸检测试剂盒 B 进行检测,计算 Ct 值的 CV 值。
1.2.4 稳定性检测 将阳性参考品、精密性参考品、最低检出限参考品分别于2 ~ 8 ℃、25 ℃、37 ℃放置 3、7 和 14 d,反复冻融 3 次、5 次,以–20 ℃冰箱中保存的参考品作为对照,用试剂盒 A 进行检测,考察参考品于不同温度下放置不同时间及反复冻融的稳定性。
1.2.5 参考品验证
1.2.5.1 准确性验证 将阳性参考品分别用灭菌生理盐水进行 10 倍稀释,标记为 P1 ~ P10,分别用试剂盒 A、试剂盒 B 和试剂盒 C 进行检测,每份样本平行检测 2 次。每个试剂盒进行 2 次独立实验。
1.2.5.2 特异性验证 将阴性参考品分别用灭菌生理盐水 10 倍稀释,标记为N1 ~ N10,分别用试剂盒 A、试剂盒 B 和试剂盒 C 进行检测,每份样本平行检测 2 次。每个试剂盒进行 2 次独立实验。
1.2.5.3 重复性验证 将重复性参考品(10 支)分别用灭菌生理盐水 10 倍稀释,标记为 R,分别用试剂盒 A、试剂盒 B 和试剂盒 C 进行检测,每份样本平行检测 2 次,重复检测 10 次。每个试剂盒进行 2 次独立实验。
1.2.5.4 最低检出限验证 取最低检出限参考品(1 ×106个/ml),用灭菌生理盐水进行系列稀释,检测试剂盒 A、B、C 的最低检出限。
2 结果
2.1 参考品的分装均匀性评估
试验结果(表1)显示,各阳性参考品、最低检出限参考品 Ct 值的 CV(n = 10)、重复性参考品 Ct 值的 CV(n = 15)均在 5.0% 以内,说明参考品的分装均匀度良好。
2.2 参考品的稳定性评估
2.2.1 冻融稳定性评估 经反复冻融 3、5 次处理后,与–20 ℃保存对照参考相比,Ct 值变化不大,表明本参考品具有较好的冻融稳定性(图1)。
表1 参考品分装均匀性评估
样品CtSDCV(%) P126.290.240.93 P225.100.351.39 P326.380.230.86 P428.050.321.14 P525.100.250.98 P623.530.301.27 P724.750.150.59 P824.190.291.18 P925.810.773.00 P1025.010.311.23 S25.450.150.58 R25.650.210.81
2.2.2 加速稳定性评估 将参考品分别于 2 ~ 8 ℃、25 ℃、37 ℃放置 3、7、14 d 后,与–20 ℃保存对照参考相比,Ct 值变化不大,表明本参考品具有较好的加速稳定性,可以满足运输、使用等的稳定性要求(图2)。
2.3 参考品的适用性验证
采用 3 家企业的试剂盒对制备参考品进行验证。结果显示,各试剂盒的准确性、特异性及重复性检测结果均符合要求。试剂盒 A、试剂盒 B 和试剂盒 C 的阳性参考品符合率均为 10/10;阴性参考品符合率均为 10/10;重复性参考品 10 次检测的 Ct 值的 CV 值均小于 5%。试剂盒 A和 B 的最低检出限为 1.0 × 103个/ml,试剂盒 C 的最低检出限为 1.0 × 104个/ml(表2)。
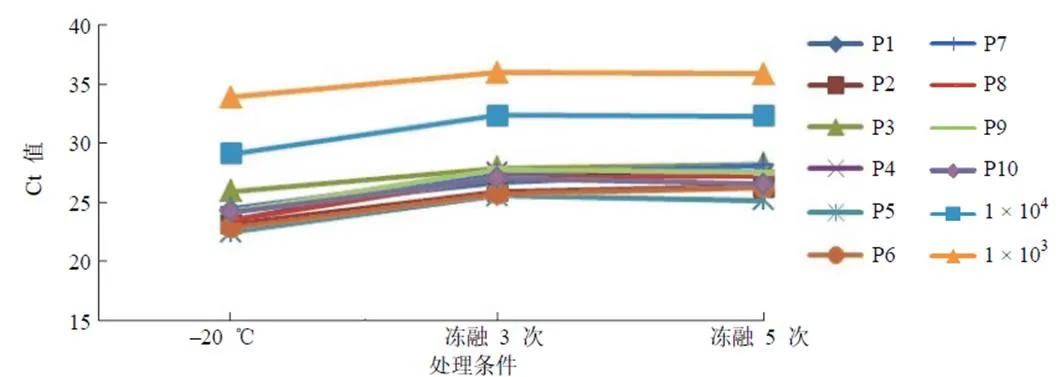
图1 冻融稳定性评估结果(1 × 104和 1 × 103分别表示将最低检出限参考品稀释为 1 × 104个/ml 和 1 × 103个/ml)
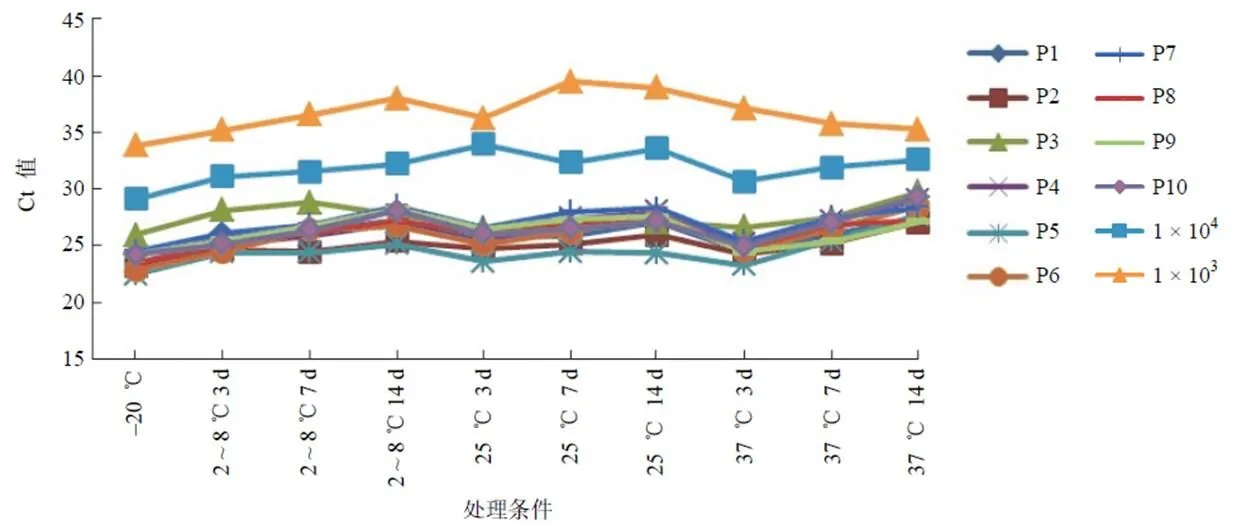
图2 加速稳定性评估结果(1 × 104和 1 × 103分别表示将最低检出限参考品稀释为 1 × 104个/ml 和 1 × 103个/ml)
表2 参考品适用性检测
试剂盒P1 ~ P10N1 ~ N10CV(%)1.0 × 104(个/ml)1.0 × 103(个/ml)1.0 × 102(个/ml) A10/1010/101.49++- B10/1010/100.70++- C10/1010/100.50+--
注:“+”表示检出;“-”表示未检出。
3 讨论
核酸诊断试剂的质量关乎病原体的检测效率和准确性,而其质量评价依赖于科学、公正的国家参考品[7]。因相关参考品的缺乏,本研究研制了脑膜炎奈瑟菌核酸检测试剂国家参考品。在菌株筛选方面,从中国医学细菌保藏管理中心选择 10 种不同血清型的脑膜炎奈瑟菌作为 10 个阳性参考菌株,使各阳性菌株具有充分多样性。阴性菌株在选择时,充分考虑与脑膜炎奈瑟菌感染部位相同或感染症状相似的病原菌,以及一些常见的其他病原体,从而排除非脑膜炎奈瑟菌的干扰。
本研究建立的脑膜炎奈瑟菌核酸检测试剂国家参考品由灭活菌悬液制成,一套参考品包括 10 个阳性参考品、10 个阴性参考品、1 个最低检出限参考品和 3 个重复性参考品。参考品的均匀性检测结果显示,各阳性参考品、重复性参考品和最低检出限参考品 Ct 值的 CV 均在 5.0% 以内,说明参考品的分装均匀度良好。稳定性检测结果表明,参考品经反复冻融 3、5 次处理,以及 2 ~ 8 ℃、25 ℃、37 ℃放置 3、7、14 d,具有较好的稳定性,可以满足运输、使用等的稳定性要求。使用 3 家企业生产的试剂盒对参考品进行适用性验证,结果表明其准确性、特异性和重复性均满足要求,最低检出限检测结果显示各企业试剂盒的最低检出限存在差异。
综上所述,本研究制备的脑膜炎奈瑟菌核酸检测试剂国家参考品具有良好的均匀性和稳定性,经验证具有良好的准确性、特异性和重复性,能够用于脑膜炎奈瑟菌核酸检测试剂的质量控制和性能评价。
[1] Stephens DS, Greenwood B, Brandtzaeg P. Epidemic meningitis, meningococcaemia, and Neisseria meningitidis. Lancet, 2007, 369(9580):2196-2210.
[2] Robbins JB, Schneerson R, Gotschlich EC, et al. Meningococcal meningitis in sub-Saharan Africa: the case for mass and routine vaccination with available polysaccharide vaccines. Bull World Health Organ, 2003, 81(10):745-750.
[3] Li JH, Wang XJ, Liang XF. Epidemic situation, prevention and control of epidemic cerebrospinal meningitis in China. Dis Surveill, 2005, 20(4):169-170. (in Chinese)
李军宏, 王晓军, 梁晓峰. 我国流行性脑脊髓膜炎的流行概况及预防控制. 疾病监测, 2005, 20(4):169-170.
[4] Qiao FJ, Ren LZ, Wang H, et al. Application of PCR technology in epidemic cerebrospinal meningitdis surveillance. Chin J Public Health Eng, 2008, 7(4):198-199. (in Chinese)
乔凤娟, 任林柱, 王会, 等. PCR技术在流脑监测中的应用研究. 中国卫生工程学, 2008, 7(4):198-199.
[5] Wang CY, Shi XZ, Sun ZL. Real-time fluorescence quantitation polymerase chain reaction for Neisseria meningitidis determination. Lab Med, 2018, 33(4):339-342. (in Chinese)
王崇义, 史训忠, 孙正林. 实时荧光定量PCR快速检测脑膜炎奈瑟菌的临床价值. 检验医学, 2018, 33(4):339-342.
[6] Richardson DC, Louie L, Louie M, et al. Evaluation of a rapid PCR assay for diagnosis of meningococcal meningitis. J Clin Microbiol, 2003, 41(8):3851-3853.
[7] China Food and Drug Administration. Measures for the administration of registration of in vitro diagnostic reagents. 2014-07-30. (in Chinese)
国家食品药品监督管理总局. 体外诊断试剂注册管理办法. 2014- 07-30.
10.3969/j.issn.1673-713X.2022.03.013
“十三五”国家科技重大专项(2018ZX10102-001-002、2018ZX09738006-006);国家科技基础条件平台——国家菌种资源库课题(NMRC-2020-2)
102629 北京,中国食品药品检定研究院中国医学细菌保藏管理中心
叶强,Email:qiangyee@nifdc.org.cn
2021-09-27
*同为第一作者
