复合益生菌发酵饲料发酵条件优化及品质鉴定
2022-06-10吴国芳张晓卫冯宇哲
万 里 吴国芳 王 磊* 张晓卫 冯宇哲
(1.青海大学畜牧兽医科学院,西宁810016;2.青海省高原放牧家畜动物营养与饲料科学重点实验室,西宁810016;3.青海省牦牛工程技术研究中心,西宁810016;4.青海省高原家畜遗传资源保护及创新利用重点实验室,西宁810016)
受非洲猪瘟和新冠疫情双重影响,饲料原料价格不断飙升,养殖成本成倍增加,如何降低养殖成本迫在眉睫[1]。抗生素作为饲料添加剂被广泛使用,其显著增加了养殖效益,但对人类、动物健康以及生态环境都造成了严重危害[2]。我国农业农村部已于2020年发文在饲料端禁抗,而益生菌发酵饲料由于具有无污染、品质高、适口性好、利用率高、可部分替代抗生素等优点被广泛关注[3],益生菌发酵可将植物性农副产品等原料分解成多糖、蛋白质和脂肪等一些大分子物质,生成有机酸、可溶性小肽等小分子物质和大量的菌体蛋白,形成营养丰富、适口性好的生物饲料[4]。
乳酸菌是影响青贮饲料发酵的主要益生菌,属于兼性厌氧型细菌,通过对糖发酵形成乳酸,从而降低pH,抑制腐败微生物的生长,减少发酵过程中的蛋白质水解和干物质损失[5]。乳酸菌可分为同型乳酸菌和异型乳酸菌两大类。在饲料中接种同型乳酸菌,饲料发酵后NH3-N含量和pH较低[6]。异型乳酸菌可增加发酵饲料中乙酸的含量,抑制好氧腐败菌的繁殖,提高青贮饲料的有氧稳定性[7]。酵母菌属于兼性厌氧型真菌,其一方面在发酵过程中产生酒香味或苹果芳香味,从而提高饲料风味和动物采食量,另一方面在发酵过程中通过自身产生的酶将饲料中的大分子物质降解为小分子物质,进而提高饲料利用率[8];同时,酵母菌发酵产生的乳酸、乙酸、丙酸等有机酸可降低发酵饲料pH,抑制病原菌生长,提高发酵饲料营养价值[9]。添加促进某些微生物定植的添加剂可以对反刍动物的营养方式进行干预[10]。已有研究表明,在反刍动物饲粮中添加适量的乳酸菌、酵母菌等益生菌可以提高动物的生产性能,改善肉品质[11],优化血液生化指标[12],提高瘤胃功能[13]。
目前关于益生菌发酵精补料的报道较少,因此,本试验使用复合益生菌对育肥牦牛精补料进行发酵,通过发酵条件优化、微生物群落分析以及发酵后饲料品质鉴定,全面地对发酵饲料进行评价,以期为益生菌发酵饲料在牦牛育肥生产中的应用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌种
3株乳酸菌:鼠李糖乳杆菌(Lactobacillusrhamnosus,YLW001菌株,菌种保藏号CCTCC M 2018759)、乳酸片球菌(Pediococcusacidilactici,YLW002菌株,菌种保藏号CCTCC M 2018760)、干酪乳杆菌(Lactobacilluscasei,YLW003菌株,菌种保藏号CCTCC M 2018761);2株酵母菌:酿酒酵母菌(Saccharomycescerevisiae,JZ9菌株,菌种保藏号CCTCC M 2020844)、毕赤酵母菌(Pichiapastoris,JZ10菌株,菌种保藏号CCTCC M 2020843)。以上菌株均由青海省畜牧兽医科学院动物营养与饲料科学实验室筛选得到。
1.1.2 培养基
MRS液体培养基(1 L):蛋白胨10 g、酵母提取物5 g、无水乙酸钠5 g、柠檬酸二铵2 g、葡萄糖20 g、牛肉膏10 g、吐温-80 1 mL、K2HPO42 g、MgSO4·7H2O 0.58 g、MnSO4·4H2O 0.25 g、超纯水1 000 mL。YPD液体培养基(1 L):酵母提取物10 g、蛋白胨20 g、葡萄糖20 g、超纯水1 000 mL。以上培养基均在121 ℃下灭菌20 min。
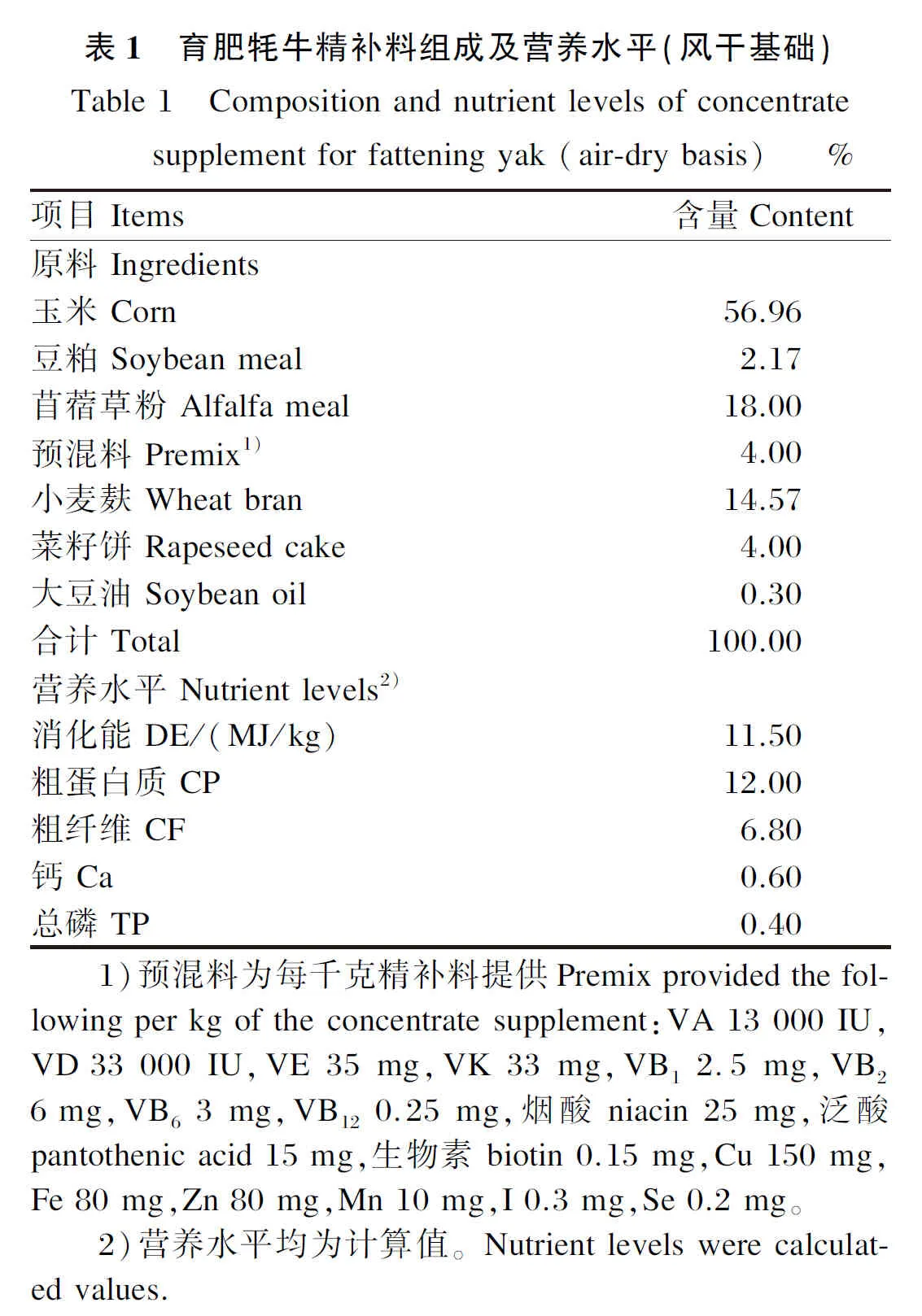
1.1.3 精补料
试验所用育肥牦牛精补料组成及营养水平见表1。
1.2 试验方法
1.2.1 菌种活化及活菌数测定
乳酸菌的活化:将冻存的3株乳酸菌菌液解冻后,分别取20 μL,同时加入到装有MRS液体培养基的15 mL的离心管中,在37 ℃恒温培养箱培养24 h,采用稀释平板涂布的方法进行活菌数测定,测得乳酸菌总活菌数为6×108CFU/mL。
酵母菌的活化:将冻存的2株酵母菌菌液解冻后,分别取20 μL,同时加入到装有YPD液体培养基的15 mL的离心管中,在28 ℃恒温培养箱培养48 h,采用稀释平板涂布的方法进行活菌数测定,测得酵母菌总活菌数为1×108CFU/mL。
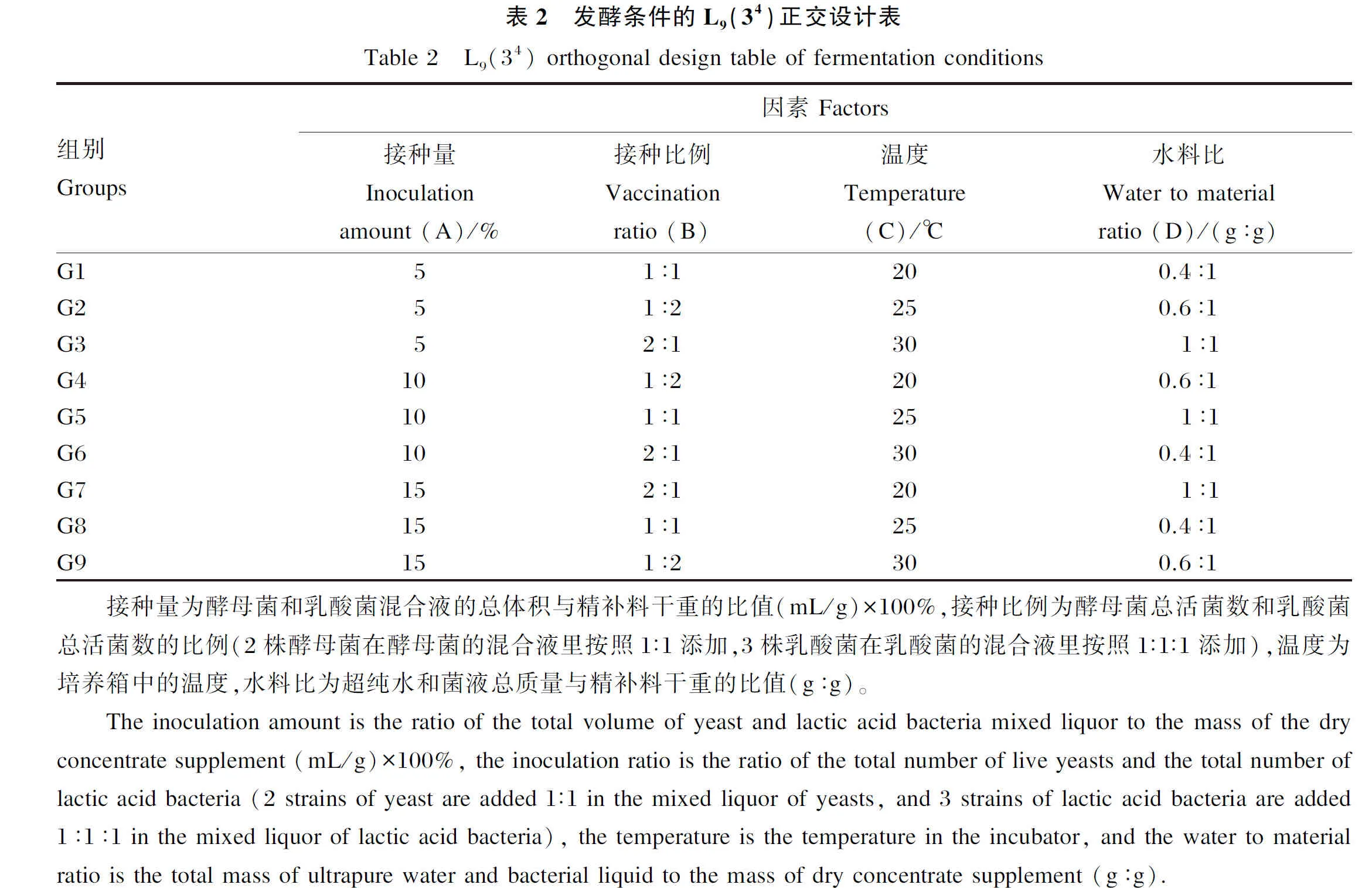
1.2.2 发酵参数正交试验设计
发酵条件优化使用4因素3水平正交设计,共设9个组。用电子秤称取1.5 kg的精补料,按照正交设计表(表2)算出所需酵母菌和乳酸菌的体积数,以及所用水的体积数(扣除菌液总体积),将菌液倒入水中,摇匀,均匀地洒在精补料上,拌匀之后分别装入500 mL的丝口试剂瓶中,每组4个重复,压实、盖好盖子,按照正交设计的温度分别放入到3个对应的培养箱中,发酵5 d后取出,测定相应指标。以上一步优化条件得到的最优组合对精补料进行发酵,设定的发酵时间分别为0、1、3、5、7、10、15 d。发酵结束后测定各发酵饲料的营养成分含量和有氧稳定性,以确定最优发酵时间。
1.2.3 指标测定
发酵饲料的pH使用便携式pH计进行测定,氨态氮(NH3-N)、可溶性糖(SS)、淀粉(ST)含量使用北京索莱宝科技有限公司生产的试剂盒进行测定,黄曲霉毒素B1(AFB1)、呕吐毒素(DON)、玉米赤霉烯酮(ZEN)含量使用陕西众美生物科技有限公司生产的酶联免疫吸附测定(ELISA)试剂盒进行测定。
微生物群落结构:使用Illumina公司的MiSeqPE-300平台(上海美吉生物医药科技有限公司)进行16S测序,然后进行α多样性、β多样性、LEfSe、相关性分析。
发酵饲料中CP(GB/T 6432—2018)、NDF(GB/T 20806—2006)、ADF(NY/T 1459—2007)含量采用相应的国标方法测定,纤维素酶(CL)、脂肪酶(LPS)、酸性蛋白酶(ACP)、α-淀粉酶(α-AL)、β-淀粉酶(β-AL)活性使用苏州科铭生物技术科技有限公司生产的试剂盒测定。
有氧稳定性:将发酵完的饲料依次完全暴露在空气中10、20、30、40、50、60 d,在每个时间节点测定饲料中心的温度和pH,并记录环境温度,当饲料中心温度高出环境温度2 ℃的时间即为有氧稳定的临界时间。
1.3 数据统计与分析
正交设计结果采用极差分析法确定最优的组合。微生物群落数据使用美吉生物云平台进行分析,按照97%序列相似度进行操作分类单元(OTU)聚类,对样本进行均一化处理,分析α多样性,并采用Student’st-test方法进行组间差异性分析。主坐标分析(PCoA)基于bray-curtis距离,组间差异性采用Adonis方法进行分析。LEfSe分析默认LDA-Score的筛选值为2.0。相关性分析使用R里面的rcorr函数、Pearson参数,计算差异菌种和表型的相关系数和P值,用热图呈现,*表示显著相关(P<0.05),**表示极显著相关(P<0.01)。发酵饲料成分指标数据使用SAS 8.2软件中的ANOVA程序进行单因素方差分析,并采用Duncan氏法进行多重比较,显著水平为P<0.05,结果以平均值±标准差表示。文章中的图片使用Origin 2018、美吉生物云平台以及R语言4.0.5软件绘制而成。
2 结果与分析
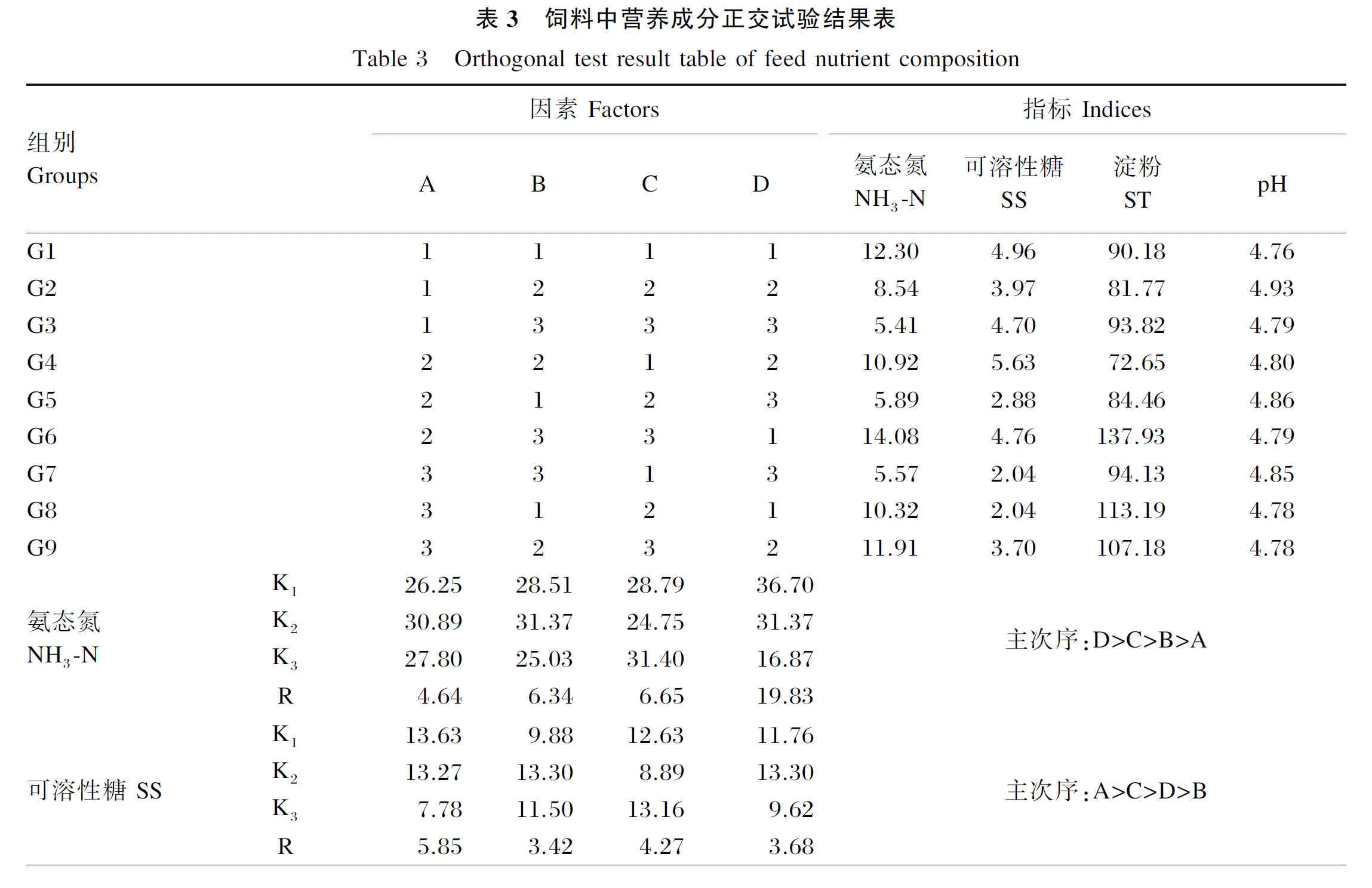
2.1 正交设计结果
饲料中营养成分和霉菌毒素含量正交试验结果分别见表3和表4。通过极差分析得出的主次序可以看出,NH3-N含量受D因素即水料比的影响最大,并且在D3、D7水平下含量较低,得到NH3-N含量的优化组为G3、G7组;SS含量受A因素即接种量的影响最大,并且在A1、A2水平下含量较高,得到SS含量的优化组为G4、G6组;各组的pH差异不大,因此不需要优化;利用同样的方法得到ST含量的优化组为G6组,AFB1含量的优化组为G1、G7组,ZEN含量的优化组为G1、G7组,DON含量的优化组为G5、G7组。由于G4组NH3-N含量过高、ST含量过低,G6组NH3-N、AFB1、DON含量过高,G5和G7组SS含量过低,G1组NH3-N含量过高,不符合要求,因此确定G3组为最优组。
2.2 不同处理对饲料中微生物群落的影响
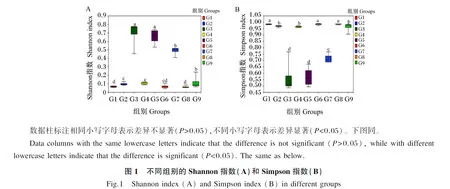
2.2.1 不同处理对饲料中微生物群落α多样性和β多样性的影响
为了分析饲料中微生物群落的α多样性,计算Shannon指数和Simpson指数,并进行指数间差异分析,结果如图1所示。从图中可以看到,G3组Shannon指数显著高于G1、G2、G4、G6、G7、G8、G9组(P<0.05),略高于G5组(P>0.05);G3组Simpson指数显著低于G1、G2、G4、G6、G7、G8、G9组(P<0.05),略低于G5组(P>0.05)。上述结果说明G3组饲料中微生物群落的α多样性高于其他组。
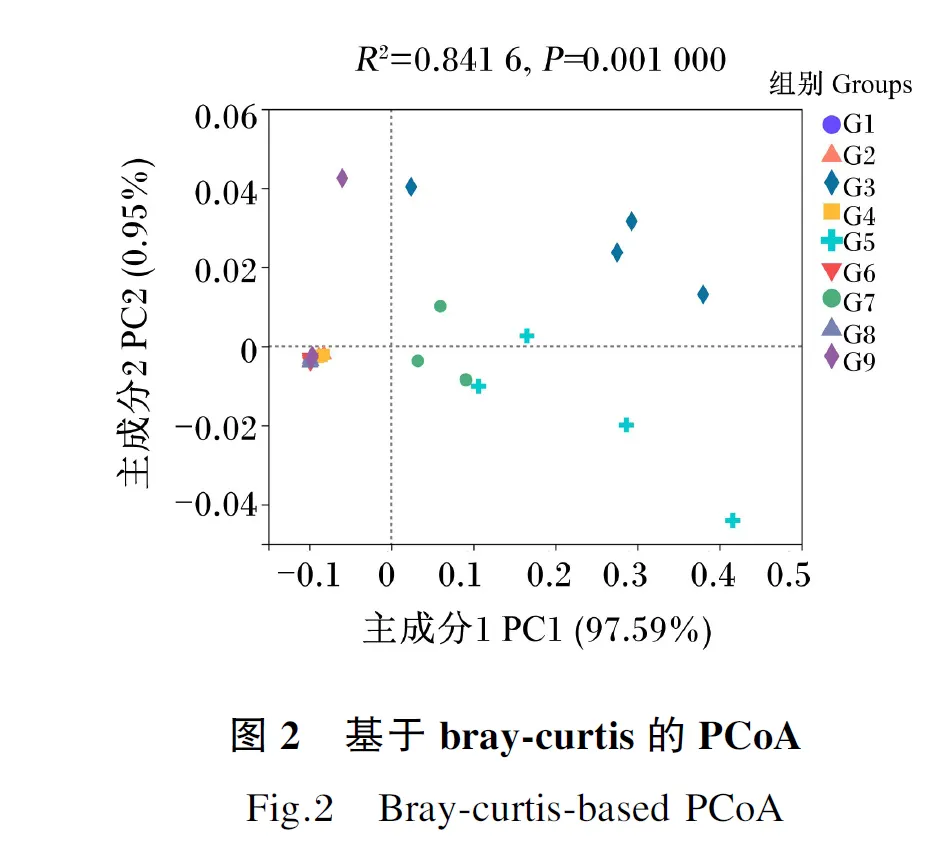
在OTU水平上,基于bray-curtis距离进行PCoA,结果如图2所示,G3、G5、G7组间分组聚类明显,G1、G2、G4、G6、G8、G9组间分组聚类不明显,使用Adonis方法进行组间差异分析发现,G3组与G1、G2、G4、G7、G6、G8、G9组差异显著(P<0.05),与G5组差异不显著(P>0.05),这说明G3组饲料中微生物群落的β多样性高于其他组。
2.2.2 不同处理对饲料中微生物群落组成的影响
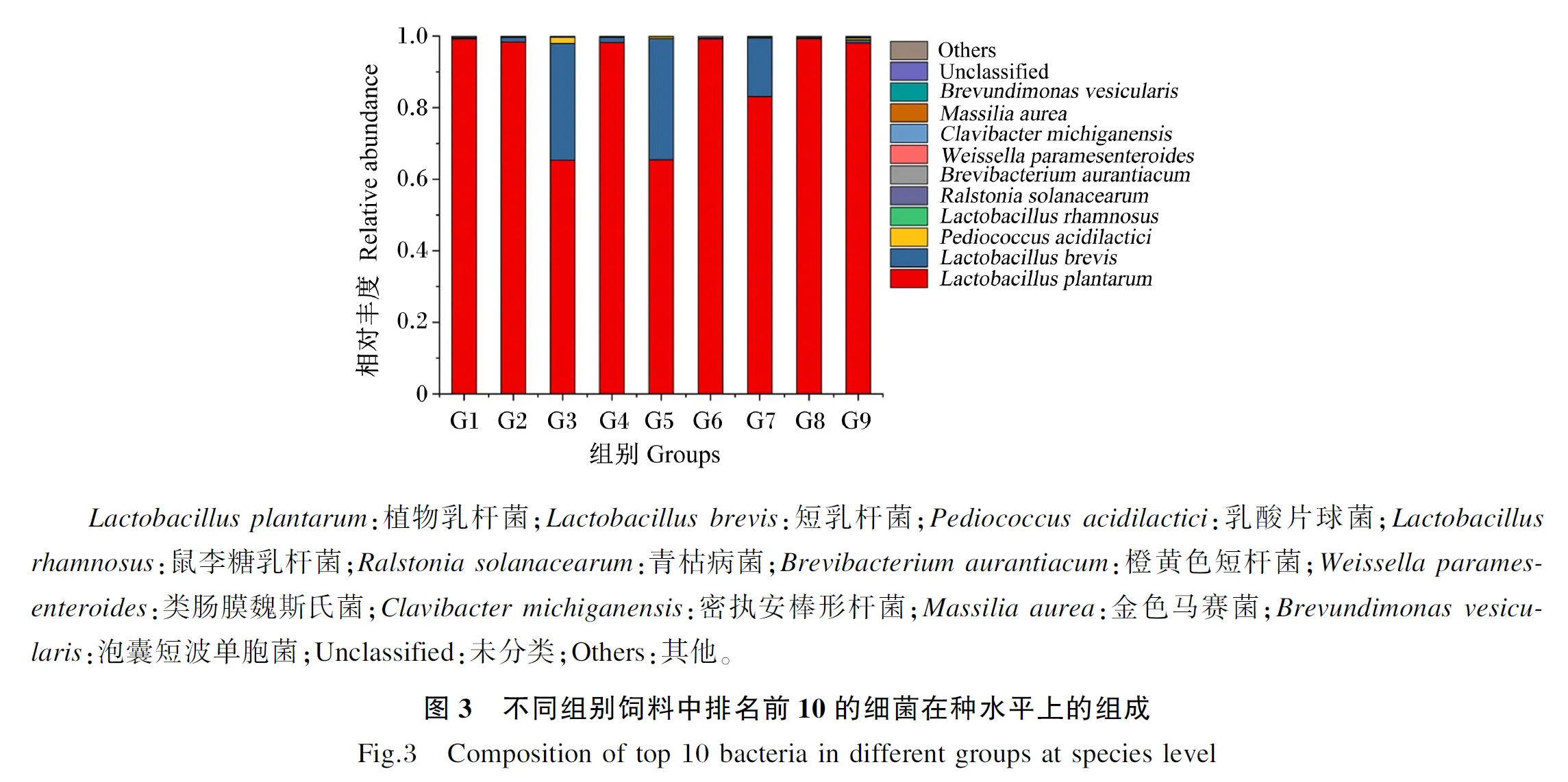
如图3所示,在种水平上,G1、G2、G4、G6、G8、G9组的优势菌种为植物乳杆菌(Lactobacillusplantarum),分别占总丰度的99.20%、98.37%、98.18%,99.20%、99.24%、98.06%,G3、G5、G7组的优势菌种为Lactobacillusplantarum、短乳杆菌(Lactobacillusbrevis),其中在G3组中Lactobacillusplantarum、Lactobacillusbrevis分别占总丰度的65.35%、32.56%;G5组中Lactobacillusplantarum、Lactobacillusbrevis分别占总丰度的65.43%、33.86%,在G7组中Lactobacillusplantarum、Lactobacillusbrevis分别占总丰度的83.10%、16.34%。对优势菌种进行单因素方差分析发现,G3组中Lactobacillusplantarum、Lactobacillusbrevis的相对丰度与G1、G2、G4、G5、G6、G8、G9组差异显著(P<0.05),与G7组差异不显著(P>0.05)。此外,G1组中还有少量的密执安棒形杆菌(Clavibactermichiganensis)、金色马赛菌(Massiliaaurea),分别占总丰度的0.007 6%、0.006 4%;G2组中有少量的类肠膜魏斯氏菌(Weissellaparamesenteroides)、泡囊短波单胞菌(Brevundimonasvesicularis),分别占总丰度的0.003 8%、0.004 1%;G3组中Pediococcusacidilactici占总丰度的1.7%,高于其他组;G5、G8组中青枯病菌(Ralstoniasolanacearum)分别占总丰度的0.020%、0.015%;G6组中Clavibactermichiganensis、Massiliaaurea、Brevundimonasvesicularis分别占总丰度的0.003 6%、0.002 5%、0.002 5%。
对差异微生物进行LEfSe,由LDA判别柱形图(图4)发现,G1组以葡萄球菌科(Staphylococcaceae)、Staphylococcales、葡萄球菌属(Staphylococcus)为主,G3组以片球菌属(Pediococcus)、乳杆菌属(Lactobacillus)为主,G4组以Lactobacillus为主,G5组以乳杆菌科(Lactobacillaceae)、Lactobacillusbrevis为主,G7组以乳杆菌目(Lactobacillales)、厚壁菌门(Firmicutes)、杆菌纲(Bacilli)为主,G8组以Lactobacillales、Lactobacillusplantarum为主,G9组以Lactobacillusrhamnosus、明串珠菌科(Leuconostocaceae)、明串珠菌属(Leuconostoc)为主。
2.2.3 饲料微生物与饲料指标之间的关联性
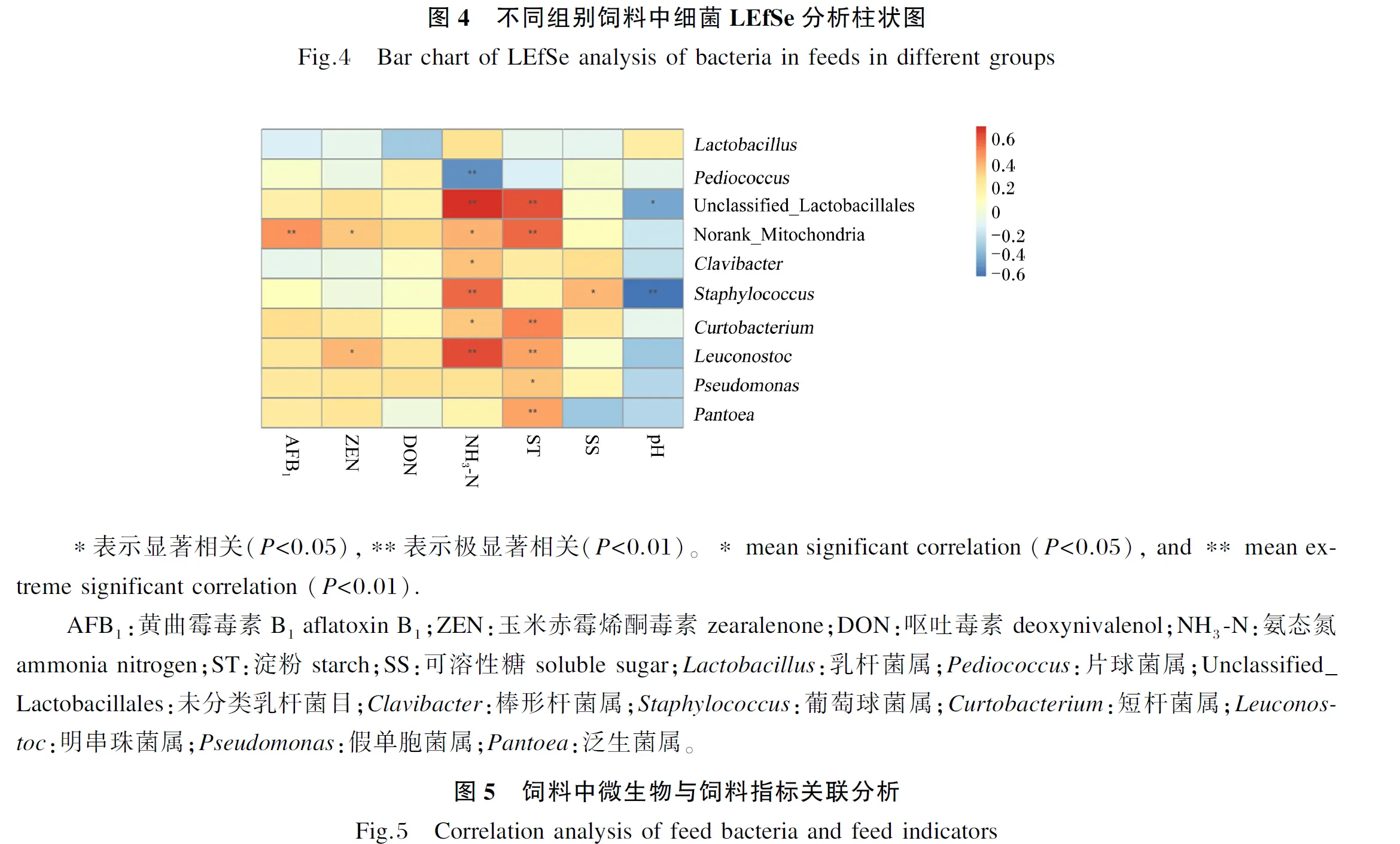
以计算出的Pearson相关系数为标准,将饲料AFB1、ZEN、DON、NH3-N、ST、SS含量及pH与微生物在属水平上的物种进行关联分析(图5)发现:AFB1含量与Norank_Mitochondria相对丰度呈极显著正相关(P<0.01);ZEN含量与Norank_Mitochondria、Leuconostoc相对丰度呈显著的正相关(P<0.05);NH3-N含量与Leuconostoc、Staphylococcus、未分类乳杆菌目(Unclassified_Lactobacillales)相对丰度呈极显著正相关(P<0.01),与Pediococcus相对丰度呈极显著负相关,与短杆菌属(Curtobacterium)、棒形杆菌属(Clavibacter)、Norank_Mitochondria相对丰度呈显著正相关(P<0.05);ST含量与泛生菌属(Pantoea)、Leuconostoc、Curtobacterium、Norank_Mitochondria、Unclassified_Lactobacillales相对丰度呈极显著正相关(P<0.01),与假单胞菌属(Pseudomonas)相对丰度呈显著正相关(P<0.05);SS含量与Staphylococcus相对丰度呈显著正相关(P<0.05);pH与Staphylococcus相对丰度呈极显著负相关(P<0.01),与Unclassified_Lactobacillales相对丰度呈显著负相关(P<0.05)。
2.3 发酵天数对饲料发酵指标的影响
2.3.1 发酵天数对饲料中CP、NDF、ADF含量的影响
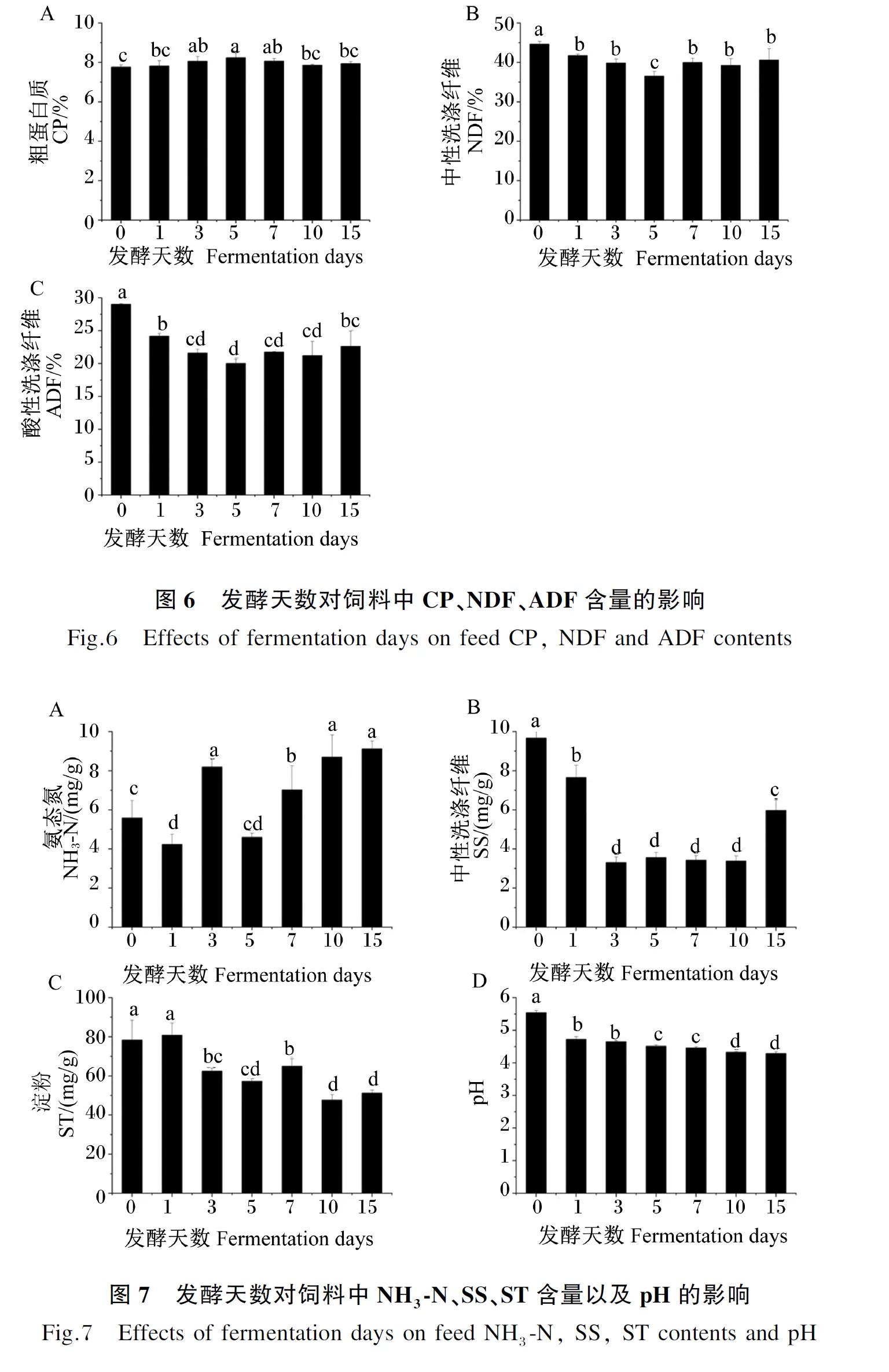
从图6可以看出,与发酵第0天(未发酵)时相比,发酵第1~15天的饲料中CP含量均有不同程度的升高,以发酵第5天时最高,显著高于发酵第0、1、10、15天时(P<0.05),而发酵第1、10、15天与发酵第0天差异不显著(P>0.05);饲料中NDF、ADF含量随发酵天数的增加先降低后升高,发酵第1~15天的饲料中NDF、ADF含量均显著低于发酵第0天时(P<0.05),以发酵第5天时最低,发酵7 d后不再有显著变化(P>0.05)。
2.3.2 发酵天数对饲料中NH3-N、SS、ST含量以及pH的影响
从图7可以看出,饲料中NH3-N含量在发酵第3、7、10、15天时显著高于发酵第0天时(P<0.05),发酵第1天时显著低于发酵第0天时(P<0.05),发酵第5天时与发酵第0天时差异不显著(P>0.05),以发酵第15天时最高,但与发酵第3、10天时差异不显著(P>0.05);发酵第1~15天的饲料中SS含量显著低于发酵第0天时(P<0.05);饲料中ST含量随发酵天数的增加总体呈下降趋势,发酵第1天时与发酵第0天时差异不显著(P>0.05),其余发酵天数均显著低于发酵第0天时(P<0.05);饲料的pH随发酵天数的增加持续降低,且发酵第1~15天的饲料的pH均显著低于发酵第0天时(P<0.05),以发酵第10、15天时较低。
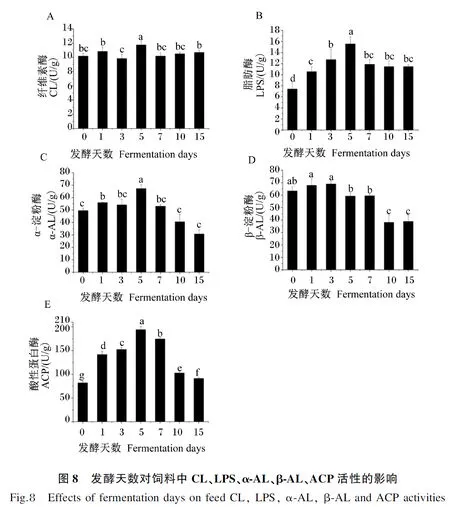
2.3.3 发酵天数对饲料中酶活性的影响
从图8可以看出,饲料中纤维素酶活性只有发酵在第5天时显著高于发酵第0天时(P<0.05),除发酵第3天时略有升高外,其余发酵天数时均略有升高,但差异不显著(P>0.05);饲料中脂肪酶活性随发酵天数的增加先升高后降低之后保持稳定,且饲料中脂肪酶活性在发酵第1~15天时均显著高于发酵第0天时(P<0.05),以发酵第5天时活性最高;饲料中α-淀粉酶活性在发酵第1、5天时显著高于发酵第0天时(P<0.05),发酵第3、7天时较发酵第0天时略有升高,但差异不显著(P>0.05),发酵第10天时开始降低,与发酵第0天时差异不显著(P<0.05);饲料中β-淀粉酶活性在发酵第1、3天时与发酵第0天时相比略有升高,在发酵第5、7天时与发酵第0天时相比略有降低,但差异均不显著(P>0.05),从发酵第10天时开始显著降低(P<0.05)。饲料中酸性蛋白酶活性随发酵天数的增加呈先升高后降低的趋势,且发酵第1~15天时均显著高于发酵第0天时(P<0.05),以发酵第5天时最高。
2.3.4 发酵天数对饲料中霉菌毒素含量的影响
从图9可以看出,发酵第1~15天时饲料中AFB1、ZEN和DON含量均显著低于发酵第0天时(P<0.05),其中AFB1含量均以发酵第15天时最低,ZEN含量以发酵第10天时最低,DON含量从发酵第5天开始趋于平稳,不再有显著变化(P>0.05)。
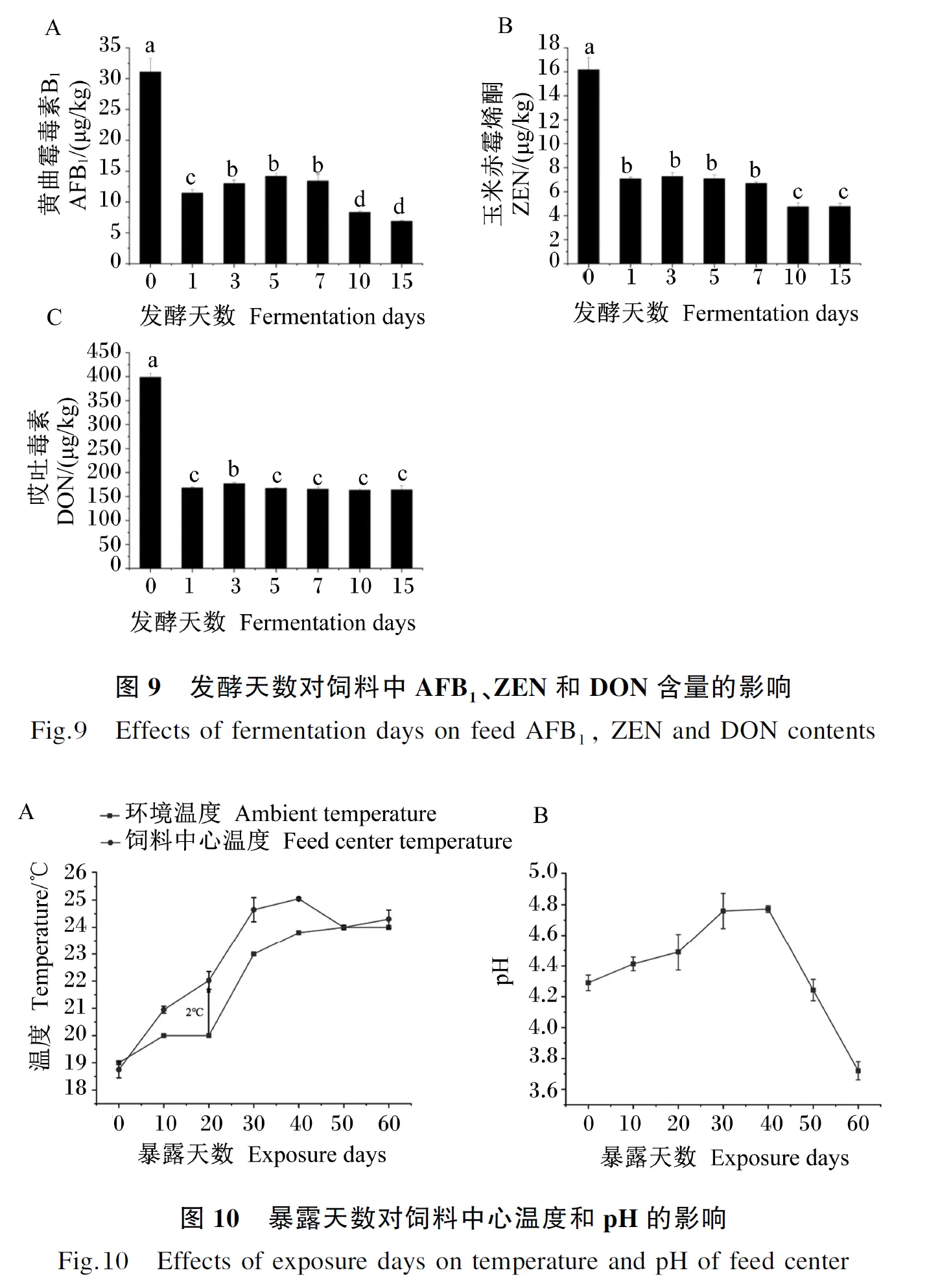
2.3.5 发酵天数对饲料有氧稳定性的影响
从图10可以看出,随着暴露时间的增加,饲料的中心温度逐步升高,当暴露20 d时,饲料的中心温度高出环境温度2 ℃。暴露0~20 d时pH基本在4.5以下,与发酵时的pH基本保持一致,暴露20~30 d期间pH快速升高,暴露40 d时pH达到最高,说明暴露20 d以后饲料开始腐败,饲料的有氧稳定的临界时间为20 d。
3 讨 论
3.1 最优发酵条件的确定
混合菌发酵时的接种量、接种比例、温度、水料比是影响发酵的主要因素[14],接种量的多少会通过改变菌的代谢影响发酵结果,过多则代谢物太多发酵不充分,过少则生长底物剩余。接种比例适宜可促进菌株共同生长,不适宜则两者中的一种对底物消耗太多,影响另一种生长,或者一种大量生长产生过多代谢物抑制另一种生长,影响发酵效果。温度则主要影响酶促效率,由于酵母菌和乳酸菌生长的最适温度不同,在温度的选择上应考虑到两者生长曲线的交叉点,保证两者共同生长。水料比太大影响到氧气的流动,会抑制微生物的生长,太小则底物的溶解度降低,影响底物的利用率。饲料中SS、ST含量较高为宜,NH3-N、pH、毒素含量较低为宜。影响指标的主次顺序与极差的大小呈正相关,结合方差分析可得到G3组最符合要求,即接种量5%,接种比例2∶1,温度30 ℃,水料比1∶1。周静等[15]采用单因素接种比例研究酵母菌和乳酸菌的共生机制时,设置接种比例分别为2∶1、1∶1、3∶2、1∶2,结果发现接种比例为3∶2时总活菌数最多。吝常华[16]研究显示,用芽孢杆菌、Lactobacillusplantarum和Saccharomycescerevisiae发酵豆粕时,最优发酵条件为:接种量15%、水料比1∶1、温度31 ℃;用枯草芽孢杆菌单菌发酵豆粕时,最优发酵条件为:接种量10%、水料比1.2∶1、温度40 ℃。本试验所得到的最优发酵条件部分与上述研究相一致,部分有差别,可能与测定指标、菌种不一致有关。
3.2 发酵条件优化对饲料微生物群落的影响
本试验中G3组饲料中微生物的α多样性和β多样性均高于其他组。乳酸菌是厌氧发酵最主要的细菌[17]。有研究表明,乳酸含量降低,饲料中pH增大,饲料中一些不耐酸的微生物就会大量繁殖,导致微生物的多样性增加[18]。G3、G6、G7组饲料中酵母菌和乳酸菌的接种比例为2∶1,G1、G5、G8组为1∶1,G2、G4、G9组为1∶2,因此G2、G4、G9组饲料中微生物多样性较低。有研究表明酵母菌和乳酸菌混合发酵前5 d,酵母菌可促进乳酸菌的生长[19],从种水平上物种丰富度来看,G3组Lactobacillusbrevis的相对丰度提高,并且还有一部分为Pediococcusacidilactici,因此G3组的多样性最高。同时,在种水平相对丰度上显示,G1组中有少量的Clavibactermichiganensis,G2组中有少量的Brevundimonasvesicularis,G5、G8组中有少量的Ralstoniasolanacearum,G6组中有少量的密执安棒状杆菌、Brevundimonasvesicularis。研究表明:Ralstoniasolanacearum、Clavibactermichiganensis都是致病菌,可导致植物萎蔫致死[20-21],Brevundimonasvesicularis也是一种致病菌,但不同于以上的菌种,它能够引起动物肺部感染、败血症、关节炎等疾病[22],因此G1、G2、G5、G6、G8组不符合要求。LEfSe分析发现G1组有葡萄球菌,G9组有明珠串球菌,而葡萄球菌为致病菌,能产生使血液凝固的酶,以及杀死细胞,明珠串球菌为危害菌,常能使蔬菜、糖类等发黏而影响加工,因此G1、G9组都不符合要求。而对于G3、G4、G7组,G3组中Pediococcusacidilactici的相对丰度高于其他组,Pediococcusacidilactici作为乳酸菌的一类,有助于提高饲料品质,所以G3组相对于其他组更有优势。相关性分析结果显示,乳酸菌对AFB1、ZEN、DON、ST、SS有抑制作用,而片球菌对NH3-N、pH有抑制作用,对ST、SS有促进作用,有研究表明:乳酸菌对AFB1、ZEN、DON都有一定的降解能力,而乳酸菌在发酵过程中需要能量来维持自身的生长,因此ST和SS被消耗。乳酸菌在增殖过程中由于产酸而使得pH降低,因而抑制蛋白酶的活性,使得蛋白质损耗减少,从而对NH3-N起抑制作用[23],LEfSe分析发现G3组主要以Pediococcus、Lactobacillus为主,因此G3组符合要求。
3.3 复合益生菌发酵对饲料营养成分及pH的影响
饲料中NDF、ADF和CP的含量是评价饲料品质最重要的指标,NDF和ADF含量越低,CP含量越高,表明饲料品质越好[24]。NDF、ADF含量降低的原因可能与发酵过程中产生分解纤维的酶类将植物细胞壁中的纤维降解为水溶性碳水化合物有关[25]。本试验中,发酵到第5天时饲料中纤维素酶的活性最高,因此发酵到第5天时饲料中NDF、ADF的含量最低。蛋白质含量提高的原因可能是在发酵初期,乳酸菌大量繁殖,酵母菌同时促进乳酸菌的生长,抑制了有害微生物的繁殖,减少了发酵初期植物呼吸作用对蛋白质的水解[26]。ST含量较低的原因可能是加入的乳酸菌数量充足,大量同型发酵乳酸菌在发酵前期快速产酸需要消耗能量以维持自身生长,发酵过程中更多的ST被利用[27]。乳酸发酵过程中产生的乙酸也抑制了酵母菌等其他微生物的活动,使pH维持在低水平下,蛋白酶活性受到抑制,从而减少了NH3-N的产生[23]。SS含量降低的主要原因是发酵期间乳酸菌活动旺盛,消耗的SS较多。pH降低的原因是乳酸菌和酵母菌在发酵过程中产酸导致酸度增加。罗撄宁等[28]在甜玉米籽青贮中加入乳酸菌后,NH3-N含量显著降低。王小平等[29]用酵母菌和乳酸菌的复合菌剂对玉米青贮发酵,结果显示玉米青贮的CP含量显著升高,NDF、ADF含量显著下降。程方等[30]使用黑曲霉和啤酒酵母对马铃薯渣进行发酵,发现马铃薯渣的CP含量及蛋白酶、纤维素酶活性均显著提高,粗纤维(CF)含量显著降低。王志敬等[31]对凤梨渣进行青贮发酵,结果显示,与发酵第0天相比,发酵后的凤梨渣NH3-N含量显著上升,SS含量、pH显著下降。王平[32]探究了乳酸菌发酵对玉米淀粉的影响,结果表明发酵第4天后玉米淀粉含量开始下降。不同研究结果不一致的原因可能是所用的菌株不同,产酶与产酸的速率不同。因此,可以认为复合益生菌发酵可以提高饲料的营养水平,降低pH。
3.4 复合益生菌发酵对饲料中酶活性的影响
随着发酵天数的增加,乳酸菌不断生长,将乳糖分解为半乳糖和葡萄糖,从而为酵母菌的生长提供能量,酵母菌大量繁殖,分泌纤维素酶,促进了植物纤维素的降解,同时酵母菌利用乳酸盐促进了乳酸菌的生长,乳酸菌产生淀粉酶、脂肪酶、蛋白酶,促进了植物饲料中ST、甘油三酯、肽链的水解[33]。本试验中,发酵到第5天时,饲料中的纤维素酶、脂肪酶、酸性蛋白酶、α-淀粉酶活性较第0天时显著提高,β-淀粉酶活性差异不显著,但总淀粉酶活性上升,与上述研究结果相一致,而后期随着乳酸菌和酵母菌生长底物的消耗,两者的生长缓慢,代谢减慢,分泌的酶减少。由此可以认为,复合益生菌发酵可以降解饲料中的大分子物质,使得饲料更容易被消化吸收。
3.5 复合益生菌发酵对饲料中霉菌毒素含量的影响
饲料在制备的过程中不可避免地会感染到少数霉菌,这些霉菌通过代谢会分泌霉菌毒素,如AFB1、ZEN、DON等,动物进食被霉菌毒素感染的饲料后健康遭受危害,已有研究表明益生菌发酵可以降低饲料中霉菌毒素含量[34]。生物吸附是微生物的细胞壁中的碳水化合物对毒素进行物理以及化学吸附,微生物发酵是发酵所产生的代谢产物通过破坏毒素的结构而使其变成低毒产物,从而达到安全、稳定、脱毒比较彻底的效果[35]。Bovo等[36]使用Lactobacillusrhamnosus吸附处理AFB1,结果发现只有未被破坏细胞壁的Lactobacillusrhamnosus对AFB1有一定吸附能力。Hernandez-Mendoza等[37]研究发现,Lactobacilluscasei也可以降解AFB1,降解率达49.2%。刘畅等[38]研究显示,Saccharomycescerevisiae同样可以降解AFB1,降解率达81.16%。Niderkorn等[39]研究发现,乳酸菌对DON有较强的清除能力。Repedkiene等[40]研究显示,Saccharomycescerevisiae对DON有良好的吸附能力。赵雪芹等[41]用6种益生菌对ZEN和DON进行了降解,结果发现Pediococcusacidilactici对ZEN的降解率达16.32%,对DON的降解率达75.51%。Wang等[42]研究发现,Lactobacillusrhamnosus和Saccharomycescerevisiae均能降解ZEN,其中Lactobacillusrhamnosus对ZEN的降解率达46%。本试验所得结果显示,在发酵第10天时,AFB1含量降低了73.27%,DON含量降低了59.01%,ZEN含量降低了70.59%,ZEN含量的降低程度高于上述前人研究结果,AFB1、DON含量的降低程度都在前人研究范围内,对ZEN含量的降低程度提高可能与本试验中乳酸菌和酵母菌的相互促进有关。综上可知,复合益生菌发酵可以降低饲料中霉菌毒素的含量。
3.6 复合益生菌发酵对饲料有氧稳定性的影响
发酵饲料的有氧稳定性是评价其是否发生腐败变质的重要指标,评价方法是将发酵好的饲料暴露在空气中,通过测定饲料中心温度以及环境温度,两者温度之差达到2 ℃时的时间即为有氧稳定的临界时间,超过该时间则发酵饲料开始腐败变质[43]。同样,pH也是衡量发酵饲料有氧稳定性的一个重要指标[44]。发酵饲料暴露在空气中与氧气充分接触,导致酵母菌、霉菌等好氧微生物大量增殖,会引起温度和pH的异常升高,导致发酵饲料的有氧稳定性降低[45]。有研究表明,同型发酵的乳酸菌产生的乙酸过少,导致有氧稳定性差。不同的是,异型发酵的乳酸菌可以产生更多的乙酸,可以抑制好氧发酵,抑制酵母菌和霉菌的生长,而Lactobacillusrhamnosus和Lactobacilluscasei均可以进行异型发酵,从而防止饲料过早的腐败变质,提高发酵饲料的有氧稳定性。Kleinschmit等[46]对玉米青贮饲料的有氧稳定性进行了评价,发现没有添加乳酸菌的玉米青贮饲料的有氧稳定临界时间为25 h,布氏乳杆菌的添加量达到105CFU/g后有氧稳定临界时间为35 h,布氏乳杆菌的添加量超过105CFU/g后,有氧稳定临界时间达到503 h。本试验中添加了Lactobacillusrhamnosus和Lactobacilluscasei,并且添加量均超过105CFU/g,其有氧稳定临界时间为480 h,与上述研究结果接近。本试验中有氧暴露20~30 d时,发酵饲料的pH开始大幅度升高,表明此时pH出现异常升高,结合温度变化的时间节点,可知发酵饲料的有氧稳定临界时间为20 d,说明本试验的复合益生菌可以提高发酵饲料的有氧稳定性。
4 结 论
① 精补料的最优发酵条件:接种量5%,接种比例2∶1、温度30 ℃、水料比1∶1。该发酵条件能够有效提高发酵饲料中微生物的多样性,提高Lactobacillusbrevis的相对丰度。
② 精补料的最佳发酵时间为5 d,该发酵时间可提高发酵饲料的营养成分含量,降低霉菌毒素含量。
③ 发酵结束开盖后,发酵饲料应在20 d内喂完。
