蛛网膜下腔出血患者脑血管痉挛危险因素分析
2022-06-10张峰涛王冠军赵中甫
张峰涛,王冠军,赵中甫
(许昌市中心医院神经外科,河南 许昌 461000)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是神经科最常见的急症之一,约占急性脑血管病的10%[1-2]。脑血管痉挛(cerebral vasospasm spasm,CVS)是一种异常血管状态,主要由颈内动脉或椎基底动脉系统受到刺激而引发[3]。CVS是SAH最为常见且最为严重的并发症之一,常导致严重的局部脑组织缺血或迟发性缺血性脑损害,甚至脑死亡,是患者致残、致死的主要原因[4]。目前,SAH后CVS的发生机制及其相关危险因素尚未明确[5],因此,明确相关危险因素对防治SAH后CVS及降低患者致残率和病死率等具有重要意义。本研究旨在分析SAH后发生CVS的危险因素,为防治SAH后CVS提供依据。
1 资料与方法
1.1 一般资料选择2018年5月至2020年5月许昌市中心医院神经外科收治的SAH患者为研究对象。病例纳入标准:(1)所有患者符合SAH诊断标准[6],SAH患者符合CVS诊断标准[7];(2)临床资料完整。排除标准:(1)合并其他脑血管疾病;(2)中途退出研究及失访者。本研究共纳入SAH患者96例,男42例,女54例;年龄27~75(45.32±6.83)岁。依据是否发生CVS将患者分为SAH组(SAH后未发生CVS,n=50)和SAH+CVS组(SAH后发生CVS,n=46)。本研究通过医院医学伦理委员会批准,所有患者和(或)家属签署知情同意书。
1.2 临床资料采集通过查阅病历收集2组患者的相关临床资料,主要包括性别、年龄、Fisher分级、Hunt-Hess分级、意识障碍、吸烟、饮酒、高血压、高血糖、白细胞计数、血钙水平、Fisher分级、Hunt-Hess分级等。
1.3 统计学处理应用SPSS 26.0软件进行统计分析。计数资料以例数和百分率表示,组间比较采用χ2检验;采用logistic回归分析SAH患者发生CVS的危险因素;P<0.05为差异有统计学意义。
2 结果
2.1 SAH患者发生CVS的危险因素单因素分析结果见表1。单因素分析结果显示,年龄、Fisher分级、Hunt-Hess分级、意识障碍、吸烟、高血压、白细胞计数、血钙水平与SAH患者发生CVS有关(P<0.05),性别、饮酒、高血糖与SAH患者发生CVS无关(P>0.05)。
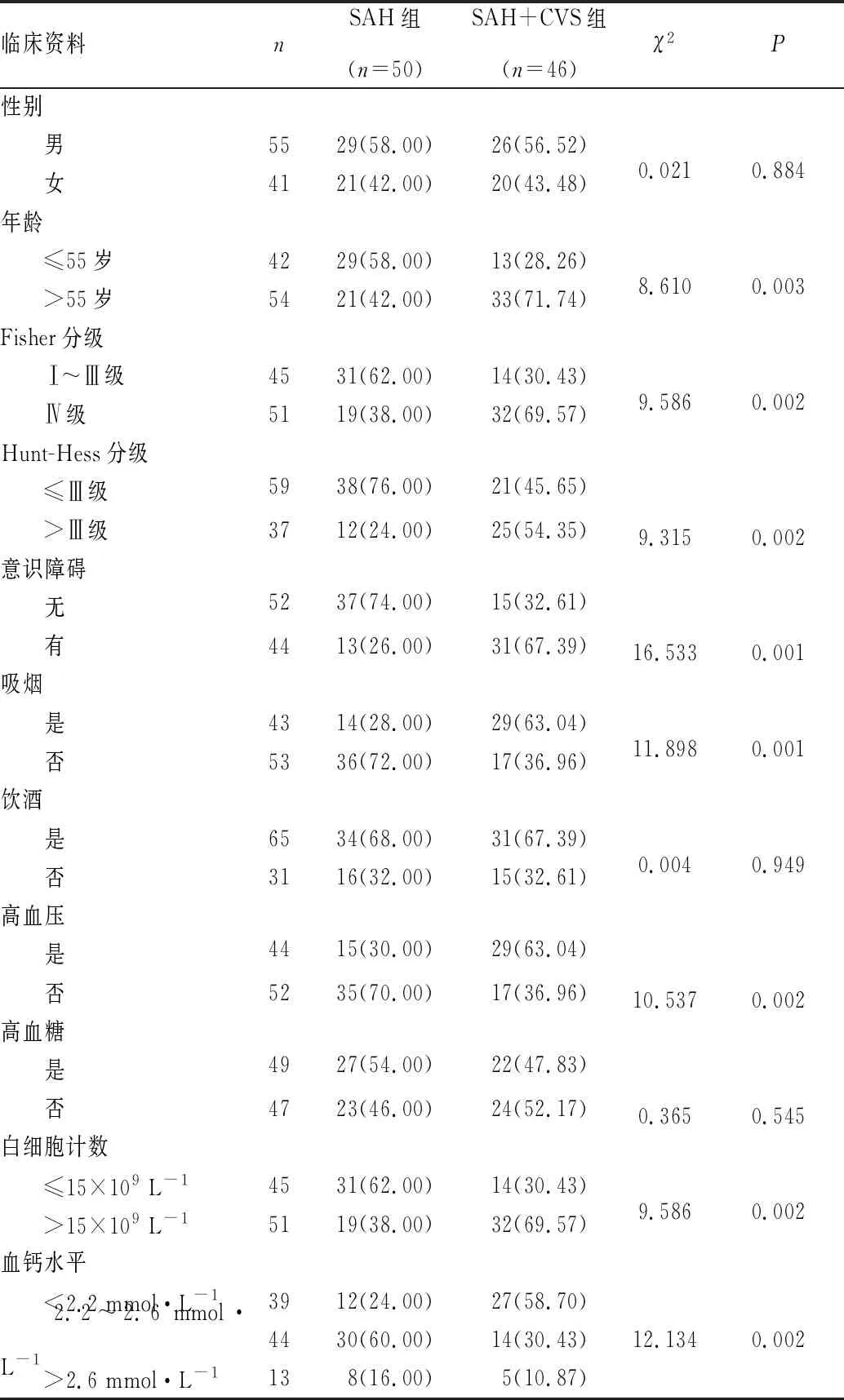
表1 2组患者临床资料比较
2.2 SAH患者发生CVS的危险因素多因素logistic分析结果见表2。以单因素分析结果中差异有统计学意义的因素为自变量,并进行赋值:年龄(≤55岁=2,>55岁=1)、Fisher分级(Ⅰ~Ⅲ级=2,Ⅳ级=1)、Hunt-Hess分级(≤Ⅲ 级=2,>Ⅲ 级=1)、发病意识(有=2,无=1)、吸烟(是=1,否=2)、高血压(是=1,否=2)、白细胞计数(≤15×109L-1=2,>15×109L-1=1)、血钙水平(<2.2 mmol·L-1=1,>2.6 mmol·L-1=2,2.2~2.6 mmol·L-1=3),以SAH后是否发生CVS为因变量(SAH+CVS组=1,SAH组=2),纳入二分类非条件logistic回归模型进行分析,结果显示,年龄>55岁、Fisher分级Ⅳ级、Hunt-Hess分级>Ⅲ 级、意识障碍、高血压、白细胞计数>15×109L-1、血钙水平<2.2 mmol·L-1为SAH患者发生CVS的独立危险因素(P<0.05)。
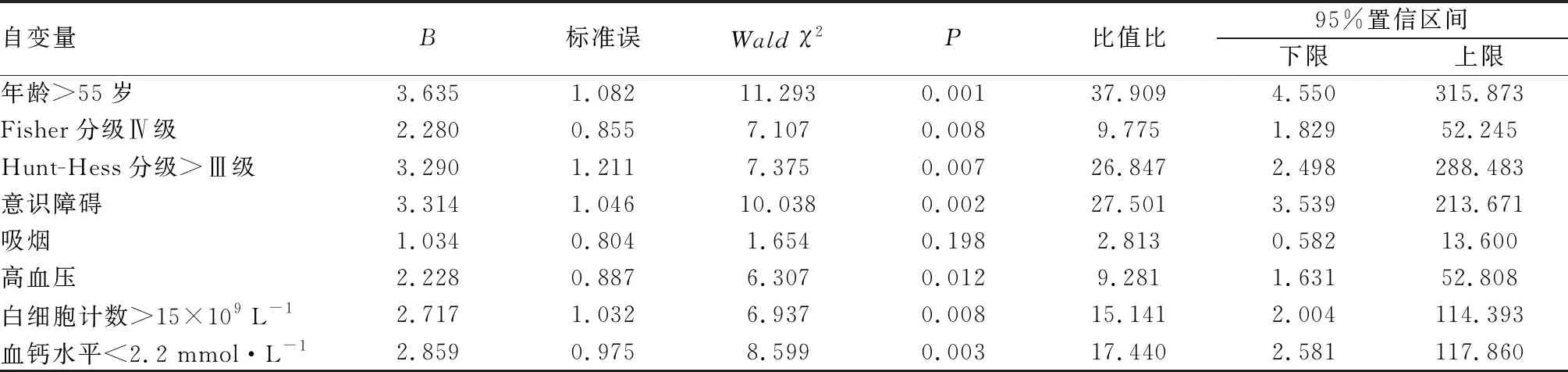
表2 SAH患者发生CVS的危险因素logistic回归分析
3 讨论
CVS是颈内动脉或椎基底动脉系统受到各种物理、化学因素刺激而引发的一种异常血管状态,为SAH最常见的并发症之一,一般发生于SAH后3~4 d,第2周时病情最为严重,可持续至第3~4周[8]。CVS的病理过程较为复杂,SAH后血液释放氧和血红蛋白、组胺等血管活性物质,进而刺激血管,导致血管痉挛,这一过程与多种因素存在紧密关联[9]。CVS是导致SAH患者迟发性脑缺血和迟发性脑梗死的重要因素,为SAH致残及致死的主要原因[10-11]。因此,分析SAH后发生CVS的危险因素对防治SAH后CVS具有重要意义。
本研究结果显示,年龄>55岁、Fisher分级Ⅳ级、Hunt-Hess分级>Ⅲ级、意识障碍、高血压、白细胞计数>15×109L-1、血钙水平<2.2 mmol·L-1为SAH后发生CVS的独立危险因素。MIJITI等[12]研究显示,SAH后CVS发生率与患者年龄有关,这与本研究结果相符合。Fisher分级可反映蛛网膜下腔的出血量,Hunt-Hess分级可反映动脉瘤性SAH的临床状态,二者均与CVS发生有关,Fisher分级和Hunt-Hess分级等级越高,SAH后并发CVS的风险越大;蛛网膜下腔积血可促使内皮素等缩血管物质大量产生,进而引发血管痉挛;且蛛网膜下腔的血凝块可对血管壁产生机械性牵拉与压迫,通过神经反射引发血管痉挛,此时,持续的血管痉挛可使内皮细胞进一步受到损害,缩血管物质释放更多,形成恶性循环,从而导致CVS。CVS为SAH迟发性脑缺血、脑梗死的主要诱因之一,意识障碍是CVS患者的常见临床表现,患者由清醒转为嗜睡或昏迷,或者由昏迷到清醒到再次昏迷,提示患者中枢神经系统存在不同程度的损伤,故发病时存在意识障碍者更容易并发CVS。有研究显示,SAH患者的CVS与脑池中出血量密切相关,而脑池中出血量与高血压呈显著正相关[13],因此,伴高血压的SAH患者出血量相对较大,对血管壁的机械性牵拉与压迫力较大,在神经反射下血管痉挛风险明显升高,更容易并发CVS。白细胞中的T淋巴细胞与B淋巴细胞等可释放多种细胞因子,促进儿茶酚胺等缩血管物质分泌,并激发免疫反应,从而诱导血管痉挛,持续的血管痉挛可造成血管内皮细胞损伤,缩血管物质大量释放,进而导致CVS[14];有研究显示,阻止白细胞侵入蛛网膜下腔及血管内皮能够降低CVS的发生率[12],进一步提示白细胞异常增高为SAH后发生CVS的独立危险因素。血管平滑肌细胞收缩主要受细胞内钙离子浓度增加与细胞膜去极化影响,CVS是一种异常血管状态,因此,血钙水平很可能与CVS的发生发展有相关性,有研究发现,钙离子拮抗剂尼莫地平可阻断电压门控钙离子通道,减少血管平滑肌细胞钙离子内流,抑制平滑肌收缩,从而舒张血管,缓解痉挛,降低CVS的发生率[15]。还有研究表明,血钙水平与CVS的发生呈显著负相关[16],与本研究结果一致。
综上所述,SAH后CVS发生率较高,其发病机制复杂,涉及众多因素。年龄较大、Fisher分级和Hunt-Hess分级高、意识障碍、高血压、白细胞计数高、血钙水平低为SAH患者发生CVS的独立危险因素,临床应针对CVS发生的危险因素制定相应的防治措施,以降低SAH患者CVS发生率,改善患者预后。但本研究样本量较小,且为单中心研究,尚需多中心、大样本研究进一步证实。
