银杏叶提取物通过脂联素/脂联素受体1/腺苷酸激活蛋白激酶信号通路改善肥胖犬脂质代谢及脂肪沉积的研究
2022-06-10朱道仙卢劲晔
陆 江 朱道仙 卢劲晔 刘 莉 刘 静
(1.江苏农牧科技职业学院宠物科技学院,泰州225300;2.江苏农牧科技职业学院动物医学院,泰州225300)
犬肥胖症是成年犬常见的代谢性疾病,严重危害宠物犬的生活质量,肥胖犬的寿命比体型较瘦犬短,慢性代谢性疾病的发病率高[1]。肥胖还可增加如血脂异常、高血压、2型糖尿病和心血管疾病等相关疾病发生的风险[2]。目前,犬肥胖症的发病率呈现不断上升趋势,肥胖问题已成为小动物临床的一项重大挑战。研究表明,成熟脂肪细胞中脂质代谢的变化与肥胖症发生发展具有相关性[3]。成熟脂肪细胞脂质过度沉积引起的细胞肥大是肥胖发生的主要病理机制,对脂肪细胞脂质代谢和脂肪沉积的调控也成为临床治疗肥胖症的重要环节[4-5]。脂联素(adiponectin,APN)是一种脂肪细胞因子,与脂联素受体1(adiponectin receptor 1,AdipoR1)结合后,可激活腺苷酸激活蛋白激酶(adenosine monophosphate-activated protein kinase,AMPK)[6-7]。AMPK对细胞脂质代谢具有双重调节作用,既可促进脂质分解,又可抑制脂肪酸合成[8]。因此,APN/AdipoR1/AMPK信号通路在改善脂质代谢和脂肪沉积中发挥重要作用,可作为肥胖症防治的潜在靶点。
我国是银杏叶的主要产地,银杏叶中富含黄酮类、萜类、多酚类等多种化合物,具有活血化瘀、降压、降脂、抗氧化等功效[9-10]。大量研究发现银杏叶及其提取物可通过抗氧化作用改善动物血脂水平及体重[11-12],但其对脂肪细胞中脂质代谢和脂肪沉积的影响及作用机制是否与APN/AdipoR1/AMPK信号通路相关尚不清晰。siRNA可通过与特定基因mRNA分子互补结合,降解mRNA,抑制特定基因表达,该技术对研究信号转导通路、发现新的药物作用靶点有重要意义。因此,本研究拟构建肥胖犬模型,以APN/AdipoR1/AMPK信号通路介导的能量代谢途径为切入点,通过siRNA技术沉默APN或AdipoR1基因表达,观察比较不同APN/AdipoR1/AMPK信号通路状态下银杏叶提取物对肥胖犬脂质代谢和脂肪沉积的影响,探究APN/AdipoR1/AMPK信号通路在银杏叶提取物防治肥胖症中的作用,为银杏叶提取物的开发应用提供试验依据,为肥胖症的防治提供新思路。
1 材料与方法
1.1 试验材料
试验动物为泰迪型贵宾犬,由江苏农牧科技职业学院美容试验犬舍提供,雄性,3岁,体重5.5 kg左右。银杏叶提取物(40 mg∶1 mL,其中含银杏黄酮甙9.6 mg,萜类2.4 mg)购于泰州市中医院。基础饲粮为小型犬成年犬粮(粗蛋白质含量≥24.5%,粗脂肪含量≥13.0%,粗纤维含量≤5.0%),购于上海比瑞吉宠物用品股份有限公司。
1.2 试验器材
试验器材主要有EchoMRI体成分分析仪(EchoMRI LLC,美国)、多功能酶标仪(Tecen Austria GmbH,澳大利亚)、荧光定量PCR仪(ABI,美国)、电泳仪(Bio-Rad,美国)、化学发光凝胶成像分析系统(JS-1060,上海培清科技有限公司)等。
1.3 试验试剂
甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)和APN检测试剂盒均购自南京建成生物工程研究所。苏木精-伊红(HE)染色试剂盒购自上海威奥生物科技有限公司。TRIzol试剂盒、cDNA反转录试剂盒及SYBR试剂盒购自日本TaKaRa公司。RIPA裂解液、BCA蛋白定量试剂盒、聚偏氟乙烯(PVDF)膜购自武汉博士德生物工程有限公司。兔源APN抗体、AdipoR1抗体、腺苷单磷酸活化蛋白激酶α1(AMPKα1)抗体、乙酰辅酶A羧化酶1(ACC1)抗体、脂肪酸合成酶(FAS)抗体、肉毒碱棕榈酰基转移酶-1(CPT-1)抗体、固醇调节元件结合蛋白-1(SREBP-1)抗体、甘油醛-3-磷酸脱氢酶(GAPDH)抗体及羊抗兔二抗等均购自Abcam公司。APN-siRNA(干扰靶点序列为5’-AGCTGTTCTACTGCTACTAGTCC-3’)、AdipoR1-siRNA(干扰靶点序列为5’-CCCAACCAAAGCTGAAGAAGAGC-3’)以及与目的基因序列无同源性的阴性siRNA(N-siRNA)均根据网站http://sidirect2.rnai.jp/设计并由上海生工生物工程有限公司合成。
1.4 试验方法
50只泰迪型贵宾犬被单笼饲养在环境温度为(24±3) ℃、相对湿度为60%左右、通风良好的动物房中,适应性饲养2周后将上述试验犬随机分成2组:对照组(A组,n=6)和高脂饲粮组(n=44),分别饲喂基础饲粮和高脂饲粮(基础饲粮+25%猪油)。饲养8周后,淘汰高脂饲粮组中增重较低的肥胖抵抗型犬,参考Murai等[13]方法以体重增幅大于15%为建模成功标准,筛选出30只肥胖模型犬。然后将这30只肥胖模型犬随机等分为5组:高脂饲粮对照组(B组,n=6)、银杏叶提取物组(C组,n=6)、N-siRNA对照组(D组,n=6)、APN-siRNA组(E组,n=6)和AdipoR1-siRNA组(F组,n=6)。A组继续饲喂基础饲粮,其他各组继续饲喂高脂饲粮,同时C组、D组、E组和F组参考预试验结果每天按50 mg/kg BW的剂量灌服银杏叶提取物,A组和B组则灌服等量生理盐水。此外,D组、E组和F组分别在腹部皮下注射500 μL相应的siRNA,A组、B组和C组注射等体积生理盐水,每周3次,试验周期为4周。试验结束后第2天早晨,空腹经桡外侧静脉采血,3 000 r/min离心5 min后分离血清,置于-80 ℃冰箱;然后用846合剂麻醉试验犬,迅速取腹部皮下脂肪组织,一部分保存于10%中性福尔马林溶液,另一部分先存于液氮中后转移至-80 ℃冰箱中保存。
1.5 体重及体脂率测定
试验结束后用宠物电子称测定试验犬的体重,用EchoMRI体成分分析仪测定体脂率。
1.6 血清生化指标检测
血液采集当天用相应试剂盒测定血清APN、TG、TC、LDL-C和HDL-C含量。
1.7 皮下脂肪组织中脂肪细胞大小检测
试验犬麻醉后收集腹部中线附近的皮下脂肪组织样本,并立即在10%中性福尔马林溶液中固定。石蜡切片和HE染色步骤如下:从福尔马林溶液中取出样品,脱水并包埋在石蜡中,切片,HE染色,中性胶密封。在普通显微镜下观察图像并保存纪录,使用Image J软件计算细胞横切面面积。
1.8 实时荧光定量PCR(qRT-PCR)检测
用TRIzol法提取脂肪组织总RNA,通过逆转录合成cDNA并用于实时荧光PCR扩增。靶基因的引物由上海生工生物工程有限公司合成(表1)。以β-肌动蛋白(β-actin)为内参基因,PCR扩增35个循环:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s。每个样本进行3次平行,将A组目的基因mRNA相对表达量的平均值设为1,其他组目的基因mRNA的相对表达量用2-ΔΔCt法计算。
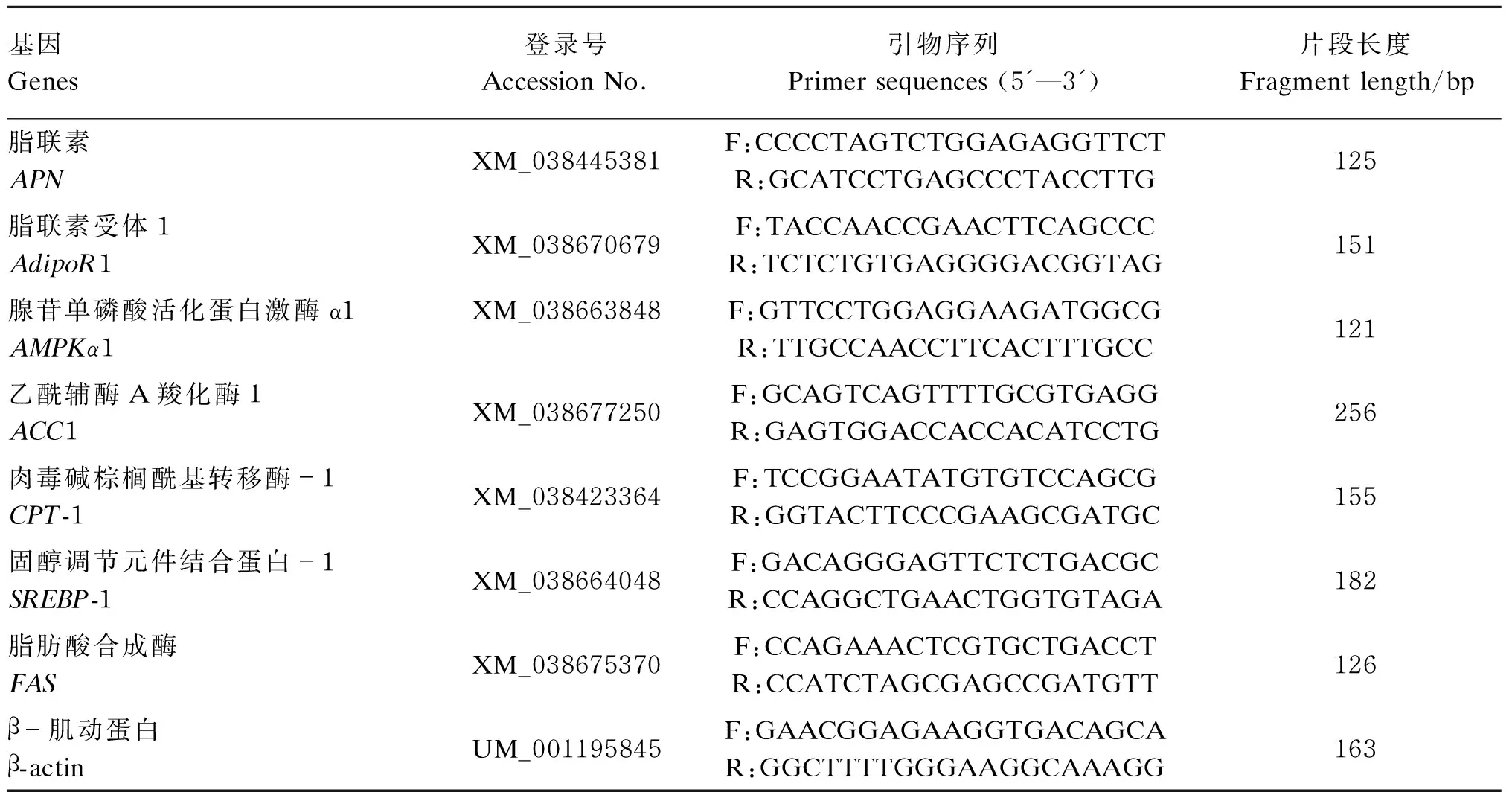
表1 PCR引物序列
1.9 Western blot检测
用RIPA裂解液提取皮下脂肪组织总蛋白,用BCA法测量蛋白浓度后取等量蛋白质样品(50 μg/孔)上样,进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)2 h,PVDF膜转膜2 h,用5%脱脂牛奶室温封闭2 h。加一抗APN(1∶3 000)、AdipoR1(1∶3 000)、AMPKα1(1∶2 000)、ACC1(1∶2 000)、CPT-1(1∶2 000)、SREBP-1(1∶3 000)、FAS(1∶2 000)和GAPDH(1∶5 000),置于4 ℃摇床中孵育过夜,TBST洗膜3次,每次5 min。然后加二抗(1∶5 000)室温下孵育1 h,化学发光成像仪中显影成像。以GAPDH为内参,通过灰度比计算各组目的蛋白相对表达量。重复检测3次,取平均值。
1.10 数据处理
试验结果用平均值±标准差表示,2组间数据用SPSS 23.0软件的t检验进行比较。P<0.05为差异显著,P<0.01为差异极显著。
2 结 果
2.1 体重及体脂率的变化
如图1所示,B组体重和体脂率均显著高于A组(P<0.05),C组体重和体脂率均显著低于B组(P<0.05),D组体重和体脂率与C组无显著差异(P>0.05),E组与F组体重和体脂率均显著高于C组(P<0.05)。
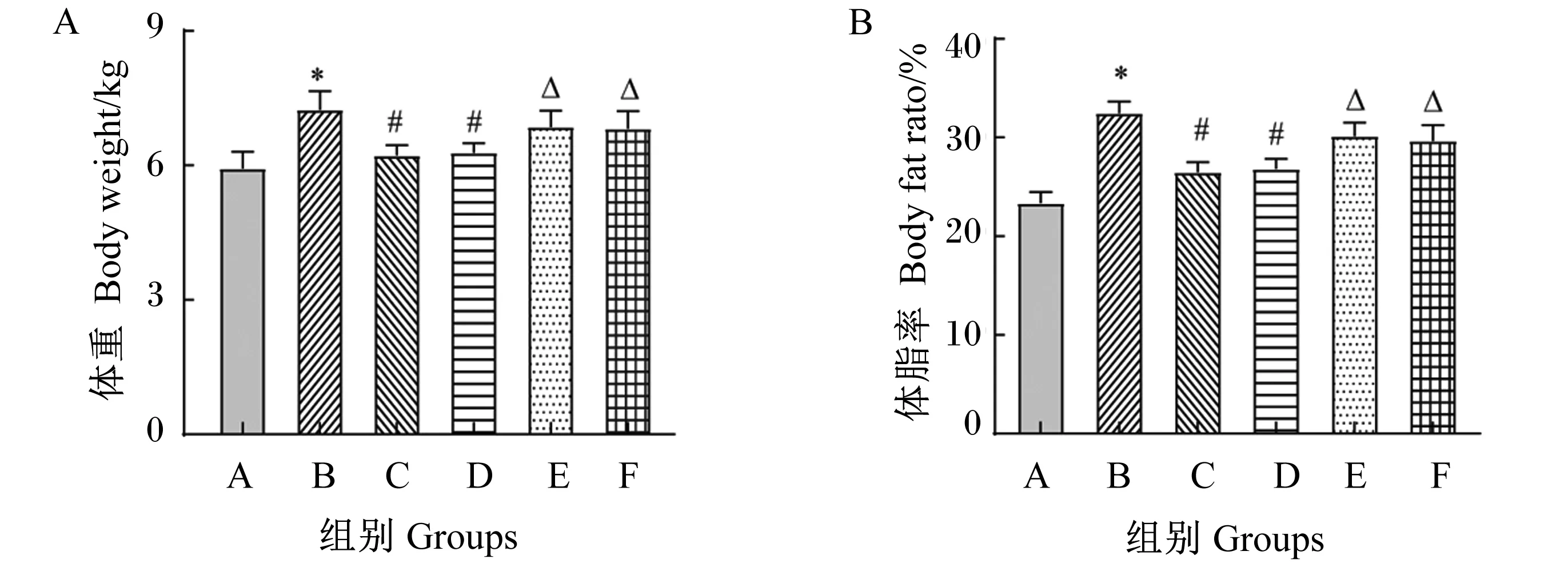
数据柱上标“*”表示与A组比较差异显著(P<0.05),“#”表示与B组比较差异显著(P<0.05),“Δ”表示与C组比较差异显著(P<0.05)。下图同。
2.2 血清生化指标的变化
由表2可知,B组的血清TG、TC及LDL-C含量显著高于A组(P<0.05),HDL-C和APN含量显著低于A组(P<0.05);C组的血清TG、TC及LDL-C含量显著低于B组(P<0.05),HDL-C和APN含量显著高于B组(P<0.05);D组的各项血清生化指标与C组无显著差异(P>0.05);E组和F组的血清TG、TC及LDL-C含量显著高于C组(P<0.05),HDL-C含量显著低于C组(P<0.05),同时E组的血清APN含量显著低于C组(P<0.05)。

表2 血清生化指标的变化
2.3 皮下脂肪组织中脂肪细胞大小的变化
通过HE染色对脂肪组织进行形态学观察,发现各组脂肪组织结构较为完整,脂肪细胞排列整齐,但各组脂肪细胞大小差别较大,B组脂肪细胞较其他组增大(图2-a)。从图2-b可知,B组脂肪细胞面积显著大于A组(P<0.05),C组脂肪细胞面积显著小于B组(P<0.05),E组、F组脂肪细胞面积显著大于C组(P<0.05),D组脂肪细胞面积与C组无显著差异(P>0.05)。相关性分析发现,脂肪细胞面积与体重呈正相关关系(r=0.886,P<0.001,图2-c),与血清APN含量呈负相关关系(r=-0.858,P<0.001,图2-d)。

a:脂肪组织HE染色结果;b:脂肪细胞面积;c:脂肪细胞面积与体重的相关性;d:脂肪细胞面积与血清脂联素含量的相关性。
2.4 脂肪组织中APN/AdipoR1/AMPK信号通路相关分子的基因表达变化
从图3-a至图3-c可知,B组APN、AdipoR1和AMPKα1的mRNA相对表达量显著低于A组(P<0.05),C组APN、AdipoR1和AMPKα1的mRNA相对表达量显著高于B组(P<0.05),E组APN和AMPKα1的mRNA相对表达量显著低于C组(P<0.05),F组AdipoR1和AMPKα1的mRNA相对表达量显著低于C组(P<0.05),D组与C组之间APN、AdipoR1和AMPKα1的mRNA相对表达量差异不显著(P>0.05)。APN/AdipoR1/AMPK信号通路下游基因mRNA的表达结果见图3-d至图3-g,可以看出:B组ACC1、SREBP1和FAS的mRNA相对表达量显著高于A组(P<0.05),C组显著高于B组(P<0.05),E组和F组显著高于C组(P<0.05),D组与C组无显著差异(P>0.05);B组CTP-1的mRNA相对表达量显著低于A组(P<0.05),C组显著高于B组(P<0.05),E组和F组显著高于C组(P<0.05),D组与C组无显著差异(P>0.05)。
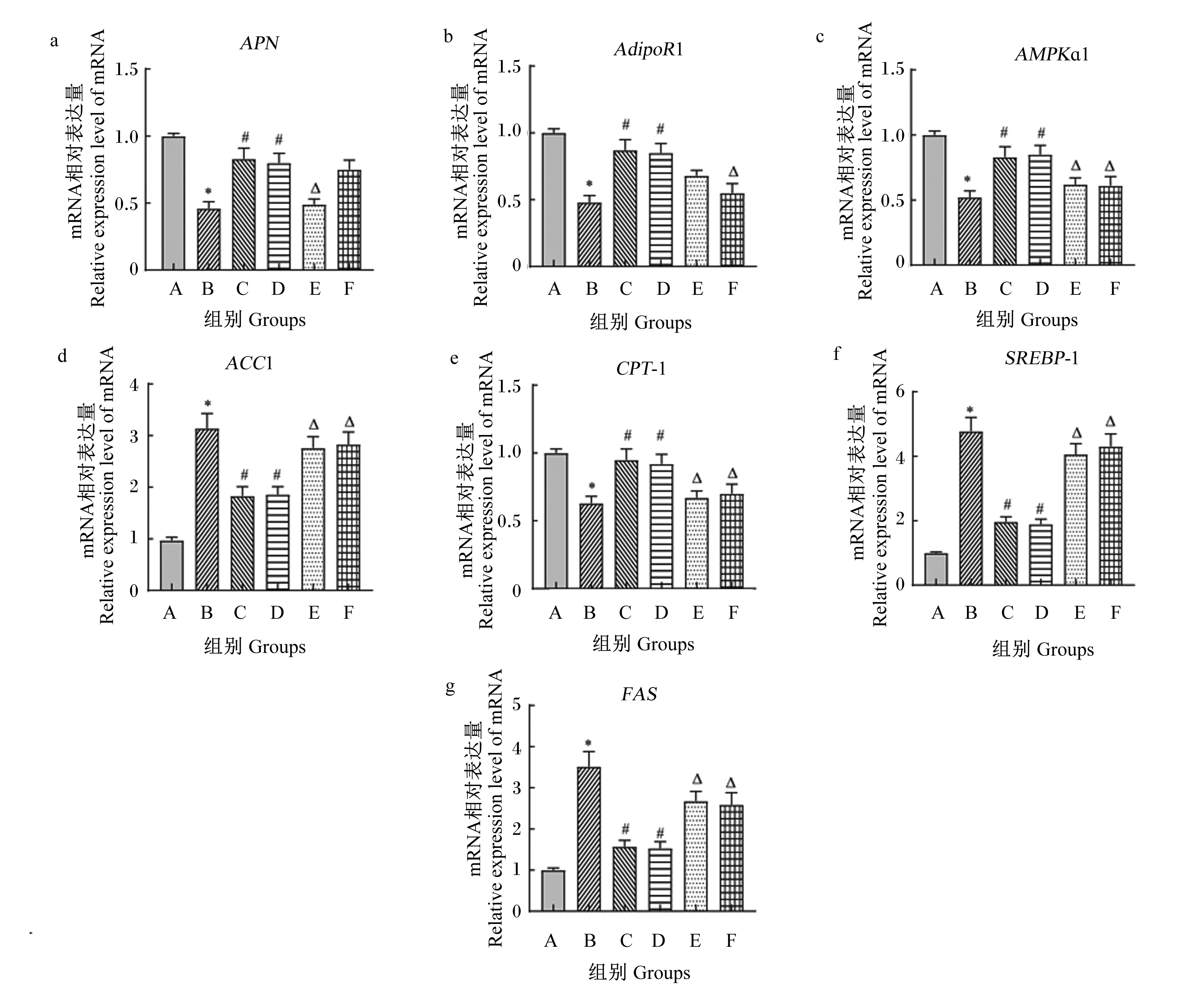
APN:脂联素;AdipoR1:脂联素受体1;AMPKɑ1:腺苷单磷酸活化蛋白激酶α1;ACC1:乙酰辅酶A羧化酶1;CPT-1:肉毒碱棕榈酰基转移酶-1;SREBP1:固醇调节元件结合蛋白-1;FAS:脂肪酸合成酶。
2.5 脂肪组织中APN/AdipoR1/AMPK信号通路相关分子蛋白相对表达量的变化
如图4-a至图4-e所示,B组APN、AdipoR1、磷酸化AMPKα1(p-AMPKα1)和AMPK的蛋白相对表达量均显著低于A组(P<0.05),C组APN、AdipoR1、p-AMPKα1和AMPK的蛋白相对表达量均显著高于B组(P<0.05),E组APN、p-AMPKα1和AMPK以及F组AdipoR1和p-AMPKα1的蛋白相对表达量均显著低于C组(P<0.05),D组APN、AdipoR1、p-AMPKα1和AMPK的蛋白相对表达与C组无显著差异(P>0.05)。如图4-f、图4-g所示,B组ACC1、SREBP-1及FAS等APN/AdipoR1/AMPK信号通路下游分子的蛋白相对表达量显著高于A组(P<0.05),而CTP-1的蛋白相对表达量显著低于A组(P<0.05);C组ACC1、SREBP-1及FAS的蛋白相对表达量显著低于B组(P<0.05),CTP-1的蛋白相对表达量显著高于B组(P<0.05);E组和F组ACC1、SREBP-1及FAS的蛋白相对表达量显著高于C组(P<0.05),CTP-1的蛋白相对表达量显著低于C组(P<0.05),D组ACC1、CTP-1、SREBP-1及FAS的蛋白相对表达量与C组无显著差异(P>0.05)。

APN:脂联素;AdipoR1:脂联素受体1;p-AMPKα1:磷酸化腺苷单磷酸活化蛋白激酶α1;AMPKɑ1:腺苷单磷酸活化蛋白激酶α1;ACC1:乙酰辅酶A羧化酶1;CPT-1:肉毒碱棕榈酰基转移酶-1;SREBP-1:固醇调节元件结合蛋白-1;FAS:脂肪酸合成酶。
3 讨 论
肥胖是由机体能量代谢失衡所引起的[14]。长期的能量摄入大于消耗会导致脂肪组织脂质代谢异常,TG大量沉积于白色脂肪组织,从而导致肥胖[15]。高脂饮食是高能量摄入的常见原因,因此也成为动物肥胖症造模的主要方法。陈其燕等[16]用脂肪供能45%的高脂饲粮成功建立肥胖小鼠模型,Grant等[1]用含24.3%脂肪的饲粮建立了肥胖犬模型。本研究中,用含25%猪油的饲粮饲喂8周后,体重高于饲喂正常饲粮的对照组,表明高脂饲粮是诱导犬肥胖的一种行之有效的方法。
研究表明,脂肪细胞肥大和/或增生引起的白色脂肪组织扩张在肥胖发生发展扮演着重要角色[17]。脂肪细胞大小是代谢性疾病的独立预测因子,脂肪细胞肥大与肥胖、胰岛素抵抗和血脂异常相关[18],与小脂肪细胞相比,肥大的脂肪细胞具有更大的脂聚性和对胰岛素作用的抵抗性[19],且脂肪细胞发生肥大往往先于增生[20],提示脂肪细胞肥大与肥胖症发生密切相关。脂肪组织功能紊乱可导致脂肪细胞存储和动员脂质的能力受到干扰,出现脂质合成增加、脂质分解减少或脂质输出减少等病理变化,从而引起脂质积聚,脂肪组织肥大,脂肪组织重量增加,发生肥胖等代谢性疾病[21]。APN是脂质代谢的一种重要调节因子,可通过APN/AdipoR1/AMPK信号通路发挥调节脂质代谢作用,AMPK是机体的能量感受器,磷酸化后可通过AMPK/乙酰辅酶A羧化酶(ACC)/CTP-1信号通路,抑制ACC活化,上调CTP-1表达,促进脂肪酸进入线粒体,增加脂肪酸的β氧化[22],还可通过AMPK/SREBP-1/FAS通路,抑制SREBP-1和FAS的表达,从而抑制脂质合成[12]。因此,APN/AdipoR1/AMPK信号通路受到抑制后,可促进细胞脂肪沉积。本研究结果显示,银杏叶提取物干预可显著上调肥胖犬脂肪组织中APN、AdipoR1、AMPKα1和p-AMPKα1的蛋白表达,下调下游脂代谢因子ACC1、SREBP-1及FAS的蛋白表达,减小脂肪细胞面积,改善肥胖症状。这些研究结果表明,银杏叶提取物改善肥胖犬症状可能与其通过APN/AdipoR1/AMPK信号通路调控脂肪细胞脂质沉积和脂质代谢有关。
siRNA具有高效性和特异性,是一种重要的基因调控技术,为研究分子间相互作用的研究提供了新的手段[23]。体内给药时,局部给药可增强siRNA的组织特异性,减轻siRNA对其他组织的副作用,从而更好地发挥对靶基因mRNA的沉默作用[24]。为了进一步证明APN/AdipoR1/AMPK信号通路在银杏叶提取物治疗肥胖症中的作用,通过皮下局部注射分别给予APN-siRNA和AdipoR1-siRNA,沉默肥胖犬脂肪组织中APN和AdipoR1的基因表达,然后观察银杏叶提取物对肥胖的干预作用。试验结果表明,与单纯给予银杏叶提取物组(C组)比较,肥胖犬沉默APN或AdipoR1基因表达同时给予银杏叶提取物组(E组或F组)AMPKα1和p-AMPKα1的蛋白相对表达量较低,APN/AdipoR1/AMPK信号通路的下游脂质代谢相关因子ACC1、SREBP-1及FAS的蛋白相对表达量较高,脂肪细胞面积较大,体重较高,而给予N-siRNA对银杏叶提取物作用的影响不大。由此可见,抑制APN或AdipoR1基因表达可以减弱银杏叶提取物对犬肥胖症的干预效果,提示APN/AdipoR1/AMPK信号通路在银杏叶提取物改善肥胖犬的脂质代谢和脂肪沉积过程中具有重要作用。
4 结 论
银杏叶提取物能够通过激活APN/AdipoR1/AMPK信号通路来调控肥胖犬的脂质代谢和脂肪沉积,从而减少脂肪细胞面积,发挥减重降脂的作用。
