INHβB、FSHR和LHR在牦牛不同生殖生理阶段卵巢组织中的表达及差异性分析
2022-06-10王军乾潘阳阳龙亚丽高泽川马文斌钟董兰余四九王立斌
王军乾,赵 凌,潘阳阳,王 萌,龙亚丽,高泽川,马文斌,钟董兰,余四九,王立斌*
(1.甘肃农业大学动物医学院,甘肃兰州 730070;2.甘肃省牛羊胚胎工程技术研究中心,甘肃兰州 730070)
牦牛(Bosgrunniens)是生活在高寒低氧环境下的一种特有畜种,也是当地牧民重要的生活资料和经济来源[1]。其生活环境十分恶劣,生产性能差,性成熟期晚,繁殖率很低。因此,研究牦牛生殖生理活动对提高牦牛繁殖率和增加牧民经济收入非常重要。
促卵泡素(follicle stimulating hormone,FSH)和促黄体素(luteinizing hormone,LH)在卵巢的生长发育和成熟排卵过程中发挥着重要的作用。发情前,FSH分泌逐渐增多,在促进卵巢增重和卵泡生长发育中起主导作用[2];发情期,LH水平不断升高,临近排卵时达到最高水平,并促进卵泡成熟和排卵,继而形成黄体;排卵后,FSH和LH又降至较低水平[3]。因此,提高FSH和LH浓度对促进卵泡的发育和提高动物的繁殖力发挥着重要作用。然而,在生理状态下,抑制素(inhibine,INH)通常抑制垂体FSH和LH的合成和分泌,并对抗FSH和LH的生理作用,对动物的繁殖活动起到明显的抑制作用[4]。激素通过和靶细胞中相应的受体结合而发挥其生理作用,FSH和LH对卵巢的调节作用就是通过与卵巢皮质和卵泡中存在FSHR和LHR结合而实现的[5],而INH与INHβB的结合来抑制垂体细胞分泌FSH,进而抑制卵泡的发育和成熟[6]。
牦牛卵巢在生长发育过程中血清INH、FSH和LH浓度的变化模式及其相互作用未见相关报道,研究INH的分泌和作用特点,掌握这3种激素在卵巢发育过程中的调节作用对提高牦牛的繁殖率具有一定的价值。本试验通过检测INHβB、FSHR和LHR在牦牛发情期、间情期、妊娠期卵巢中的表达和定位,研究抑制素(INH)、FSH和LH在牦牛不同生理时期对卵巢的生理作用,在提高牦牛繁殖率及促进牦牛养殖业发展方面具有重要意义。
1 材料与方法
1.1 材料
1.1.1 主要试剂 INH Beta B抗体(bs-1825R)、FSHR抗体(bs-20658R)、LHR抗体(bs-6431R)、Goat Anti-Rabbit IgG和免疫组化染色试剂盒,北京博奥森生物技术有限公司产品;β-actin Rabbit Ab,Cell Signaling公司产品;RNA提取试剂盒,北京Omega公司产品;GoscriptTMReverse Transcription System反转录试剂盒,美国Promega公司产品;DAB显色液,美国Invitro-gen Zymed公司产品。
1.1.2 主要仪器设备 PCR仪,Biorad公司产品;实时荧光定量PCR仪,Roche生物科技公司产品;显微照相系统(DP71),日本Olympus公司产品;化学发光仪,上海Roche生物公司产品。
1.1.3 样品处理 样品取自青海省西宁市某屠宰场,4岁~8岁雌性牦牛,体况良好,无明显临床疾病。动物禁食8 h~10 h 后,颈动脉放血屠宰,30 min内分别采集处于发情期(有明显的发情症状)、间情期(排卵后有周期黄体生成)和妊娠期(妊娠2月~3月)的卵巢组织,样品分别保存于液氮中用于提取RNA与蛋白质,以及固定于40 mg/mL的多聚甲醛溶液中用于免疫组化检测。
1.2 方法
1.2.1 引物设计 利用Primer Premier 6.0设计四对引物(表1),由生工生物工程(上海)有限公司合成。

表1 引物序列
1.2.2 RNA提取及基因表达水平检测 用TransZol试剂盒提取不同生殖阶段卵巢组织的RNA,反转录为cDNA后置于-20 ℃保存。PCR反应体系如下:cDNA 2 μL,上、下游引物各0.5 μL,TaqDNA聚合酶 10 μL,H2O 7 μL。反应条件:95 ℃ 4 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 15 s,72 ℃ 5 min,共40个循环。RT-qPCR反应体系:SYBR Premix ExTaqⅡ10 μL、cDNA 2 μL、上、下游引物各0.5 μL、H2O 7 μL。反应条件:95 ℃ 4 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 15 s,72 ℃ 5 min,共40个循环。每个样品重复检测3次,利用2-ΔΔct法分析基因的相对表达量。
1.2.3 蛋白质提取和Western blot检测蛋白表达量 取出卵巢组织,研磨后加入RIPA裂解缓冲液和PMSF冰浴3 h,组织完全裂解后,在4 ℃、12 000 r/min条件下离心,弃去沉淀。蛋白变性:蛋白原液与4×蛋白上样缓冲液按 3∶1 混合,100 ℃变性15 min,变性后的蛋白-20 ℃保存。配制50 g/L浓缩胶和100 g/L分离胶,进行SDS-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE);电泳结束后切胶、转膜,再封闭,孵育一抗(稀释比例1∶1 000)、二抗(稀释比例1∶3 000),后用化学发光仪曝光,利用Image J软件分析INHβB、FSHR和LHR蛋白在卵巢组织中的相对表达量。
1.2.4 免疫组织化学技术 用40 mg/mL多聚甲醛固定的卵巢组织样品制作石蜡切片。切片进行脱蜡,在pH 6.0的柠檬酸缓冲液(0.01 mol/L)中进行抗原修复,液体加热沸腾后持续15 min,再冷却至常温;免疫组化试剂盒(抗兔)孵育二抗;以二氨基联苯胺染色法用DAB显色液进行显色,然后苏木精复染、酒精脱水、二甲苯透明、树脂封片,晾干。用IHC方法检测相关受体的分布。
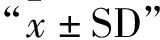
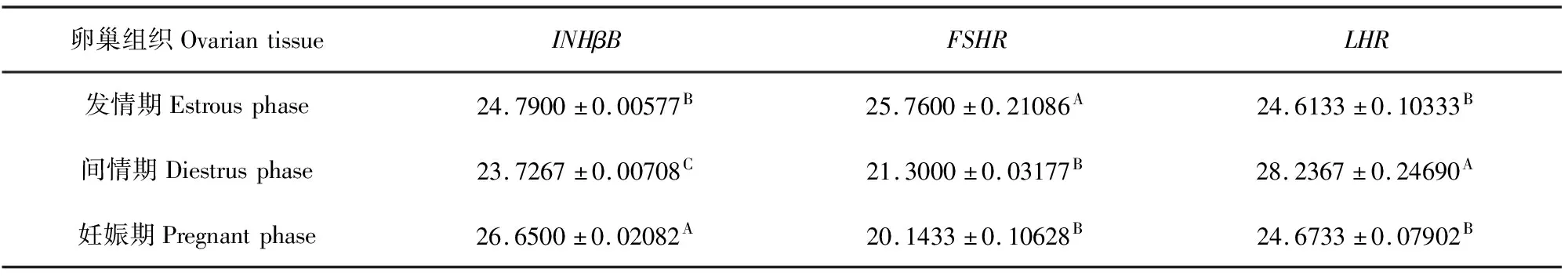
表2 牦牛不同生殖生理阶段卵巢组织中INHβB、FSHR和LHR基因表达量
表3 牦牛不同生殖生理阶段卵巢组织中INHβB、FSHR和LHR蛋白灰度分析数值
2 结果
2.1 牦牛卵巢组织INHβB、FSHR和LHR mRNA表达
PCR结果如图所示(图1a~图1c),条带单一,结果与预期大小相符。INHβB在妊娠期牦牛卵巢组织中表达量显著高于发情期和间情期(P<0.05),且发情期高于间情期(P<0.05)(图1d);FSHR基因的表达量在发情期显著地高于间情期和妊娠期(P<0.05),后两个时期差异不显著(图1e)(P>0.05);而LHR在间情期表达量最高(P<0.05),发情期和妊娠期差异不显著(图1f)(P>0.05)。
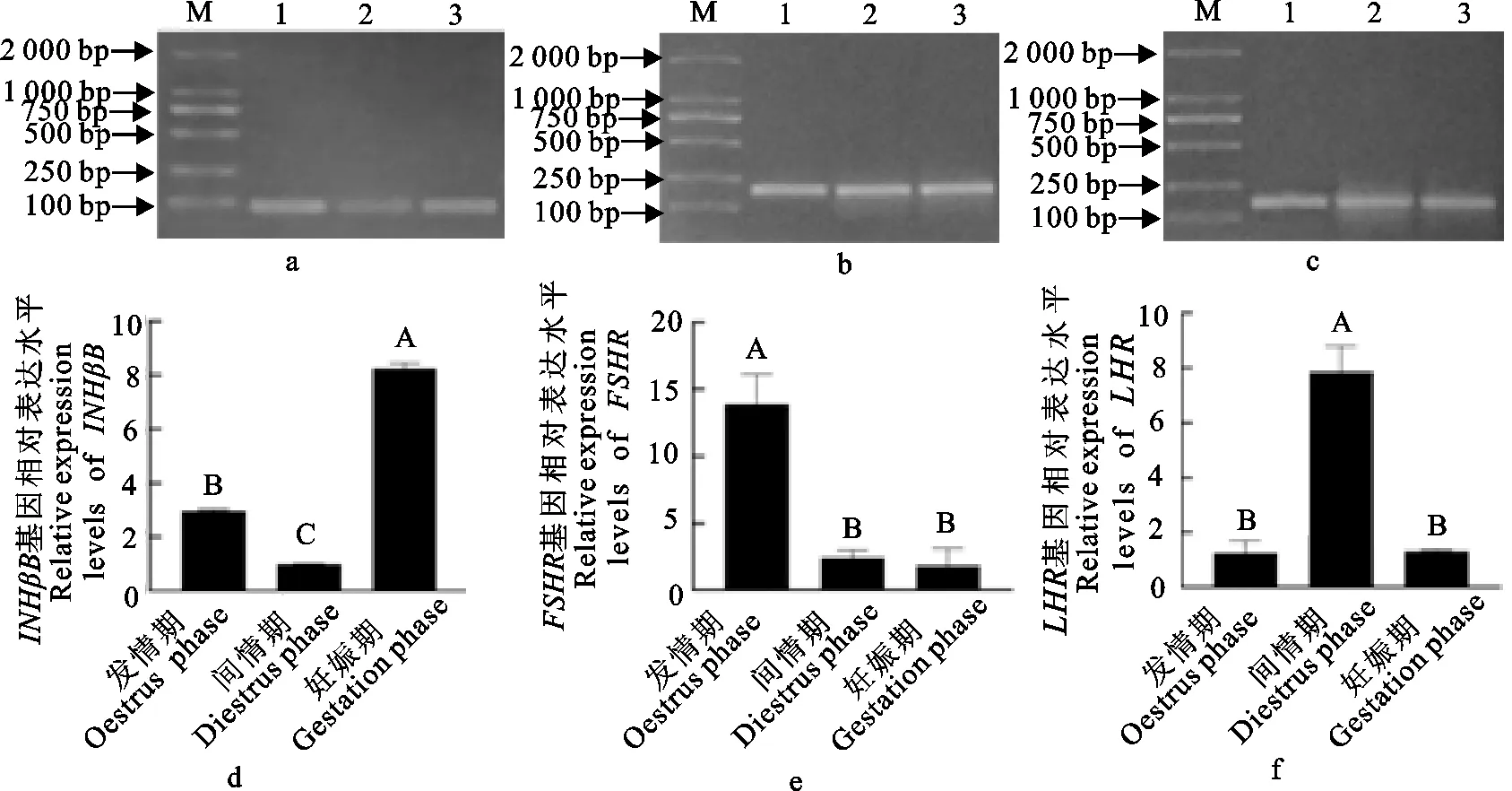
a、b、c.PCR结果;M.DNA 标准DL 2 000;1.发情期卵巢组织;2.间情期卵巢组织;3.妊娠期卵巢组织;d.INHβB基因;e.FSHR基因;f.LHR基因;相同大写字母之间表示差异不显著(P>0.05);不相同大写字母之间表示差异显著(P<0.05)
2.2 牦牛卵巢组织INHβB、FSHR和LHR蛋白表达
INHβB、FSHR和LHR蛋白在牦牛卵巢的表达存在明显差异(图2a)。INHβB蛋白在牦牛妊娠期卵巢组织中表达量极显著高于发情期和间情期(P<0.05),发情期和间情期表达量差异不显著(图2b)(P>0.05);FSHR在发情期表达量最高,间情期次之,妊娠期最低(P<0.05)(图2c);LHR在间情期的表达量最高,妊娠期次之(P<0.05),发情期最低(P<0.05)(图2d)。
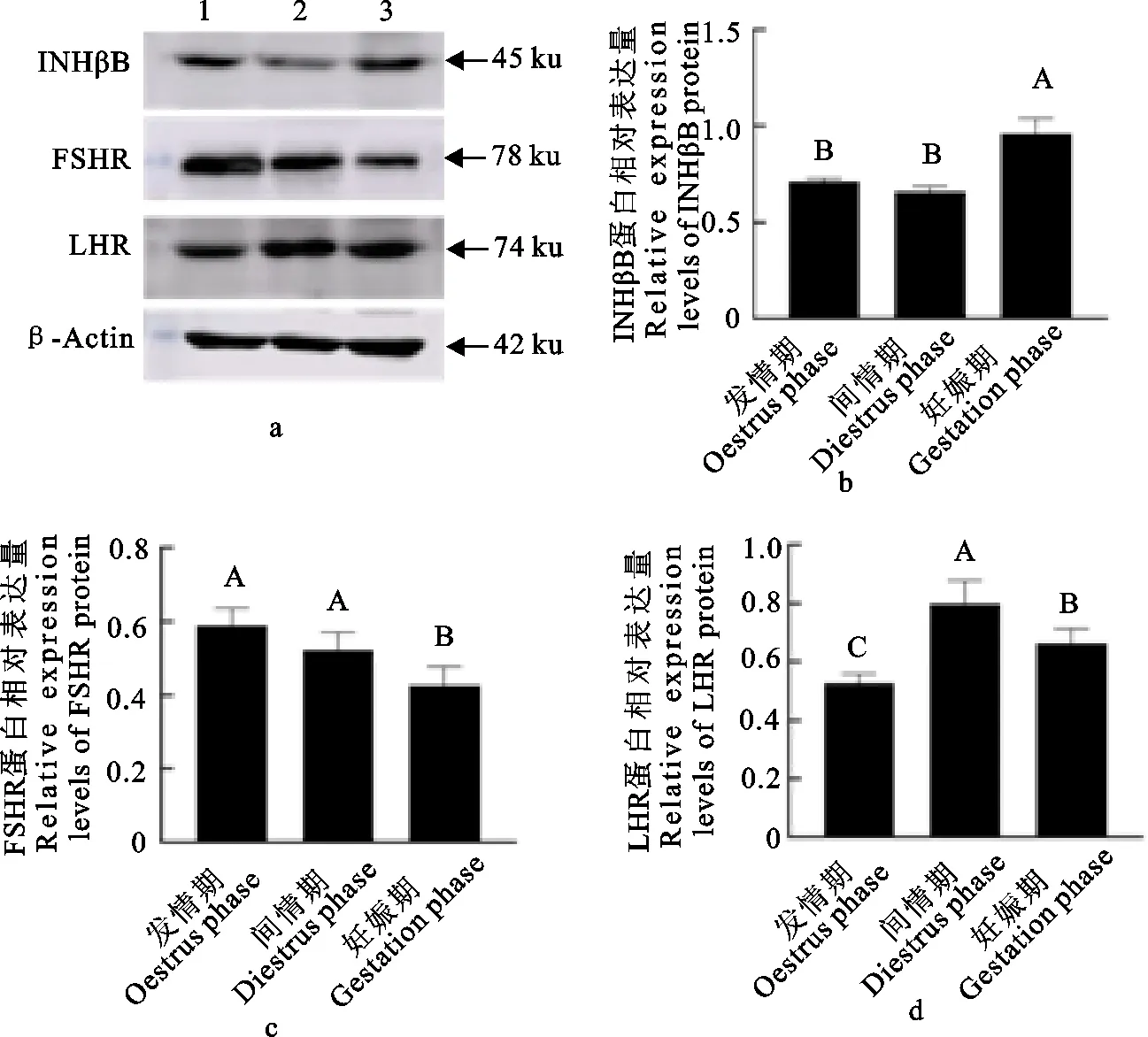
a.Western blot 结果;1.发情期卵巢组织;2.间情期卵巢组织;3.妊娠期卵巢组织;b.INHβB蛋白相对表达分析;c.FSHR蛋白相对表达分析;d.LHR蛋白相对表达分析;相同大写字母之间表示差异不显著(P>0.05);不相同大写字母之间表示差异显著(P<0.05)
2.3 INHβB、FSHR和LHR在牦牛卵巢组织中的分布
免疫组织化学检测结果显示,INHβB、FSHR和LHR在牦牛不同生殖阶段卵巢均为阳性表达(图3A、B、C、D、E、F、G、H、I)。其中,INHβB、FSHR和LHR在发情期主要分布在卵泡膜、颗粒细胞和卵丘细胞上(图3A、D、G),而在间情期和妊娠期主要分布于黄体细胞(图3B、C、E、F、H、I)。
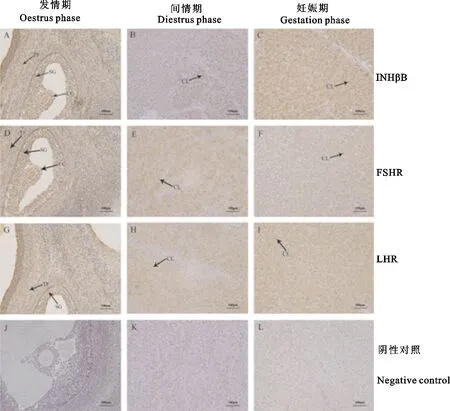
CC.卵丘细胞;SG.颗粒细胞;TF.卵泡膜;CL.黄体细胞
3 讨论
INH是一种主要由性腺分泌的糖蛋白激素[7],具有强烈抑制FSH合成和分泌的作用,而对LH的合成和分泌有轻微的抑制作用[8]。INH在妊娠前期主要由黄体细胞产生,在妊娠后期INH主要由胎盘产生,产生的INH主要贮存在细胞浆中,可通过与细胞表面的INHβB结合发挥作用,以旁分泌和自分泌方式参与妊娠期间的内分泌调节[9-10]。同时,INH与颗粒细胞上的INHβB结合后作用于垂体促性腺激素分泌细胞,抑制FSH的合成与释放,破坏FSHRmRNA的稳定性[11-13],使FSH对妊娠期卵巢的作用减弱。本研究发现INHβB在妊娠期牦牛卵巢组织中的表达量显著高于间情期和发情期,而发情期又略高于间情期的表达量,说明妊娠期牦牛卵巢INHβB与配体结合度高,信号转导作用强,推测机体需要INH维持妊娠过程。
FSH主要由垂体细胞分泌,能刺激卵巢生长[14]。下丘脑产生促性腺激素释放激素作用于垂体,促使垂体释放促性腺激素,从而使FSH的含量升高,同时FSHR在卵巢组织中的表达水平升高[15-17]。FSHR在颗粒细胞中呈现高水平表达,它与FSH结合调节卵泡的成熟,颗粒细胞增殖和雌激素的产生[18]。本试验结果显示,FSHR在发情期牦牛卵巢组织中表达量显著高于间情期和妊娠期,而间情期又略高于妊娠期,说明发情期牦牛卵巢对FSH具有功能需求,证实FSH能促进牦牛发情,并对卵巢的增重和卵泡的生长发育发挥主要作用。
LH在生理状态下与FSH协同对卵巢发挥作用,二者的作用机制相似。LH对黄体期卵巢作用显著,促进黄体的形成,LH通过作用于周围的颗粒细胞,使卵母细胞恢复减数分裂,并导致排卵[19-21]。本试验结果显示LHR在牦牛间情期卵巢组织中的表达量高于发情期和妊娠期,而妊娠期又略高于发情期的表达量,说明牦牛间情期卵巢对LH的功能需求,LH对牦牛卵泡排卵起到重要作用。
在卵巢的皮质和卵泡中有INHβB、FSHR和LHR,这3个受体是由转化生长因子和相应的受体结合蛋白构成的共受体,INH、FSH和LH通过与共受体结合对卵巢发挥调控作用[22],受体能特异性结合相应的激素刺激靶细胞发挥效应,配体主要有传导信号的作用,能诱导激素和受体结合[23-24]。从而发挥对牦牛生殖功能的调控。
本试验结果表明,INHβB、FSHR和LHR在牦牛发情期、间情期、妊娠期卵巢组织中均有表达,但其表达量存在明显的差异,说明这3种激素在卵巢的发育、卵泡成熟和排卵以及妊娠过程中发挥不同的作用。研究3个受体在牦牛卵巢的表达情况为探索INH、FSH和LH调控牦牛卵巢活动的分子机制提供了科学突破点,为了对本研究结果做进一步验证,可推进牦牛卵泡颗粒细胞体外培养的验证试验。参考文献:
[1] 王 可,祝超智,赵改名,等.中国牦牛的品种与分布[J].中国畜牧杂志,2019,55(10):168-171.
[2] RONG M,LIU J X,LI Y,et al.Novel functional recombinant human follicle-stimulating hormone acquired from goat milk[J].J Agric Food Chem,2021,69:2793-2804.
[3] CLARKE I J,FINDLAY J K,CUMMINS J T,et al.Effects of ovine follicular fluid on plasma LH and FSH secretion in ovariectomized ewes to indicate the site of action of inhibin[J].Reprod Fert,1986,77:75-85.
[4] XIA Y,WANG Q,HE X D,et al.Cloning and expression analysis of the follicle-stimulating hormone receptor(FSHR)gene in the reproductive axis of female yaks(Bosgrunniens)[J].Domest Anim Endocrinol,2020,70:106383.
[5] UTOMO B,PUTRANTO E D,FADHOLLY A,et al.Profile of follicle-stimulating hormone and polymorphism of follicle-stimulating hormone receptor in Madrasin cattle with ovarian hypofunction[J].Vet World,2020,13:879-883.
[6] GAO Y T,DU Q,LIU L Y,et al.Serum inhibin B for differentiating between congenital hypogonadotropic hypogonadism and constitutional delay of growth and puberty:a systematic review and meta-analysis[J].Endocrine,2021,10:22-28.
[7] 张 超,罗艳梅,张家骅,等.激活素、抑制素及其受体与动物生殖作用的研究进展[J].中国畜牧兽医,2011,38(2):115-119.
[8] KUMAR T R,WANG Y,LU N,et al.Follicle stimulating hormone is required for ovarian follicle maturation but not male fertility[J].Nat Genet,1997,15(2):1-4.
[9] 阳美霞,张虹亮,张羽芳,等.抑制素免疫对动物卵泡发育的影响[J].中兽医医药杂志,2018,37(1):32-34.
[10] GONEY M P,WILCE M C J,WILCE J A,et al.Engineering the ovarian hormones inhibin A and inhibin B to enhance synthesis and activity[J].Endocrinology,2020,161:38-46.
[11] SPOSINI S,PASCALI F D,RICHARDSON R,et al.Pharmacological programming of endosomal signaling activated by small molecule ligands of the follicle stimulating hormone receptor[J].Front Pharmacol,2020,11:62-70.
[12] BRADEN T D,FAMWORTH P G,BURGER H G,et al.Regulation of the synthetic rate of gonadotropin-releasing hormone receptors in rat pituitary cell cultures by inhibin[J].Endocrinology,1990,127(5):87-92.
[13] CANDELARIA J I,RABAGLINO M B,DENICOL A C,et al.Ovarian preantral follicles are responsive to FSH as early as the primary stage of development[J].Endocrinology,2020,247(2):153-168.
[14] 胡 斐,吕慎金,金 一,等.绵羊FSHR基因生物信息学分析及其器官表达规律研究[J].黑龙江畜牧兽医,2019(3):24-27.
[15] CHEN S J,LIU W J,YANG C,et al.Gonadotropin inhibitory hormone downregulates steroid hormone secretion and genes expressions in duck granulosa cells[J].Anim Reprod,2021,18:128-136.
[16] EGBERT J R,ROBINSON J W,ULIASZ T F,et al.Cyclic AMP links luteinizing hormone signaling to dephosphorylation and inactivation of the NPR2 guanylyl cyclase in ovarian follicles[J].Biol Reprod,2021,27:78-84.
[17] YANG J,GONG Z D,SHEN X Y,et al.FSH receptor binding inhibitor depresses carcinogenesis of ovarian cancer via decreasing levels of K-Ras,c-Myc and FSHR[J].Anim Biotechnol,2021,32:84-91.
[18] WANG N,SI C C,XIA N,et al.TRIB3 regulates FSHR expression in human granulosa cells under high levels of free fatty acids[J].Reprod Biol Endocrinol,2021,19:129-139.
[19] JONAS K C,RIVERO M A,ODUWOLE O,et al.The luteinizing hormone receptor knockout mouse as a tool to probe theinvivoactions of gonadotropic hormones/Receptors in females[J].Endocrinology,2021,162:70-77.
[20] WOODRUFF T K,LYON R J,HANSEN S E,et al.Inhibin and activin locally regulate rat ovarian folliculogenesis[J].Endocrinology,1990,127:196-205.
[21] 许丹宁,田允波,黄运茂,等.卵泡大小和颗粒细胞对山羊卵泡卵母细胞体外成熟和体外受精的影响[J].中国兽医学报,2011,31(7):1066-1069.
[22] STEWART J L,STELLA S,CUNHA L,et al.Administration of nerve growth factor-β to heifers with a pre-ovulatory follicle enhanced luteal formation and function and promoted LH release[J].Theriogenology,2020,148:37-47.
[23] 杨灿锋,杨利国.抑制素受体的研究进展[J].中国优生与遗传杂志,2011,19(6):3-4.
[24] CHEN H,CUI Y,YU S,et al.Expression and localisation of FSHR,GHR and LHR in different tissues and reproductive organs of female yaks[J].Folia Morphol(Warsz),2018,77:301-309.
