不同交联剂处理对脱细胞小肠黏膜下层多孔支架的影响
2022-06-10李博文刘玉华
邓 艺,张 一,李博文,王 梅,唐 琳,刘玉华△
(北京大学口腔医学院·口腔医院1.修复科,2.综合二科,国家口腔医学中心,国家口腔疾病临床医学研究中心,口腔生物材料和数字诊疗装备国家工程研究中心,口腔数字医学北京市重点实验室,国家卫生健康委员会口腔医学计算机应用工程技术研究中心,国家药品监督管理局口腔生物材料重点实验室,北京 100081)
随着组织工程在医学领域的应用,生物支架材料也在飞速发展,其作为种子细胞和生物活性分子的载体,为细胞生长提供必要的生长微环境[1],其中,天然来源的生物材料因其良好的生物相容性、可降解性、材料的可加工性,以及结构修饰后性能的可改变性等优点受到广泛关注[2-3]。细胞外基质来源的天然生物材料成为近年来研究的热点,研究表明细胞外基质富含胶原蛋白,具有糖蛋白和糖胺聚糖等活性成分,可以释放多种生长因子[4],具有潜在成骨、组织重塑等性能[5-7],其中脱细胞小肠黏膜下层(decellularized small intestinal submucosa,SIS)是来源广、价格低廉、易于获得、广泛应用的细胞外基质材料[8],一些学者已经将SIS海绵状多孔支架用于修复组织缺损[9]。尽管天然胶原蛋白类支架材料具有成分优势,但这类材料的应用潜力受到其机械强度低和易降解性的限制。研究表明交联剂的使用对其性能有重要影响[10],戊二醛(glutaraldehyde,GA)是近二十年来应用最广泛的合成化学交联剂,其优点在于价格低廉且交联效率高[11]。碳二亚胺[1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC]是一种生物相容性良好的合成化学交联剂,N-羟基丁二酰亚胺(N-hydroxy succinimide,NHS)常与EDC联合应用于胶原的体外交联,提高了EDC交联效率[12],其优点在于交联剂自身不与胶原结合,具有类似催化剂的特性,易于从交联后材料中洗脱,对天然材料的性质影响较小。原花青素(procyanidine,PA)是一种天然化学交联剂,是来源于水果、蔬菜、树皮等的天然多酚,是天然存在的植物代谢产物,其优点在于交联反应稳定、不破坏胶原结构,近年来应用范围逐渐扩大[13]。交联剂的应用会在材料内部形成交联键,不同程度地改变材料的结构和性质[14],所以客观评价不同交联修饰方法对材料性能的影响十分必要。本研究使用上述3种交联剂修饰SIS多孔支架,通过评价支架的理化性能、细胞毒性以及对人骨髓间充质干细胞(human bone marrow mesenchymal stem cells,hBMSCs)体外增殖的影响,为其未来的应用提供理论基础。
1 材料与方法
1.1 材料及主要试剂
经脱细胞处理的猪源小肠黏膜下层购自北京大清生物技术股份有限公司,胃蛋白酶购自美国NOVON Scientific公司,乙醇溶剂购自北京化工厂有限责任公司,EDC、25%(质量分数)戊二醛水溶液、乙酸、苯骈戊三酮(茚三酮)购自国药集团化学试剂有限公司,NHS购自上海阿拉丁试剂有限公司,原花青素、10×磷酸盐缓冲液(phosphate buffered saline,PBS)、1 mol/L Tris-HCl缓冲液、二氯化锡二水购自北京索莱宝科技有限公司,Ⅰ型胶原酶购自美国Sigma公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自日本东仁化学研究所,Calcein-AM/PI活死细胞检测试剂盒购自江苏凯基生物技术股份有限公司,DMEM 培养基、胎牛血清(fetal bovineserum,FBS)、100×细胞培养用抗生素购自美国Gibco公司。
实验所用设备:冷冻研磨仪(SPEX6770)购自美国SPEX公司,冷冻干燥机(Labconco FreeZone©2.5L)购自美国Labconco公司,万能材料试验机(EZ-L)购自日本Shimadzu公司,精密电子天平(AL104-IC)购自瑞士Mettler-Toledo公司,场发射环境扫描电镜(field emission scanning electron microscope,FESEM,QuattroESEM)购自美国ThermoFisherScientific公司,万能材料试验机(EZ-L)购自日本Shimadzu公司,超微量分光光度计(NanoDrop 2000)购自美国ThermoFisherScientific公司,酶标仪(ELx800)购自美国BioTek公司,激光共聚焦显微镜(confocal laser scanning microscopy,CLSM,LMS710)购自美国Leica公司。
1.2 交联SIS多孔支架的制备
SIS使用蒸馏水清洗,使用冷冻研磨仪研磨成粉后置入冷冻干燥机(-80 ℃、0.014 mBar)冻干6 h,得到干燥SIS粉末。配置1%(质量分数)SIS溶液[1%(质量分数)SIS粉、3%(质量分数)乙酸、0.1%(质量分数)胃蛋白酶],使用磁力搅拌器室温搅拌6 h,将均质的溶液加入模具中,送至-20 ℃冰箱内预冷24 h后放入-80 ℃冰箱预冷12 h,使用冷冻干燥机冻干12 h。将冻干后SIS多孔支架随机分成3组,分别置于5 g/L GA乙醇溶液、50 mmol/L EDC乙醇溶液和5 g/L PA乙醇溶液中室温避光交联24 h,去离子水洗涤3次,干燥备用。
1.3 理化性能
1.3.1微观形貌观察 使用场发射环境扫描电镜观察3组多孔支架表面和横截面,拍摄图像。
1.3.2孔径及孔隙率 使用计算机软件ImageJ对FESEM图像进行分析,每个图像随机选取10个孔,计算孔径;整体图像分析计算孔隙率。


1.4 抗酶解性能
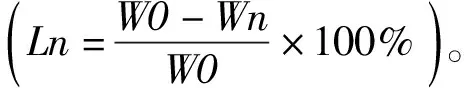
1.5 力学性能
使用万能材料试验机进行压缩试验,准备高度为5 mm、直径6 mm的圆柱形样品,以1 mm/min的速度进行压缩试验,直至样品高度最大降低80%,样品的抗压强度(kPa)计算为高度降低50%时的载荷(N)/样品横截面积(mm2),每组至少重复测量5个试样。
1.6 细胞相容性
1.6.1材料准备 将交联后SIS多孔支架置于48孔板板底,无水乙醇消毒3 h,PBS漂洗3次,紫外线消毒4 h,加入细胞培养基,置于培养箱中过夜。
1.6.2细胞毒性实验 选择状态良好(P4~P6)的hBMSCs制备细胞悬液备用,调整细胞悬液密度,以2×104个每孔的密度接种于各组材料上,培养24 h后依照Calcein-AM/PI活死细胞检测试剂盒说明书进行染色,使用共聚焦显微镜观察细胞数量和状态,其中绿染为活细胞,红染为死细胞。
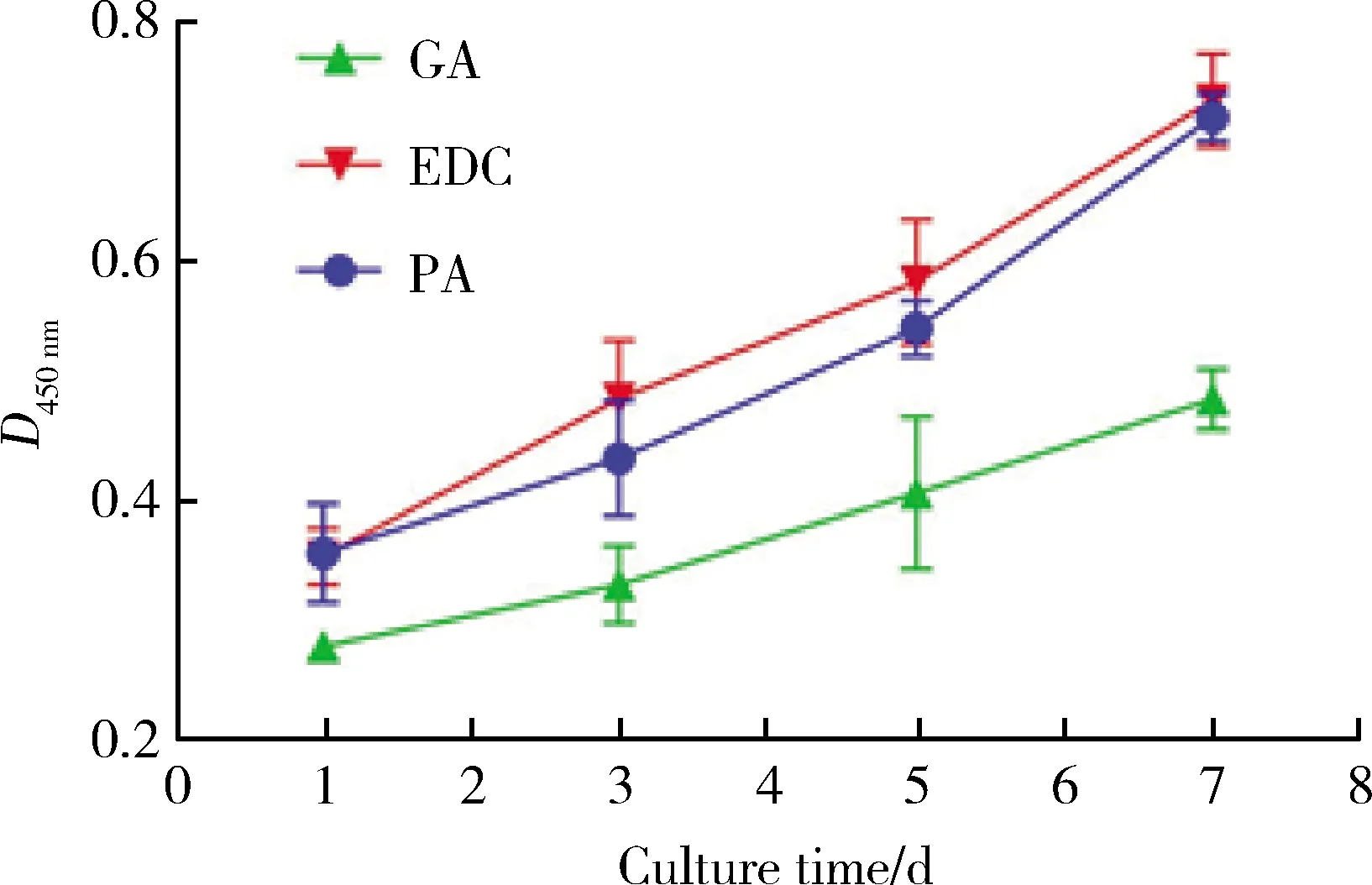
1.6.3细胞增殖实验 选择状态良好(P4~P6)的hBMSCs制备细胞悬液备用,调整细胞悬液密度,以1.5×104个每孔的密度接种于各组材料上,在培养第1、3、5、7天,依照CCK-8试剂盒说明书进行细胞增殖情况的测定[450 nm处光密度值(D)],绘制各试验组的细胞增殖曲线,每组设3个复孔。
1.7 统计学分析
采用SPSS 25.0统计软件,计量资料以均数±标准差表示,孔径、孔隙率、交联度、溶胀率、质量丧失率、压缩模量、CCK-8测定结果组间比较均采用单因素方差分析(ANOVA),两两比较采用LSD法,P<0.05认为差异有统计学意义。
2 结果
2.1 理化性能
2.1.1多孔支架结构 SIS多孔支架经交联后宏观形貌见图1。GA组呈浅黄色,EDC呈白色,PA呈浅褐色,表面光滑,可见均匀的微小孔隙结构,PA组体积稍有缩小;表面微观及横截面微观形貌(图2)可见各组表面及材料内部均存在纤维之间搭建的大小均匀、相互连通的蓬松网状三维孔隙结构。
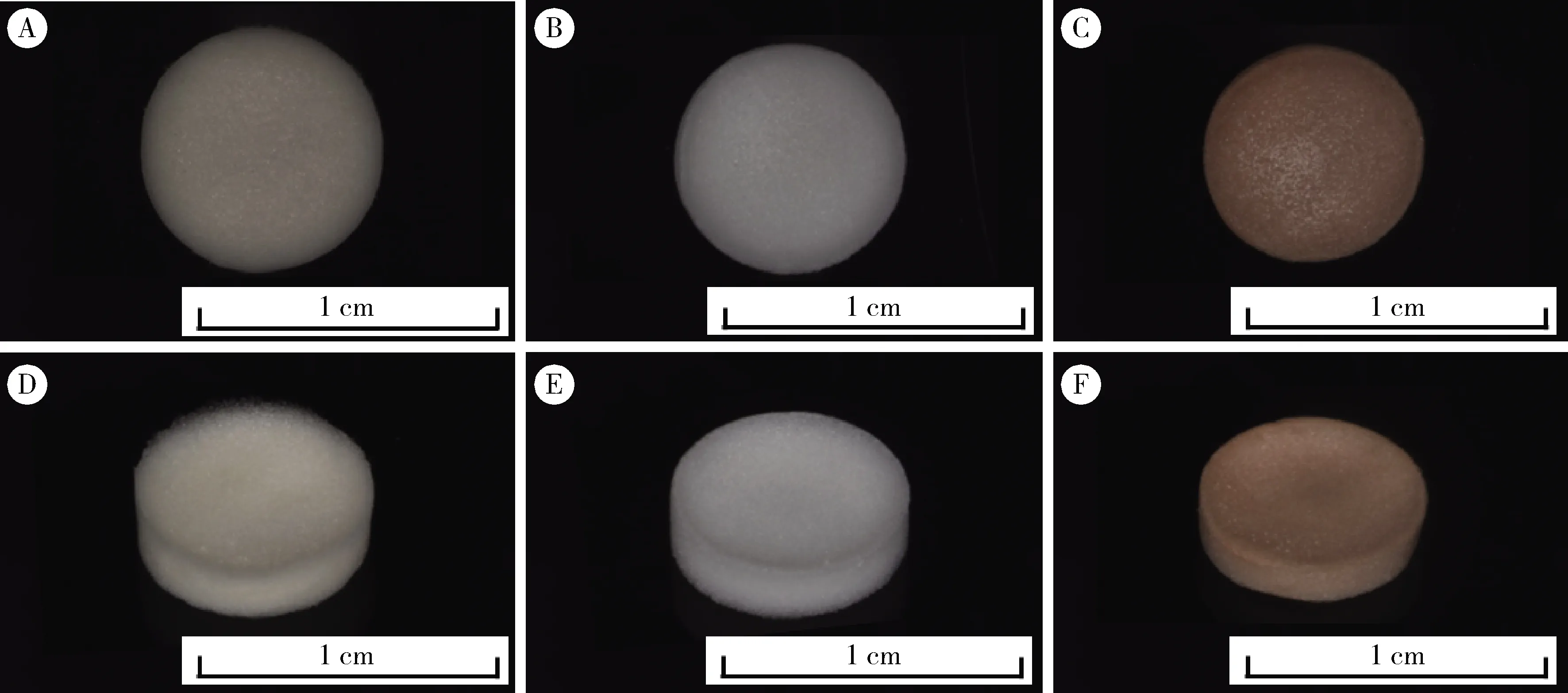
图1 交联后SIS多孔支架的宏观形貌

A, B and C, the top view of different SIS porous scaffolds crosslinked by GA, EDC and PA respectively; D, E and F, the side view of different SIS porous scaffolds crosslinked by GA, EDC and PA respectively.A to C, FESEM images of surface morphology of the scaffolds crosslinked by GA, EDC and PA respectively; D to F, FESEM images of cross-section morphology of the scaffolds crosslinked by GA, EDC and PA respectively(Magnification=500, scale bar=300 μm).GA, glutaraldehyde; PA, procyanidine; EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide.
2.1.2孔径及孔隙率 使用ImageJ软件计算交联后SIS多孔支架孔径(图3A)和孔隙率(图3B)。GA组孔径(149.50±14.65)μm、EDC组(161.90±13.44)μm、PA组(140.10±12.06)μm,EDC组孔径最大,与另两组差异具有统计学意义(P<0.05);GA组孔隙率84.83%±1.89%、EDC组85.11%±1.71%、PA组79.62%±1.14%,PA组孔隙率最小,与另两组孔隙率差异有统计学意义(P<0.05)。
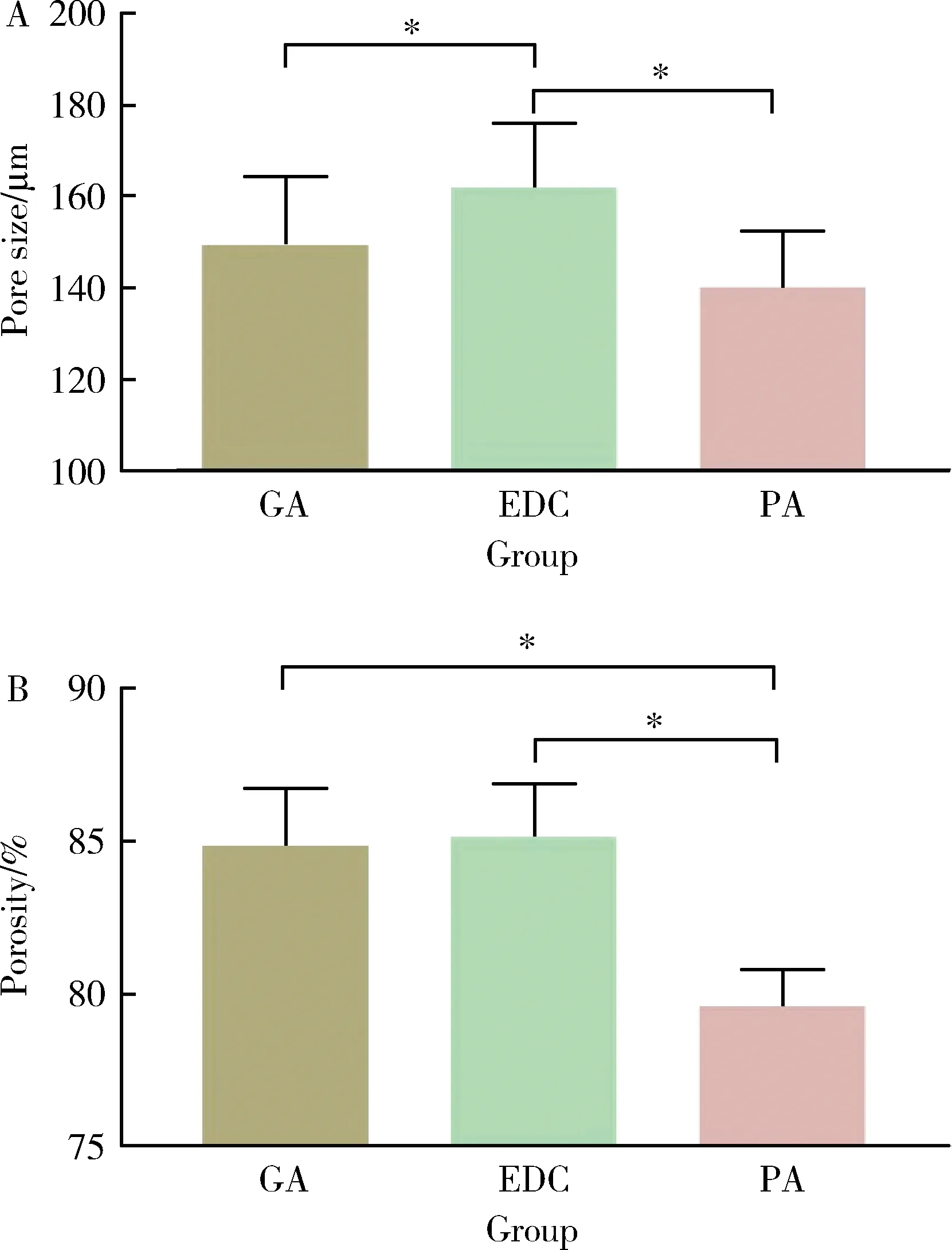
A, pore size; B, porosity; GA, glutaraldehyde; PA, procyanidine; EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide.* P<0.05.
2.1.3交联度 交联后GA组SIS支架交联度63.12%±2.63%,EDC组69.13%±4.78%,PA组71.29%±5.77%,PA组> EDC组> GA组,PA组与GA组之间差异有统计学意义(P<0.05,图4)。

GA, glutaraldehyde; PA, procyanidine; EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide.* P<0.05.
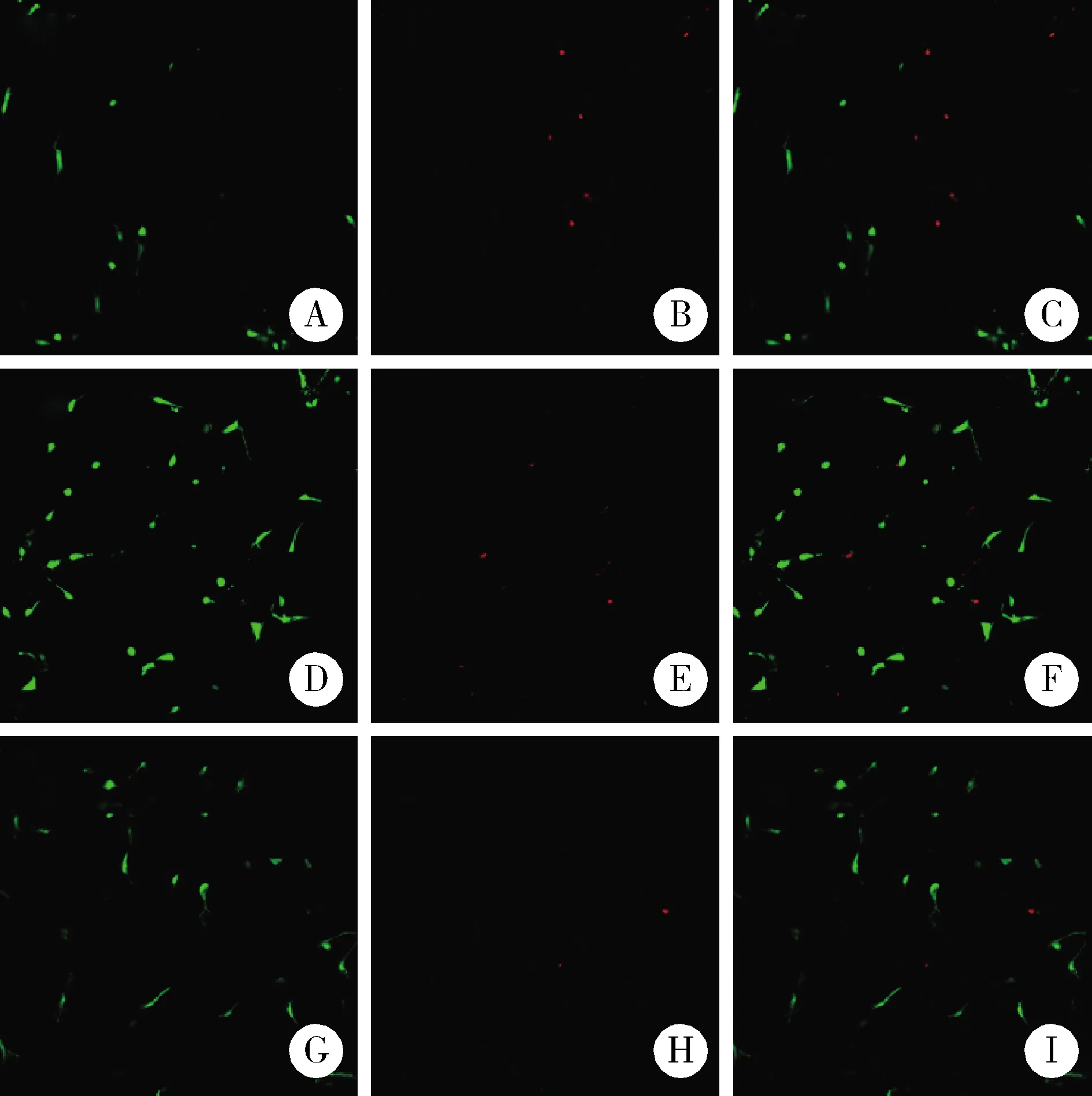
2.1.4溶胀率 交联后,GA组SIS支架的溶胀率6 165.17%±98.92%,EDC组6 609.73%±169.77%,PA组5 711.18%±141.16%,PA组 GA, glutaraldehyde; PA, procyanidine; EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide.* P<0.05. 交联后SIS支架的质量丧失率(图6)GA组L7=20.47%±4.80%、L10=37.98%±10.29%、L15=79.31%±1.98%,EDC组L7=22.51%±1.16%、L10=36.67%±2.29%、L15=46.18%±2.47%,PA组L7=14.15%±1.48%、L10=25.90%±3.51%、L15=30.05%±0.33%。第7天时,PA组与另两组差异有统计学意义(P<0.05);第10天时,GA组与PA组差异有统计学意义(P<0.05);第15天时,3组间的质量丧失率差异均有统计学意义(P<0.05)。由图7可见,降解至第7天时,3组无明显变化;第10天时,GA组已失去三维结构,变成絮状分散在降解液中;第15天时,GA组絮状结构明显减少,大部分已降解,EDC组结构松散,而PA组外观依然保持完整,综上,PA组的抗酶解能力最佳。 GA, glutaraldehyde; PA, procyanidine; EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide.* P<0.05. A, B and C, the SIS scaffold of GA group degraded in digestion solution on day 7, day 10 and day 15 respectively; D, E and F, the SIS scaffold of EDC group degraded in digestion solution on day 7, day 10 and day 15 respectively; G, H and I, the SIS scaffold of PA group degraded in digestion solution on day 7, day 10 and day 15 respectively. GA组的压缩强度为(15.22±1.21)kPa,EDC组压缩强度为(15.17±1.04)kPa,PA组压缩强度为(26.09±3.19)kPa,PA组与另两组差异具有统计学意义(P<0.05);经3种交联处理后,相同的形变条件下,PA组能承受的应力最大,EDC组和PA组能承受的应力相似(图8)。 A, compressive strength; B, stress-strain curves.GA, glutaraldehyde; PA, procyanidine; EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide.* P<0.05. 2.4.1活死细胞染色 在各组多孔支架中,细胞呈球形生长,分布较为均匀。GA组活细胞数量较少且有较多的死细胞,细胞毒性强;EDC组具有最多的活细胞数量,较少的死细胞数量,细胞毒性低;PA组活细胞数量较多,死细胞数量最少,细胞毒性较低(图9)。 A-C, images of live/dead assay staining of hBMCSs in GA group after 24 h culture time(A, living cells, green; B, dead cells, red; C, merge of A and B); D-F, images of live/dead assay staining of hBMCSs in EDC group after 24 h culture time(D, living cells, green; E, dead cells, red; F, merge of D and E); G-I, images of live/dead assay staining of hBMCSs in PA group after 24 h culture time(G, living cells, green; H, dead cells, red; I, merge of G and H). 2.4.2CCK-8细胞增殖曲线 培养时间从1~7 d,可以见到3组的光密度值有明显的增加,3组均处于增殖状态。EDC组表现出最高的增殖速度,PA组与EDC组相近,GA组增殖速度较慢(图10)。 GA, glutaraldehyde; PA, procyanidine; EDC, 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide. 天然胶原蛋白类材料在体外应用时,原有的自组装结构和天然的交联受到破坏,通过引入外源性交联的方法在胶原分子之间引入交联键,可以防止胶原分子在受到压力后滑动,提高了胶原网状结构的机械强度[16]。但是交联剂的应用会给天然材料引入一定的毒性,因此评价交联后生物支架材料的理化性能和生物相容性十分必要。 本研究应用冷冻干燥法制备SIS多孔支架,材料中的水再冻干过程中升华成气相,在材料内部生成连通多空结构,相比于其他方法,冻干过程可以维持胶原蛋白的二和三级结构完整,更好地保护了SIS材料中的生物活性因子。经3种交联剂处理后的3组SIS多孔支架基本保持原有形状,PA组和GA组有着色现象,EDC组无着色,与Delgado等[17]的研究相似。多孔支架的微孔隙结构在交联过程中可能发生改变,Ma等[18]研究发现高浓度交联处理会使支架孔隙结构变得细长。本研究发现3种交联方法均保留了多孔支架表面及内部相互连通的类圆形微孔隙结构,验证了交联浓度的可行性。组织工程中,支架材料的孔径大小对于细胞行为有很大的影响,组织工程要求多孔支架的孔径为100~200 μm,孔隙率大于80%[19],高孔隙率可以促进细胞更好地向内生长,让养分和代谢产物更快地交换,有利于种子细胞的扩散和增殖[20]。本研究支架交联后的孔径为140~160 μm,孔隙率77%~82%,基本满足此要求,其中EDC组的孔径较大,与另两组相比差异有统计学意义,PA组的孔隙率和孔径较小,与另两组相比差异有统计学意义。Vidal等[21]和He等[22]的研究认为PA与EDC、GA相比,可诱导出类似共价键的结合,交联过程置换水产生氢键,产生了更强的胶原纤维之间的相互作用和更紧密的网络结构,这可能使支架的孔径、孔隙率减小。 在孔隙率方面,组织工程需求多孔支架的孔隙率为80%~90%,孔隙率低于80%不利于细胞的扩散和营养代谢,高于90%会降低材料的抗压能力以及加快其降解速度。适宜的孔隙率可以使细胞更好地向内生长,让养分和代谢产物更快地交换,有利于种子细胞的扩散和增殖,有益于组织的形成。有研究表明,如支架的孔径较小,增加其孔隙率可以提升细胞的增殖能力[20]。 溶胀率可以体现支架的吸水能力和保水能力,影响因素主要有支架材料的交联度和孔隙率[23]。本研究GA组、EDC组、PA组交联度依次升高,GA组与PA组间差异具有统计学意义;EDC组溶胀率最高,PA组溶胀率最低,3种材料交联后的溶胀率差异均有统计学意义。结合孔径和孔隙率的数据可见EDC组的孔径和孔隙率最高,这可能是EDC组溶胀率最高的原因。 本研究SIS多孔支架经PA交联处理后,相比EDC和GA有更高的压缩强度和更强的抗酶解能力。在第7、10、15天分别测定3组支架的质量丧失率,结果显示PA组低于其他两组且在第15天时仍保持较完整的结构。经PA交联后的材料可能有更紧密的结构,可以更好地抵抗胶原酶的渗透,这同时体现在压缩强度的提高和机械性能的改善。回顾文献发现,影响材料抗降解能力的原因来自三方面:(1)材料的疏水性:PA与胶原蛋白复合物之间的交联反应主要涉及蛋白质酰胺基和酚羟基之间的氢键,促进氢键结合会形成疏水结构,降低了介电常数,这种微环境增强了此类氢键的稳定性[24],使得经PA交联的材料在水性缓冲液中也可保持长时间稳定;(2)材料的微结构:材料的网络结构通常随着浸泡时间的增加逐渐松散,因为降解酶可逐渐进入材料结构内部,接触到更多的酶切割位点,加速了降解反应,本研究观察到的GA组在第7天大体结构破坏后产生了迅速降解的表现可能就是由于这个原因,而经PA交联后的材料的结构紧密,降解酶不易进入其结构内部,因此经过15 d的浸泡仍可保留宏观形状,较好地抵抗了胶原酶的渗透;(3)材料的溶胀率:多孔支架的溶胀率高会使得降解液更广泛地渗透入海绵支架中,增大了降解液与支架内部结构之间的接触面积,加快了降解速度。 材料的表面亲水性、溶胀、表面粗糙度对细胞附着很重要,交联过程对上述性能均有一定的影响,此外,交联反应会影响材料中与细胞黏附相关的配体密度,影响细胞与配体结合从而影响细胞分化,进而影响细胞行为,因此需要仔细考虑提升支架稳定性的方法。交联剂的选择不仅影响材料的力学性能,还影响支架的化学环境,两者都可以影响细胞命运。本研究将hBMSCs在支架上经过24 h培养后,3组支架在生物相容性方面表现不尽相同。GA组活细胞数量占比75%,死细胞数量占比25%,显示出较强的细胞毒性;EDC组的活细胞数量最多,数量占比95%,死细胞数量少,数量占比5%,细胞毒性最弱;PA组活细胞数量占比92%,死细胞数量占比8%,细胞毒性较低。EDC组细胞毒性最弱,这可能由于EDC诱导的交联为“零长度交联”,经过洗涤可从支架中洗脱干净,不引入额外的毒性基团,且本研究的交联过程在低浓度EDC条件下进行,可以保留类似未交联状态下的天然细胞黏附情况,使细胞具有良好的早期黏附能力。另外,EDC组支架具有高溶胀率和高孔隙率,有利于细胞的增殖,通过细胞增殖曲线可以发现,hBMSCs在EDC组增殖速度也最快。相比EDC组,PA组可见到较多活细胞,细胞毒性较低。PA已在临床上证实为安全的,由于其良好的生物相容性,死细胞数量极少,PA组的细胞增殖速度也与EDC组相似。本研究PA组活死细胞染色可见细胞数量整体较少,可能是由于支架孔径小、孔隙率较低、溶胀率较低,细胞在其上早期黏附较少。GA组与其余两组相比,活细胞数量最少,死细胞较多,显示出较强的细胞毒性。既往研究表明,GA的毒性来自于交联剂残留以及材料的降解[11],交联剂残留基团随着材料的降解被释放出来,对细胞的增殖产生不良影响,多次漂洗可以有效减少材料的毒性,本研究在接种细胞前使用PBS进行了多次漂洗,细胞在GA组仍可增殖,由增殖曲线可见hBMSCs在其上增殖速度较慢。 综上所述,3种交联剂处理均可达到较高的交联度,经EDC或PA交联处理的SIS多孔支架在拥有较好理化性能的同时具有良好的生物相容性,相比于GA是更有应用前景的交联处理方法。
2.2 抗酶解性能


2.3 机械性能

2.4 生物相容性
3 讨论
