脓毒症小鼠髓源性抑制细胞氨基酸代谢特点
2022-06-10邓书伟秦秋实朱鏐娈
马 媛,张 玥,李 蕊,邓书伟,秦秋实,朱鏐娈,△
(1.北京大学地坛医院教学医院传染病研究所,北京 100015;2.首都医科大学附属北京地坛医院传染病研究所,北京 100015;3.新发突发传染病研究北京市重点实验室,北京 100015)
脓毒症是由宿主对感染的反应失调引起的器官功能障碍,病死率高达30%,是重症监护病房患者死亡的主要原因之一[1-2]。2017年全球估计有4 890万例脓毒症患者和1 100万例脓毒症相关死亡患者,约占全球死亡人数的19.7%[3]。近年来,随着抗感染和辅助支持治疗技术的进步,脓毒症早期死亡率已有所下降,但存活下来的部分患者会发展为以长期免疫抑制为特点的慢性危重症[4]。这些患者不仅处于免疫抑制状态,还伴有分解代谢亢进和营养不良,进而导致多器官功能衰竭甚至死亡[5],因此,阐明脓毒症免疫抑制期的代谢特点,对于充分明确脓毒症发病机制至关重要,有助于探索新的脓毒症治疗手段。
髓源性抑制细胞(myeloid-derived suppressor cells, MDSCs)是在病理条件下产生的异质性髓系细胞群,对免疫反应有负调节作用[6-8]。在脓毒症早期,MDSCs通过抑制过度炎症反应发挥保护作用。然而,MDSCs持续增殖并发挥免疫抑制功能,则大大增加了脓毒症继发感染和死亡风险[5, 9]。临床研究表明,严重脓毒症或脓毒症休克患者循环中MDSCs数量持续增加与不良结局密切相关[10-11]。MDSCs引起的免疫抑制是脓毒症预后不良的关键因素。
近年研究发现,细胞代谢水平对MDSCs发挥免疫抑制功能具有重要的调节作用[12]。如在肿瘤微环境中,MDSCs通过大量吸收和消耗环境中的精氨酸,损害T细胞免疫应答、抑制T细胞增殖和促进凋亡[13-15]。除精氨酸之外,MDSCs中其他氨基酸代谢特点以及对免疫抑制功能的影响目前少有报道。为了深入了解脓毒症MDSCs的能量代谢水平和氨基酸代谢特点,本文采用安捷伦Seahorse XF技术实时监测MDSCs能量代谢,采用超高效液相色谱-串联质谱联用技术(ultra-performance liquid chromatography/tandem mass spectrometry, UPLC-MS/MS)靶向检测脓毒症小鼠骨髓MDSCs中的氨基酸及寡肽含量,旨在明确脓毒症MDSCs氨基酸代谢特点,为进一步探索脓毒症免疫抑制机制提供新思路。
1 材料与方法
1.1 实验动物
所有实验小鼠均来自中国医学科学院实验动物研究所(北京),12 h/12 h昼夜循环且恒温环境下自由饮食,为6~8周龄雄性C57BL/6小鼠,体质量18~20 g。所有动物饲养及动物实验均获得首都医科大学动物实验及实验动物福利委员会批准(批准号:AEEI-2021-181)。
1.2 脓毒症小鼠模型构建及样本采集
通过盲肠结扎穿孔(cecal ligation and puncture, CLP)手术制备脓毒症小鼠模型[16]。每次实验将20只小鼠随机分成两组,每组10只,分别进行CLP手术和假手术(sham组)对照。生存率实验重复观察3次,确定CLP模型构建稳定。选取其中一次实验小鼠分离骨髓单细胞悬液,用于后续实验。首先腹腔注射80 mg/kg戊巴比妥钠(溶于生理盐水)麻醉,腹部常规消毒,沿腹中线切口打开腹腔,分离盲肠远端与大肠系膜,游离出盲肠,用不可吸收的4号丝线在盲肠尾部的第三到第四根血管之间结扎。随后,使用18号针头于盲肠处穿孔2次,并轻轻挤出少许盲肠内容物确保穿刺孔开放。最后还纳肠管,并对肌肉层和皮肤层依次进行简单的间断缝合。术后于小鼠背侧皮下注射1 mL生理盐水补液。对照sham组仅进行开腹、关腹缝合操作。连续观察7 d,绘制CLP模型小鼠的生存曲线,麻醉处死小鼠,分离股骨和胫骨制备骨髓单细胞悬液。
1.3 MDSCs样本制备
麻醉处死小鼠,组织剪解剖取出小鼠的双侧股骨和胫骨,在超净台中用无菌纱布剥除腿骨上残余的附着肌肉。用2 mL无菌注射器吸取无菌磷酸盐缓冲液,反复冲洗骨髓腔,收集细胞悬液于流式管中。用滴管反复吹打为单细胞悬液,400目无菌纱网滤膜过滤细胞悬液,以去除组织碎块等杂质。细胞分选使用BD Aria Ⅱ流式细胞仪进行,分选纯度大于95%。在骨髓单细胞悬液中加入荧光抗体抗CD45、抗CD11b和抗Gr-1抗体于4 ℃避光染色15 min。采用BD Aria Ⅱ流式细胞仪分选CD45+CD11b+Gr-1+MDSCs细胞,一部分新鲜细胞用于能量代谢实时检测,另一部分细胞团块储存于-80 ℃用于代谢组学分析。
1.4 氧气消耗速率(oxygen consumption rate, OCR)检测
使用安捷伦Seahorse XF分析仪(安捷伦,美国)实时检测细胞OCR。将新鲜分离的MDSCs细胞在含有10%胎牛血清的RPMI-1640培养基中洗涤一次,然后按照每孔1×105细胞数接种到24孔生物能量分析仪细胞培养板中,在37 ℃下孵育1 h后再进行分析。将事先配置好的浓度分别为15、10、5 μmol/L的寡霉素、碳酰氰4-(三氟甲氧基)苯腙[carbonyl cyanide 4-(trifluoromethoxy)phenylhydrazone, FCCP]、鱼藤酮和抗霉素A工作液,按每孔56、62、69 μL加入到相应孔中,测量OCR。
1.5 UPLC-MS/MS代谢组学分析
在冰浴下解冻MDSCs细胞团块,加入80 μL含同位素内标的甲醇溶液,超声裂解细胞。再在4 ℃下以18 000×g离心20 min。取10 μL上清液与70 μL硼酸盐缓冲液(pH = 8.8)和20 μL 6-氨基喹啉基-N-羟基琥珀酰亚氨基甲酸酯衍生化试剂混合,55 ℃、1 200 r/min反应10 min。反应结束后加入900 μL超纯水,混匀并从中吸取50 μL,加入50 μL超纯水混匀后通过UPLC-MS/MS技术靶向测定氨基酸含量。采用UPLC-MS/MS技术靶向检测MDSCs的氨基酸水平。仪器的参数和方法设置如下:色谱柱使用VanGuard保护柱(2.1 mm×5 mm, 1.7 μm)和ACQUITY UPLC分析柱(2.1 mm× 100 mm, 1.7 μm);柱温40 ℃、样品管理器温度10 ℃、流动相液速0.6 mL/min以及注射体积5 μL。流动相包括水相[含有0.1%(体积分数)甲酸的水)和有机相[含有0.31%(体积分数)甲酸的乙腈],配制水相与有机相梯度混合溶液(比例从96∶4到5∶95),采用混合溶液动态洗脱9 min。
1.6 统计学分析
采用GraphPad Prism 9软件对数据进行统计学分析。正态分布数据以均数±标准差表示,使用两独立样本t检验比较两组间的统计学差异;非正态分布资料以中位数(四分位数)表示,两组间比较使用Mann-WhitneyU检验。分类指标构成比数据使用Fisher精确概率法比较组间差别,P<0.05认为差异具有统计学意义。采用MassLynx软件对 UPLC-MS/MS生成的原始数据文件进行处理,提取每个代谢物的峰并进行积分和定量。使用单维检验(依据数据的正态性和方差齐性选取t检验或Menn-WhitneyU检验)分析差异代谢物。使用监督模式下的正交偏最小二乘-判别分析(orthogonal partial least square discriminant analysis, OPLS-DA)进一步研究两组数据间氨基酸MDSCs分布特点,计算代谢物的变量重要性值(various important projection, VIP),以VIP>1为条件筛选差异氨基酸。将多维和单维分析中得到的共同差异代谢物定义为潜在生物标志物,使用小分子通路数据库(small molecular pathway database, SMPDB)对差异代谢物进行通路富集分析。
2 结果
2.1 CLP组小鼠MDSCs线粒体功能变化
实验小鼠CLP后逐渐出现呼吸频率加快、大便稀软、饮水、进食及活动次数减少。术后约12 h小鼠眼周分泌物增加,大便呈稀水样,活动次数明显减少,部分小鼠出现死亡。术后约3 d进入稳定期,小鼠死亡明显减少。如图1A所示,CLP组小鼠的7 d生存率为50%(n= 10)。与sham组(43.15% ± 7.42%)相比,CLP组小鼠骨髓中的MDSCs比例(75.53% ± 6.02%)显著上升(t= 7.582,P< 0.001,图1B和1C)。采用流式细胞术分选小鼠骨髓MDSCs,使用安捷伦Seahorse XF分析仪测量OCR,发现CLP组小鼠MDSCs的基础呼吸能力[(50.03±1.20)pmol/min]、线粒体腺嘌呤核苷三磷酸(adenosine triphosphate, ATP)产生[(25.30±1.21)pmol/min]和最大呼吸速率[(78.07±2.57)pmol/min]均显著高于sham组的基础呼吸速率[(34.53±0.96)pmol/min,(t= 17.41,P< 0.001)]、ATP产生[(12.63±0.96)pmol/min,(t=14.18,P<0.001)]和最大呼吸速率[(42.57±1.87)pmol/min,(t= 19.33,P<0.001)],表明CLP组小鼠MDSCs线粒体氧化磷酸化功能增强(图1D~1G),因此,CLP组小鼠的骨髓中MDSCs比例增加,且表现出葡萄糖有氧氧化增强。
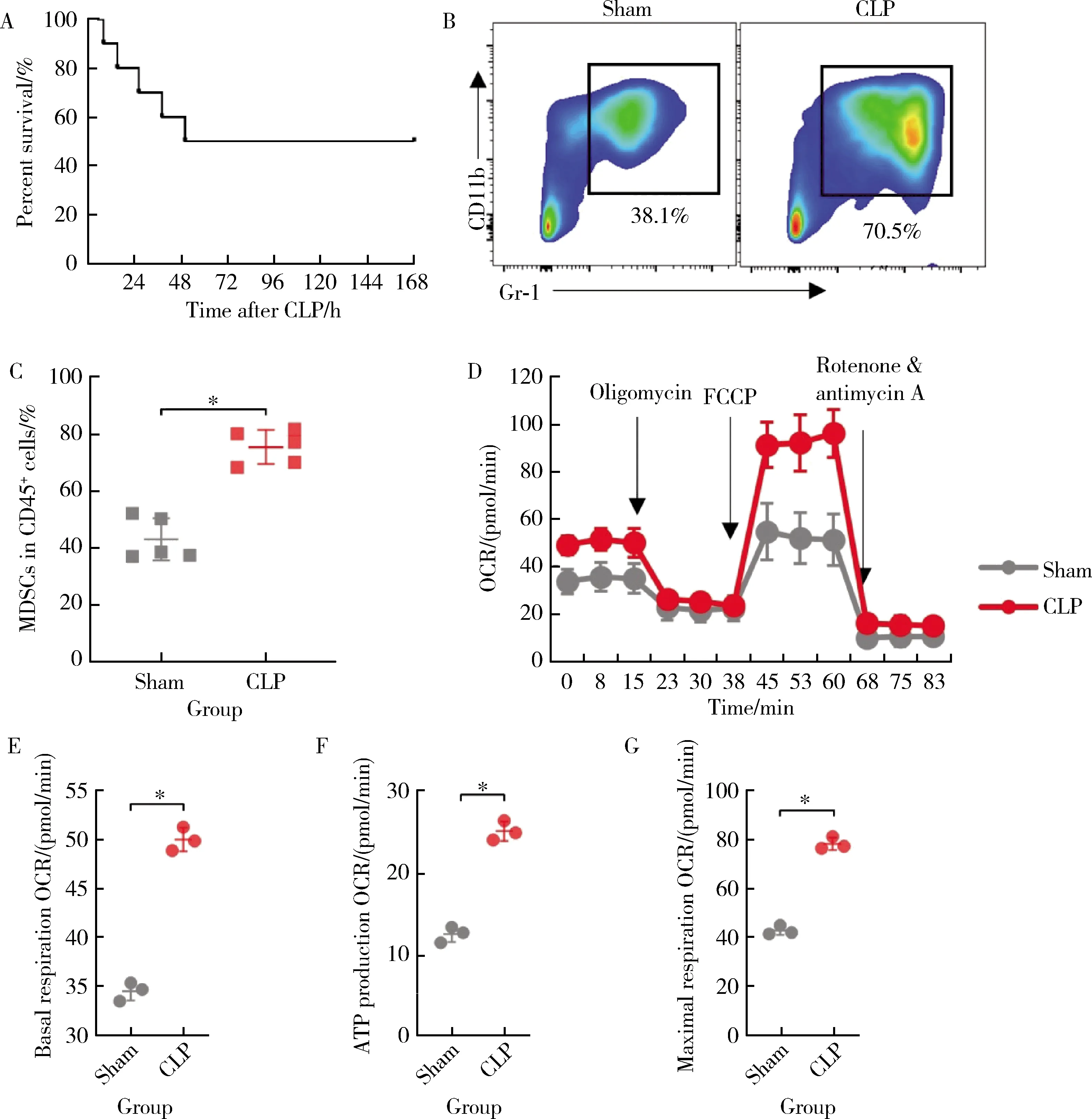
A, survival curve of CLP group mice; B, representative plot of flow cytometry of mouse bone marrow MDSCs; C, comparison of MDSCs content between sham group and CLP group; D, OCR curves of MDSCs in sham and CLP groups; E, F, G, basal, ATP production and maximum respiration OCR of MDSCs in sham and CLP groups.CLP, cecal ligation and puncture; MDSCs, myeloid-derived suppressor cells; OCR, oxygen consumption rate; FCCP, car-bonyl cyanide-p-trifluoromethoxyphenolhydrazone; ATP, adenosine triphosphate.*P < 0.001.
2.2 CLP组小鼠MDSCs的氨基酸代谢特点
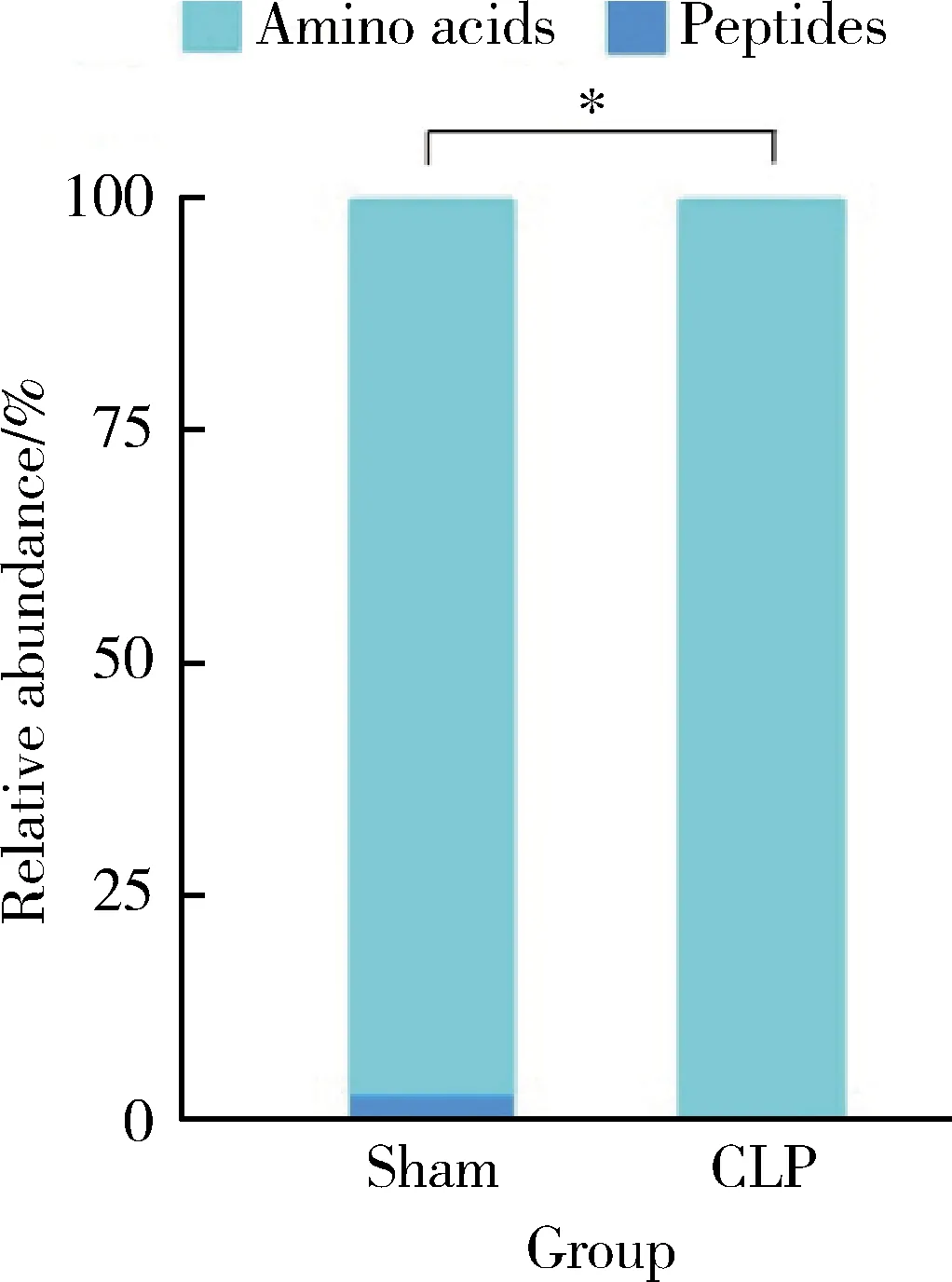
为了研究CLP组小鼠MDSCs的氨基酸代谢特点,采用UPLC-MS/MS技术靶向检测细胞内氨基酸及寡肽含量。本研究成功鉴定出29种氨基酸类代谢物,包括27种氨基酸及2种寡肽。使用Fisher精确概率法分析CLP组和sham组小鼠骨髓中MDSCs的各类代谢物组成差异,发现两组小鼠骨髓中MDSCs的各类代谢物构成不同(P<0.001,图2)。采用单维检验,根据筛选标准P<0.05、log2FC的绝对值≥0,获得两组间的差异代谢物。与sham组相比,甘氨酸、亮氨酸、天冬氨酸、赖氨酸等26种氨基酸含量升高,没有含量降低的氨基酸(表1,均P<0.05)。

表1 单维检验分析sham组与CLP组小鼠MDSCs中氨基酸及寡肽含量
CLP, cecal ligation and puncture; MDSCs, myeloid-derived suppressor cells.*P < 0.001.
2.3 CLP组小鼠MDSCs的氨基酸标志代谢物
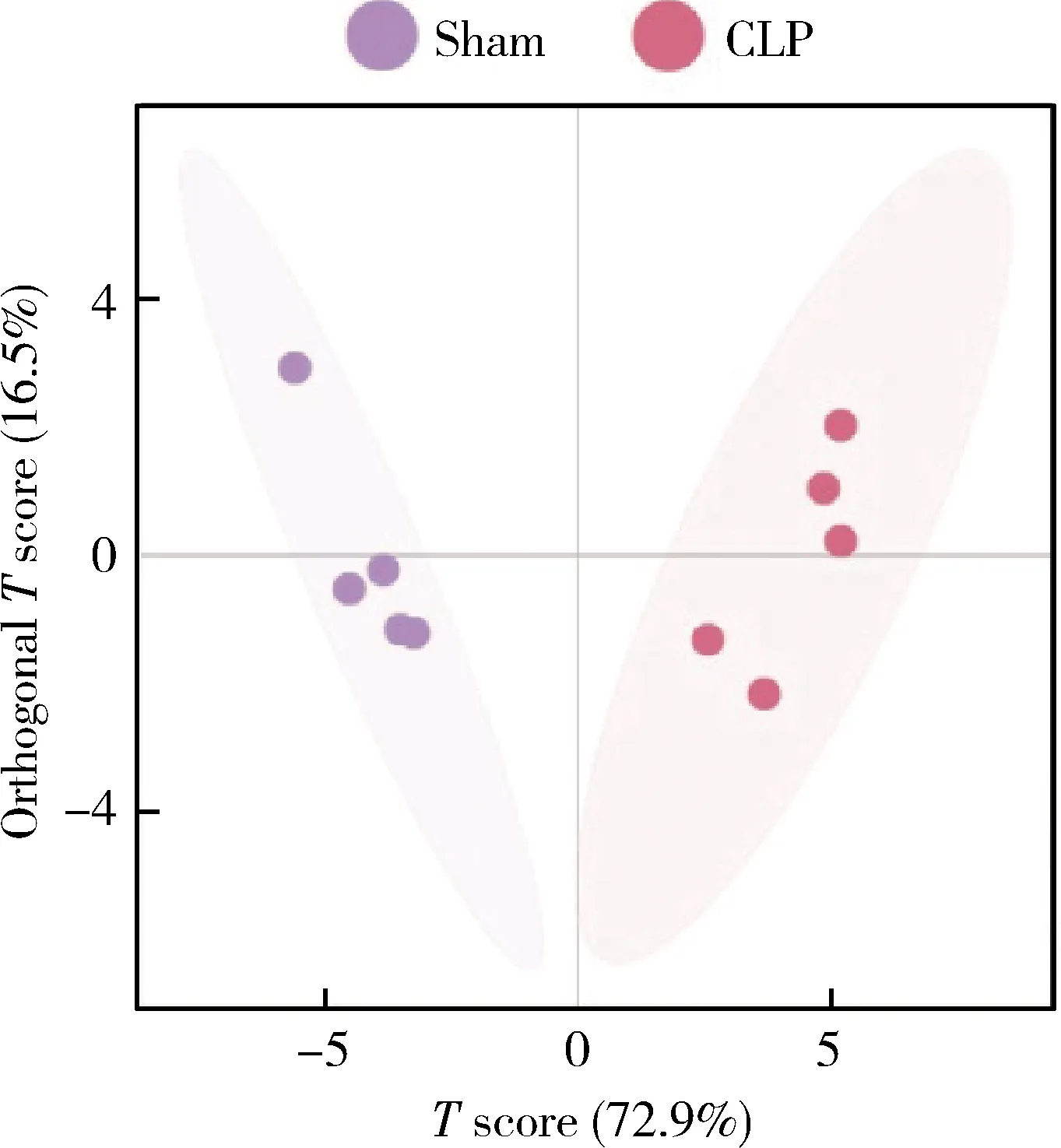
为了进一步筛选差异代谢物,我们在单维检验结果的基础上,采用OPLS-DA进行多元变量统计分析。图3展示了OPLS-DA的分析结果,横坐标是第一预测主成分的得分值,显示不同组间的差异;纵坐标是第一正交成分的得分值,显示组内样本间的差异,括号中的百分比代表主成分的解释率,结果显示sham组与CLP组单独分布、无重叠,表明两组的代谢物成分存在差异。基于OPLS-DA模型,对两组MDSCs的氨基酸和寡肽进行归一化处理,根据VIP > 1,结果显示亮氨酸、苏氨酸、甘氨酸等17种氨基酸在CLP组含量均显著升高,是CLP组小鼠MDSCs中的氨基酸标志代谢物(表2)。
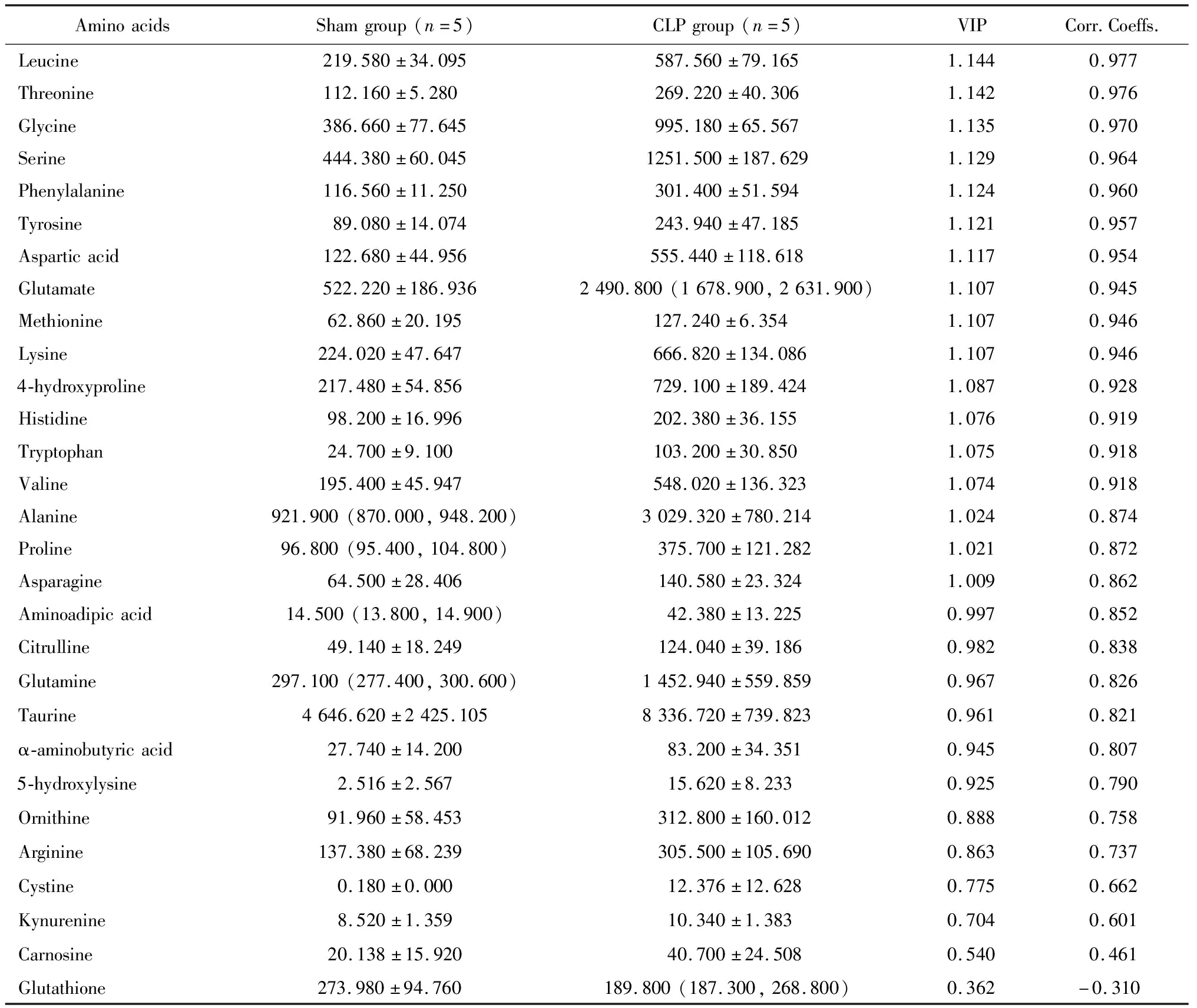
表2 多元变量统计分析sham组与CLP组小鼠MDSCs中氨基酸及寡肽含量
CLP, cecal ligation and puncture; MDSCs, myeloid-derived suppressor cells; OPLS-DA, orthogonal partial least square discriminant analysis.
2.4 MDSCs氨基酸标志代谢物的通路富集分析
将单维和多维统计筛选出的差异代谢物进行合并,得到17种潜在生物标志物。采用热图展示标志代谢物在每个单独样本中的含量,结果显示17种标志代谢物在所有CLP组小鼠MDSCs中含量均显著升高(图4A)。如图4B所示,CLP组小鼠骨髓MDSCs中17种潜在生物标志物的主要富集代谢通路为苹果酸-天冬氨酸穿梭、氨回收、丙氨酸代谢、谷胱甘肽代谢、苯丙氨酸和酪氨酸代谢、尿素循环、甘氨酸和丝氨酸代谢、β-丙氨酸代谢、谷氨酸代谢、精氨酸和脯氨酸代谢。

A, heat map of changes in marker metabolite content in MDSCs in the sham group and CLP group; B, bar graphs of enrichment analysis of metabolite pathways for MDSCs markers in sepsis, all P <0.001.CLP, cecal ligation and puncture; MDSCs, myeloid-derived suppressor cells.
3 讨论
脓毒症后期免疫抑制和代谢紊乱是造成患者长期发病甚至死亡的重要原因。MDSCs增多并引起的免疫抑制是脓毒症继发感染以及预后不良的关键因素。在本研究中,我们发现CLP组小鼠骨髓中发挥免疫抑制作用的MDSCs比例显著增加。线粒体是能量生成的主要场所,我们通过线粒体压力测定试剂盒检测发现,CLP组小鼠的MDSCs的基础呼吸、ATP合成和最大有氧呼吸都较sham组小鼠增强,说明CLP组MDSCs线粒体有氧呼吸和能量代谢增强,可能用于增殖和维持免疫抑制功能。我们进一步通过UPLC-MS/MS技术靶向检测CLP组小鼠MDSCs中的氨基酸代谢组,发现与sham组相比,CLP组小鼠的MDSCs氨基酸代谢谱发生明显改变。在MDSCs中共检测到29种氨基酸及寡肽。在单维检验中,甘氨酸、亮氨酸、天冬氨酸等26种氨基酸在CLP组小鼠MDSCs中含量显著上调,但是由于代谢组学数据具有多维和变量间高度相关的特点,使用传统的单变量分析无法准确挖掘数据内潜在的关联信息,因此在单维检验基础上进一步采用多元变量统计分析进行降维和归类,剔除无关变量,筛选出CLP组小鼠MDSCs的氨基酸标志代谢物。在多维分析中,与sham组相比,CLP组小鼠MDSCs中亮氨酸、苏氨酸、甘氨酸等17种氨基酸含量均显著增加,这17种潜在生物标志物的主要富集代谢通路为苹果酸-天冬氨酸穿梭、氨回收、丙氨酸代谢等,因此,CLP组中MDSCs细胞内氨基酸代谢谱显著改变,氨基酸含量普遍上调,提示MDSCs可能通过竞争必需氨基酸来抑制其他免疫细胞活性。由此推测,CLP组MDSCs中显著增强的代谢通路可能与MDSCs的增殖和免疫抑制功能相关。
虽然早期识别和治疗已经使脓毒症导致的多器官功能障碍和住院死亡率有所下降,但是越来越多的脓毒症患者,尤其是老年人,会发展为慢性危重症状态,表现为持续的炎症-免疫抑制和分解代谢综合征(persistent inflammation-immunosuppression and catabolism syndrome, PICS)[5],这种持续的炎症、免疫抑制和分解代谢会导致不良临床结局。脓毒症患者的MDSCs数量显著增加,且随病情危重时间持续升高[10]。MDSCs具有免疫抑制功能,并通过产生炎症介质、一氧化氮和活性氧引起持续的炎症反应,是PICS的促进因素[5]。进入PICS阶段的脓毒症患者表现出分解代谢增强,血清白蛋白<3.0 g/dL,肌酐身高指数<80%,住院期间体质量减轻10%或体重指数<18 kg/m2[5]。针对脓毒症患者氨基酸代谢紊乱,研究提出采用营养支持疗法,补充多种氨基酸可以改善脓毒症患者的预后[17],但是,也有临床试验发现外源氨基酸补充会产生潜在危害[18]。在本研究中,CLP组小鼠MDSCs中亮氨酸、苏氨酸、甘氨酸等氨基酸含量普遍上调,苹果酸-天冬氨酸穿梭、氨回收、丙氨酸代谢增强,可能是由于MDSCs对这些氨基酸的吸收增多,也可能是糖脂代谢等其他途径分解代谢增强,一方面用于供能,促进MDSCs增殖,另一方面将代谢产物转化成氨基酸用于合成特定蛋白质,维持MDSCs免疫抑制功能。
细胞需要足够的能量和营养物质维持活性和增殖。近年研究逐渐清晰地认识到,免疫细胞可通过代谢重编程来调整自身免疫功能,以适应与癌症、炎症以及自身免疫性疾病相关的病理微环境。比如肿瘤相关MDSCs通过显著增加脂肪酸β氧化来进行代谢重编程,这种代谢重编程伴随着三种免疫抑制机制的激活,即精氨酸酶1、一氧化氮合酶2和过氧亚硝基阴离子的上调,从而阻断T细胞增殖和γ干扰素产生[19]。本研究中,CLP组小鼠MDSCs的线粒体功能增强,包括基础呼吸、最大呼吸、呼吸潜力都显著高于sham组小鼠。线粒体是细胞内氧化磷酸化和形成ATP的主要场所,氧化磷酸化是驱动MDSCs抑制功能的关键代谢途径[20],这些结果说明CLP组小鼠MDSCs通过增强线粒体的氧化磷酸化和ATP产生,用于维持MDSCs的免疫抑制功能和为MDSCs增殖提供能量。
氨基酸对正常的细胞功能和存活是必不可少的。在我们的研究中,脓毒症MDSCs标志代谢物的第一富集通路为苹果酸-天冬氨酸穿梭,也称为苹果酸穿梭,是真核细胞中协助电子跨越线粒体内膜进入线粒体的电子传递链以生成ATP的生物化学体系。由于线粒体内膜对于还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NADH)不通透,需要苹果酸携带NADH跨越线粒体内膜用于氧化磷酸化产生ATP。糖酵解和氧化磷酸化的活性依赖NAD+/NADH 稳态,因此苹果酸-天冬氨酸穿梭在同步细胞质糖酵解途径和线粒体氧化磷酸化方面发挥重要作用[21]。在癌症中,苹果酸-天冬氨酸穿梭的诱导表达被认为是恶性肿瘤的标志物[22],因此,CLP组小鼠MDSCs中的标志代谢物主要富集于苹果酸-天冬氨酸穿梭代谢通路,为细胞线粒体氧化磷酸化传递电子,以维持MDSCs的免疫抑制功能。
除了增强线粒体功能和苹果酸-天冬氨酸穿梭代谢通路进行氧化磷酸化用于维持免疫抑制功能外,CLP组小鼠MDSCs中还有很多其他含量增加的氨基酸。CLP组小鼠MDSCs中氨基酸含量的升高可能是与其他免疫细胞竞争导致的。研究表明,具有高代谢率的MDSCs可以与自然杀伤细胞和细胞毒性T淋巴细胞竞争精氨酸、色氨酸、半胱氨酸等必需氨基酸,限制自然杀伤细胞和细胞毒性T淋巴细胞的存活并诱导细胞凋亡[23]。在前列腺癌模型中,抑制L-精氨酸的转运可以使MDSCs控制 T 细胞免疫的能力减弱,抗肿瘤活性增强[24]。MDSCs与抗原呈递细胞竞争细胞外胱氨酸,使抗原呈递细胞不能将胱氨酸在细胞内还原成半胱氨酸并转运给T细胞,从而剥夺T细胞激活和发挥功能所需的半胱氨酸[25]。MDSCs还可以将色氨酸降解为犬尿氨酸,促进调节性T细胞的扩增和阻碍树突状细胞的免疫激活[26]。MDSCs与抗肿瘤细胞竞争谷氨酰胺并部分氧化L-谷氨酰胺,从而增加免疫抑制,为肿瘤创造有利的条件[23],因此,在肿瘤中MDSCs通过与其他免疫细胞如抗原呈递细胞、T细胞竞争氨基酸,抑制免疫细胞的功能,促进肿瘤生长。我们推测在脓毒症中MDSCs发生的氨基酸代谢变化也与它在脓毒症中的免疫抑制作用相关,但是由于多种氨基酸均显著升高,氨基酸代谢谱整体发生变化,很难通过改变某一氨基酸代谢途径来影响MDSCs功能,因此我们没有针对某个氨基酸进行实验验证。
目前围绕MDSCs氨基酸代谢的研究主要集中在癌症领域,关于脓毒症中MDSCs氨基酸代谢改变及其对免疫应答的影响研究较少,未来还需要探索氨基酸代谢调控脓毒症MDSCs功能的具体机制。本研究采用经典的CLP脓毒症小鼠模型研究脓毒症中MDSCs氨基酸代谢特点,尽管本研究制备的CLP小鼠模型稳定,氨基酸代谢谱分析组内差异较小,但每组5只小鼠仍存在样本量小的局限性,因此本研究得出的初步结论,仍需进一步扩大样本量重复验证。在今后的研究中,通过进一步鉴定CLP术后不同时间点小鼠骨髓MDSCs数目、功能、血清炎症因子水平以及氨基酸代谢谱,并进行综合分析,有助于充分认识并判别脓毒症不同进展阶段的免疫-代谢状态,为揭示脓毒症免疫病理机制提供重要补充,也将为纠正脓毒症患者免疫-代谢紊乱提供重要靶点和思路。
