5种光周期对锦鲤生长、能量收支及生物钟基因表达的影响
2022-06-09史东杰王文峰李文通王赛赛姜巨峰
史东杰 王文峰 李文通 魏 东 王赛赛 姜巨峰
(1. 北京市农林科学院, 水产科学研究所, 北京 100068; 2. 农业农村部华北都市农业重点实验室, 北京 10097;3. 北京市房山区养殖业技术推广站, 北京 102488; 4. 天津农学院水产学院, 天津 300380;5. 天津市水产研究所暨天津市观赏鱼技术工程中心, 天津 300221)
光照、温度和食物等对硬骨鱼类胚胎发育、生长、繁殖和性别分化等具有重要影响[1,2]。光照主要包括光周期、光谱和光强, 在自然界所有物理影响因素中, 光周期最为规律, 是唯一能够为动物提供季节性稳定节律的环境因子。不同鱼类具有不同的生理节律、运动行为、基因表达及生理生化功能, 这些生命活动与光周期同步[3—5]。
研究发现, 光信号传输至机体松果体控制生物钟基因震荡、激素水平涨落、识别功能及记忆力等生命活动。魏萍萍等[6]研究表明, 在光周期8L∶16D处理组, 红鳍东方鲀脑组织中的生长激素GH基因和生长激素抑制素SS基因相对表达量均显著高于光周期24L∶0D处理组, 且两种基因的表达水平在光周期8L∶16D和12L∶12D实验条件下表现出夜高昼低的特点。刘春晓等[7]实验证明, 连续光照可有效提高斑马鱼(Danio rerio)卵巢转化生长因子-β超家族/Samd (TGF-β/Smad) 信号通路基因的相对表达量。袁满等[8]研究发现, 在光周期12L∶12D条件下, 花鲈(Lateolabrax maculatus)垂体中生物钟基因Cry1/2、Per2、Cry1a和Timeless呈现昼夜节律。Brown等[9]研究认为, 长光照15L∶9D能使加利福尼亚银鱼(Leuresthestenuis)性腺偏雌发育, 光照12L∶12D则使性腺偏雄发育。Shin等[10]的研究表明, 在长光照14L∶10D条件下, 金鱼(Carassius auratus)的GnRHs、GYHs、Kiss1/GPR54 mRNA及血浆促卵泡生成素(Follicle-stimulating hormone,FSH)、17α-羟基孕烯醇酮(17α-hydroxypregnenolone)水平明显高于短光照10L∶14D和对照组12L∶12D。这些研究表明, 光周期对鱼类生长、能量收支和基因表达具有调控作用。
锦鲤(Cyprinus carpio)隶属鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲤属(Cyprinus), 其体型健美, 色彩艳丽, 斑纹变幻莫测, 是欧亚地区重要的经济型观赏鱼养殖品种。目前, 有关光周期对锦鲤生长影响的报道甚少, 本研究拟开展5种光周期对锦鲤生长、能量收支及生物钟基因表达影响的研究, 为锦鲤养殖业提供参考数据。
1 材料与方法
1.1 实验鱼及养殖条件
实验鱼来自北京市观赏鱼创新团队大兴综合实验站自家产群体, 日光温室条件下养殖, 14d后随机挑选体质健壮、规格相近的锦鲤750尾(126.37±5.62) g, 于实验室循环水系统进行玻璃缸养殖, 每个养殖用玻璃缸(2.0 m×0.8 m×0.6 m)50尾, 15个缸。养殖水温(21±1)℃, 溶解氧≥4 mg/L, 每天上午9:00—9:30、下午15:00—15:30各投喂1次, 投喂正规厂家生产的商品膨化饲料, 日投喂量为鱼体重的2%—3%, 并根据摄食情况做适当调整。每5—7d换水1次, 每次换水量为总水量的15%, 24h充气。实验室24h开启20W节能灯补充光照, 选用黑色遮光布避光。使用测量仪测量光强, 在整个养殖过程中,水面处的光强为750 lx。暂养期和正式实验期, 除光周期处理不同外, 其他条件不变。
1.2 实验设计与样品采集
实验鱼在养殖缸暂养7d后, 开始正式。实验设计5个光周期: 长光照18L∶6D (光照时间8:00—次日2:00)、短光照8L∶16D (光照时间8:00—16:00)、连续光照24L∶0D (光照时间8:00—次日8:00)、连续黑暗0L∶24D (无光照)和对照组12L∶12D (光照时间8:00—20:00)。光源采用LED光源(深圳市绿源灯光设备有限公司), 光色为白色(λ400—780 nm)。1个玻璃缸对应一个光周期处理组, 每组设3个平行。实验周期为90d。实验第1天, 每个实验组取30尾实验鱼测量体质量、干重和鱼体干物质能值。实验第15、第30、第45、第60、第75和第90天进行采样, 每次随机选取实验鱼30尾, MS-222(0.1g/L)麻醉, 测量体质量。实验第90天, 每个光周期处理组随机取60尾实验鱼在冰盘上解剖取全脑组织, 迅速至液氮速冻后于-80℃冰箱保存备用, 并随机取30尾实验鱼测量干重、鱼体干物质能值和含氮量。实验期间记录成活率、饲料量、粪便量和残饵量等数据, 每次在投喂1h后及投喂前用虹吸法移出粪便和残饵, 于70℃烘干、研磨、称重, 保存备用。
1.3 总RNA提取与生物钟基因表达量测定
TRIzol法提取不同光周期条件下实验鱼全脑的总RNA, 用琼脂糖凝胶电泳确定RNA完整性, 要求A260nm/A280nm的值为1.8—2.0[11], 琼脂糖凝胶浓度为1.5%。根据SYBR Premix ExTaqTMⅡKit (Tli RNaseH Plus)的引物设计原则, 用Premier 5软件设计生物钟基因Clock、Cry1、Bmal1、Per2基因和βactin基因的特异引物。β-actin基因为内参基因。引物委托宝生物工程(大连)有限公司合成。引物序列信息见表 1。
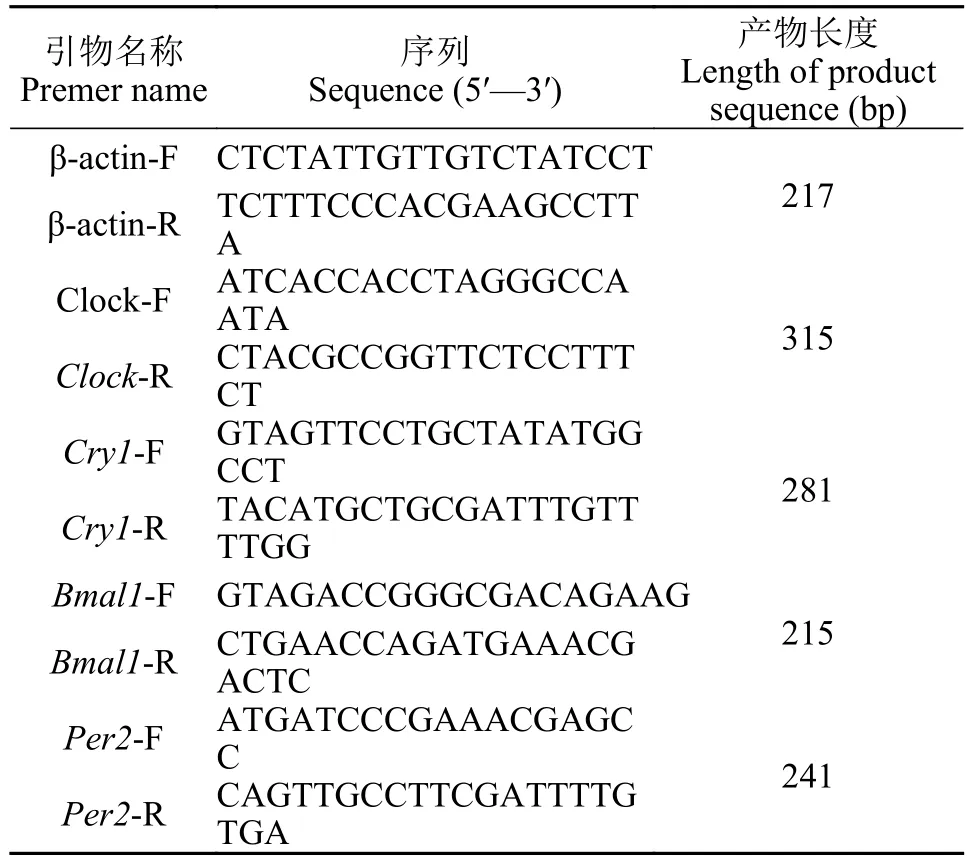
表1 本实验所用引物信息Tab. 1 Primers used in the study
参照TransScript©Oen-Step gDNA Removal and cDNA Super Mix 说明书要求将RNA反转录成cDNA, 使用LightCycle96仪器和SG Fast qPCR Master Mix(2×)试剂盒进行PCR实验。PCR反应体系:共20 μL, 2×SYBR Premix FxTaqⅡ10 μL, 上游、下游引物(10 μmol/L) 分别为0.6 μL, cDNA模板1.0 μL,50×Passive Reference Dye Ⅱ0.4 μL, 蒸馏水8 μL。反应条件: 95℃变性8s, 60℃退火20s, 95℃延伸15s,重复45个循环。每个样品均重复3次。
1.4 指标分析与数据处理
数据采用mean±SD表示。用SPSS19.0 软件进行单因子方差和多重比较, 分析不同光周期处理条件下锦鲤生长指标、能量收支和生物钟基因Clock、Cry1、Bmal1和Per2相对表达量等各数据差异的显著性, 显著水平为0.05。RT-PCR相对表达量数据用2-ΔΔCt计算[12]。
特定生长率(SGR)、饲料系数(FCR)、成活率(SR)计算方法如下:SGR(%/d)=(lnW1- lnW0)/d×100;FCR=T/(W1+W2-W0);SR(%)=S1/S0×100。式中,W0、W1和W2分别为鱼初始体重(湿重)、终末体重(湿重)和死鱼重量(湿重);T为总投喂量;d为饲养天数;S0和S1分别为实验初鱼尾数和实验末鱼尾数。
采用进口IKA C5000氧氮式量热计测定各样品能值, 用KDN520全自动凯氏定氮仪测定含氮量。能量收支模型[13]为C=P+F+R+U。式中,C为摄食能(摄食量×饲料能值);P为总生长能(终末鱼体能量-初始鱼体能量);F为粪便能(单位质量粪便能值×粪便量);R为代谢能(通过上述公式计算, 即R=CP-F-U[14]);U为排泄能(通过氮收支差值计算, 即U=(CN-FN-PN)×24.83。其中CN为食物氮、FN为粪氮、PN为生长氮)。
2 结果
2.1 生长、饲料系数和成活率
从表 2可见, 在整个实验周期, 各处理组锦鲤的成活率无显著变化(P>0.05), 24L组和18L∶6D组饲料系数显著低于12L∶12D组、8L∶16D组和24D组(P<0.05)。实验前30d内, 各处理组特定生长率无显著变化(P>0.05), 但随着实验时间延长, 24L组、18L∶6D组和12L∶12D组锦鲤的特定生长率显著高于8L∶16D组和24D组(P<0.05)。从表 2可以看出, 在实验开始的前30d内, 实验鱼的终末体重无显著差异(P>0.05), 从第45天至实验结束, 24L组、18L∶6D组和12L∶12D组终末体重显著高于8L∶16D组和24D组(P<0.05), 24L组获得最大体重(587.98±23.86) g, 24D组获得最小体重为(429.61±19.73) g。
在实验期间, 各处理组锦鲤终末体重均有增加(图 1), 但增长率不同, 在12L∶12D光处理条件下, 锦鲤终末体重的线性回归方程的斜率为0.9755(图 1A),24L组的锦鲤生长速度最快, 斜率为0.6491, 其次为18L∶6D组, 斜率为0.6320; 24D组的锦鲤生长速度最慢, 斜率为0.4291。
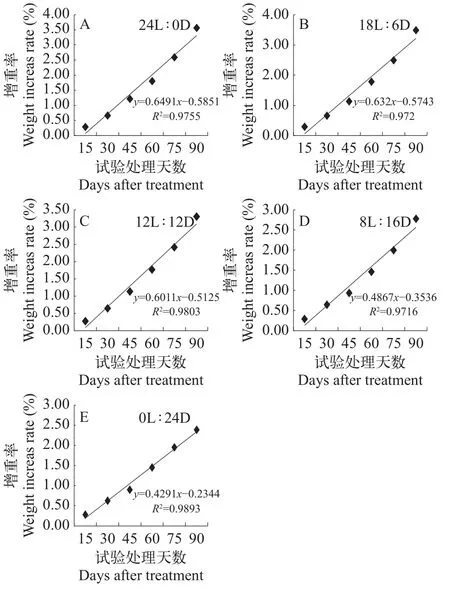
图1 不同光照条件下锦鲤增重率的线性回归分析Fig. 1 Linear regressive analysis of koi carp body weight increase rate in different light conditions
2.2 能量分配
表3为不同光照条件下养殖90d, 平均每克干物质鱼体摄食能在4种能量支出的分配比例。由表 3可见, 在不同光周期条件下, 摄食能分配在代谢能的比例最大, 其次是消耗在生长能。各组分配于代谢能和生长能的比例, 在24L∶0D、18L∶6D、12L∶12D和8L∶16D四组之间无显著差异(P>0.05),但在0L∶24D组存在显著差异(P<0.05), 分配于代谢能和生长能的比例明显下降, 损失于排泄能和粪便能的比例最高(P<0.05)。

表3 不同光照条件下锦鲤的能量总收支Tab. 3 Total energy budget of koi under different light conditions(%)
2.3 生物钟相关基因表达量变化
由图 2可见,Clock基因相对表达量在24L∶0D光周期条件下最高, 并显著高于其他光照条件处理组(P<0.05);Per2基因的相对表达量在18L∶6D光周期处理组最高, 但18L∶6D组与12L∶12D组、8L∶16D组、0L∶24D间无显著差异(P>0.05),Per2基因的相对表达量在24L∶0D组最小(P<0.05);Cry1基因的相对表达量在24L∶0D和18L∶6D两个光周期处理组不显著, 且显著高于其他光照处理组,Cry1基因的相对表达量在其他光照处理组依次为12L∶12D > 8L∶16D > 0L∶24D;Bmal1基因的相对表达量在各光周期处理组均无显著性差异(P>0.05)。
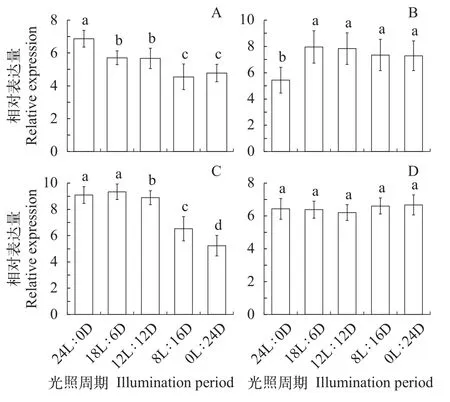
图2 不同光照条件对锦鲤生物钟基因相对表达量的影响Fig. 2 Effects of different light conditions on the relative expression of four biological clock genes in koi carp
3 讨论
3.1 锦鲤幼鱼生长的最适光周期
在自然环境中, 光周期作为重要的环境因子之一, 可以对硬骨鱼类生长、代谢和繁殖产生重要的影响[1,2]。Hamed等[16]发现延长光照时间可以明显改善斑马鱼(Danio rerio)的生长和繁殖性能[15]。异育银鲫(Carassius auratus)在16L∶8D光周期条件下的最终体重、生长率和饲料利用率显著高于其他光周期处理组, 大西洋鲑(Salmo salar)在连续光照条件下获得最大体重[17], 鲤(Cyprinus carpio)在日光照大于6—9h时生长速度明显加快。大多数鱼类生活于10—12h的光周期环境[15]。在本实验中, 不同光周期(24L∶0D、18L∶6D、12L∶12D、8L∶16D和0L∶24D)处理45d后, 连续光照24L∶0D和较长光照18L∶6D、12L∶12D对锦鲤幼鱼的终末体重、特定生长率的增加具有显著影响(P<0.05), 通过线性回归分析, 终末体重的增长率最高, 说明不同的光周期对锦鲤生长具有一定的影响。据文献分析, 绝大多数报道认为长光照对鱼类生长、发育和内分泌调节具有改善作用[3—5,7,10,15—18], 目前未见到延长光照时间超过12L会对鱼类产生负影响的报道, 本实验研究结果与绝大多数报道观点一致。此外, 多数鱼类的实验研究通常会选择为14L∶10D[15], Wilkinson等[19]发现调控光周期对虹鳟存活率并无显著性影响。在本实验中, 整个实验周期5种光照条件处理组锦鲤的成活率无显著变化(P>0.05)这一结论也与Bahram等[20]对波斯鲟(Acipenser persicus)和Edgar等[21]对墨西哥慈鲷(Cichlasoma beani)的研究相似, 但Windarti等[22]研究认为, 在光照24D∶0L和18D∶6L条件下, 初始体重为约4 g的鲢(Hypophthalmichthys molitrix)经过, 8周的养殖, 平均体重为98 g,较自然光周期条件下平均体重增加26 g, 这与本研究结果不同, 推测可能与鱼类生活习性有关, 鲢是一种夜行性鱼类, 在黑暗的环境中较活跃, 因此连续黑暗更适合此类鱼的生长。
3.2 光周期对能量收支的影响
许多研究表明, 光对鱼类生理活动产生多种影响, 鱼类为了适应生活环境变化, 会把机体摄入能量分配到生长、代谢及其他维持生命活动的方面[23]。不同种类鱼的能量收支机制有所不同, 即使是同种鱼在不同摄食水平, 其能量分配情况也不同, 但是鱼类摄入的总能量首先需要满足基础代谢, 而后剩余的能量才会促进生长[24]。本研究锦鲤幼鱼也呈现相同的情况, 5种(24L∶0D、18L∶6D、12L∶12D、8L∶16D和0L∶24D)光周期处理条件下, 摄食能分配在代谢能比例最大, 其次是分配在生长方面, 说明代谢能和生长能主导了锦鲤幼鱼能量收支模式, 但在0L∶24D组, 出现代谢能和生长能显著下降的现象, 说明光周期对锦鲤能量收支主要组分之间的比例关系有一定的影响, 即在连续黑暗条件下, 锦鲤幼鱼用于代谢和生长的能量显著减少, 以适应黑暗环境, 这与林晓涛等[25]对光周期影响罗氏沼虾幼体能量收支的报道结果一致。
3.3 光周期对Clock、Per2、Cry1和Bmal1基因的影响
光照、温度、摄食水平和运动行为等多种环境因子都可被人、哺乳动物、昆虫、鸟类和植物的不同生物钟基因系统识别。很多研究显示, 对于生物钟系统调控来说, 光周期、光照强度和光质是影响生物钟相关基因表达和昼夜节律变化的最重要的环境因子, 且光对生物钟系统的调控呈现出特异性和保守性[26]。通过文献分析, 鱼类具有多种生物钟基因存在, 其中研究最为广泛的为Clock、Per2、Cry1和Bmal1等基因[27]。在本实验中, 研究了5种光照周期(24L∶0D、18L∶6D、12L∶12D、8L∶16D和0L∶24D)对锦鲤幼鱼生物钟基因Clock、Per2、Cry1和Bmal1表达的影响。结果表明,Clock和Cry1基因在连续光照24L∶0D和长光照18L∶6D条件下相对表达量较高, 但Per2在除连续光照24L∶0D处理条件外, 其他处理组相对表达量相近,此外,Bmal1基因表达量不受实验光照周期的影响。目前, 尚未见到光周期与生物钟基因表达量作用的报道, 在相关领域的研究表明, 斑马鱼Per2和Cry1aa基因能直接受光周期调节, 持续光照暴露与Cry1aa基因过量表达相同, 都能抑制生物振荡(Biooscillation), 但生物振荡在光暗循环实验条件下, 可显著增强, 使生物钟基因的表达节律与昼夜变化同步[28]。研究发现, 斑马鱼Per2基因启动子存在一个包含D-box和E/E,-box的光应答模块(LRM),Per2光应答生物反应与这个模块相关[29]。可见, 光周期在调控生物钟基因方面发挥重要作用。由于各种鱼类生活环境和机体调控机制不同, 对光环境的适应能力及光应答反应不同, 这也正印证了光对生物钟系统调控具有特异性和保守型。
4 结论
本研究通过定期监测不同光周期下锦鲤幼鱼生长、能量收支及生物钟基因相对表达量规律, 探究鱼类对光照环境的生理反应。在整个试验周期,各光周期处理组成活率无显著变化(P>0.05),24L组和18L∶6D组饲料系数显著低于12L∶12D组、8L∶16D组和24D组(P<0.05)。终末体重和特定生长率在实验前30d内受光照影响不大(P>0.05), 而实验30d后出现显著变化, 延长光周期尤其是连续光照会显著增加终末体重和特定生长率(P<0.05);对比连续黑暗0L∶24D组, 其他光周期处理组锦鲤摄食能分配在代谢和生长的比例显著增加(P<0.05); 4个生物钟相关Clock、Per2、Cry1和Bmal1基因相对表达水平无明显规律。因此, 在锦鲤幼鱼养殖过程中可以考虑延长光照或连续光照(18—24h/d)。本研究结果可为锦鲤幼鱼的养殖提供参考。
