柚皮苷对重症急性胰腺炎大鼠的疗效及Notch信号通路的影响研究∗
2022-06-09程玉婷周海东张中琳
赵 伟 程玉婷 周海东 张中琳
(上海市第十人民医院,上海 200443)
重症急性胰腺炎(SAP)是一种急腹症,常伴有多系统、多器官功能损害或衰竭[1]。SAP的发病和发展特点是变化迅速,病情复杂,治疗困难[2]。研究表明,急性胰腺炎的特征是间质水肿、腺泡细胞空泡化[3]。约25%的急性胰腺炎患者会发展为SAP,死亡率约为22.7%[4]。这种疾病的发病机制仍不完全清楚。Notch信号通路是一种高度保守的分子细胞信号通路,由Notch受体(1,2,3,4型)、Notch配体(DSL蛋白)和细胞内效应分子CSL蛋白(DNA结合蛋白)组成,其表达水平与多种细胞生物学效应密切相关,并且参与机体血管的生成[5]。孔令宇等[6]研究发现,抑制Notch信号的激活,可减少急性胰腺炎小鼠胰腺组织胰腺腺泡细胞的坏死,减少炎症反应。Notch信号通路与机体免疫系统密切相关,有研究表明,Notch1的表达水平与淋巴细胞发育相关,从而影响机体炎症因子水平的变化[7]。柚皮苷属于双氢黄酮类化合物,其主要成分为葡萄糖、鼠李糖和柚配质,具有防治心血管疾病、抗过敏、抗炎等功效[8]。王婷婷等[9]研究表明,柚皮苷可通过抑制细胞焦亡来减轻心肌缺血/再灌注损伤大鼠心肌细胞损伤及炎症反应。但柚皮苷对SAP是否有治疗作用尚未有报道。因此,本研究通过建立SAP大鼠模型,探讨柚皮苷对SAP大鼠及Notch信号通路的影响,为治疗SAP的潜在药物和治疗靶点的开发提供基础。
1 材料与方法
1.1 实验动物 12周龄SPF级SD大鼠(雌雄各半),购自北京富龙腾飞实验动物研究院有限公司[动物生产许可证号:SCXK(京)2019-0047],体质量220~240 g,所有大鼠均饲养于SPF级动物房,室温20~25℃,湿度40%~60%,光照昼夜交替(12 h/12 h),自由饮水饮食。本研究已通过医院伦理委员会批准。
1.2 实验药物 柚皮苷(河南莱尔茵生物科技有限公司,原料药,纯度99.95%,批号10387-19-4,将柚皮苷用生理盐水溶解成质量浓度为2.5、5、10 mg/mL的混悬液);注射用乌司他丁(广东天普生化医药股份有限公司,规格:5万单位,批号20200405)。
1.3 试剂与仪器 牛磺胆酸钠(北京汤普森生物科技有限公司,批号205-479-4);淀粉酶检测试剂盒、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)酶联免疫吸附试剂盒、苏木素-伊红(HE)染色液(波音特生物科技南京有限公司,批号BYT-30477、BYT-2917、BYT-2903、BYT-30172、BYT-1055);Notch1、DSL、CSL和β-actin单克隆抗体、兔抗鼠二抗(上海沪震生物科技有限公司,批号HZ-11357R、HZ-1047R、HZ-11859R、HZ-0146K、HZ-0174L)。酶标仪(上海科华生物工程股份有限公司,型号ST-360)。显微镜(日本尼康公司,型号ECLIPSE Si)。化学发光成像系统(北京托摩根生物科技有限公司,型号MG1500)。
1.4 分组与造模 各组大鼠在禁食、禁水12 h后,参照文献[10]的方法,腹腔注射3%戊巴比妥钠麻醉,上腹正中出切开腹部,暴露胰胆管,血管夹夹闭肝门部位胰胆管,经十二指肠刺入胰胆管,夹闭胆总管末端,注射1 mL/kg浓度为5%的牛磺胆酸钠,观察15~25 min,当胰腺颜色变为暗红,伴有肿大和出血时,表示SAP建模成功[10]。建模成功后,将大鼠伤口缝合。将建模成功的80只大鼠采用随机数字表法分为模型组、阳性对照组(乌司他丁2×104U/kg)[11]和柚皮苷低(25 mg/kg)、中(50 mg/kg)、高(100 mg/kg)剂量组[12],每组16只。另外取16只大鼠仅上腹正中出切开腹部后缝合伤口设为假手术组。
1.5 给药方法 各组大鼠均于术后1 h开始给药,阳性对照组大鼠腹腔注射2×104U/kg乌司他丁,柚皮苷低、中、高剂量组大鼠分别腹腔注射25、50、100 mg/kg柚皮苷,模型组和假手术组腹腔注射等量生理盐水,各组大鼠注射体积均是10 mL/kg,每天给药1次。
1.6 标本采集与检测 1)血清淀粉酶和炎症因子水平。48 h后于大鼠心脏采集血液3 mL,4℃2 500 r/min离心15 min,分离血清,检测血清淀粉酶、TNF-α、IL-1β、IL-6水平。2)胰腺病理组织。采用1%戊巴比妥钠腹腔注射麻醉大鼠,解剖取胰腺组织,采用生理盐水清洗组织表面血渍,然后放于甲醛溶液中固定48 h,最后制作HE染色切片并在显微镜下观察组织结构变化情况。3)胰腺组织Notch1、DSL和CSL蛋白表达水平。取0.5 g大鼠胰腺组织放入玻璃研磨器中,加入1 mL放射免疫沉淀裂解缓冲液充分研磨,离心提取蛋白上清液,调节蛋白浓度使其为3 μg/mL,每孔上样量为10 μL后进行电泳,将凝胶上的蛋白转移至硝化纤维素膜,5%脱脂奶粉溶液对硝化纤维素膜封闭2 h后,加入特异性抗体Notch1、DSL、CSL和β-actin一抗1∶2 000稀释,孵育12 h(4℃),然后加入二抗(1∶3 000)孵育2 h,最后使用显影剂在凝胶成像系统上显影。
1.7 统计学处理 应用SPSS23.0统计软件。计量资料以(±s)表示,多组间采用单因素方差分析比较,多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠血清淀粉酶水平与炎症因子水平比较 见表1。与假手术组比较,模型组血清淀粉酶水平显著升高(P<0.05);与模型组比较,柚皮苷低、中、高剂量组血清淀粉酶水平依次降低(P<0.05);柚皮苷高剂量组与阳性对照组血清淀粉酶水平无明显差异(P>0.05)。与假手术组比较,模型组血清TNF-α、IL-1β和IL-6水平显著升高(P<0.05);与模型组比较,柚皮苷低、中、高剂量组血清TNF-α、IL-1β和IL-6水平依次降低(P<0.05);柚皮苷高剂量组与阳性对照组比较,血清TNF-α、IL-1β和IL-6水平无显著差异(P>0.05)。
表1 各组大鼠血清淀粉酶及炎症因子水平比较(±s)

表1 各组大鼠血清淀粉酶及炎症因子水平比较(±s)
注:与假手术组比较,∗P<0.05;与模型组比较,◇P<0.05;与阳性对照组比较,△P<0.05;与柚皮苷低剂量组比较,#P<0.05;与柚皮苷中剂量组比较,□P<0.05。下同。
组别假手术组模型组阳性对照组柚皮苷低剂量组柚皮苷中剂量组柚皮苷高剂量组n 16 16 16 16 16 16血清淀粉酶(U/L)1 307.62±173.14 7 712.38±846.24*3 126.77±397.88◇6 072.84±703.52◇△4 542.77±521.19◇△#3 149.16±405.75◇#□TNF-α(pg/mL)19.15±2.17 57.12±6.52*26.17±3.05◇46.54±5.06◇△35.14±4.07◇△#26.25±3.13◇#□IL-1β(pg/mL)21.77±3.08 59.11±6.29*29.03±3.21◇47.42±5.17◇△38.52±4.94◇△#29.18±3.38◇#□IL-6(pg/mL)24.97±3.19 42.73±5.07*31.11±3.54◇39.05±4.57◇△35.92±3.91◇△#31.28±3.58◇#□
2.2 各组大鼠胰腺组织病理结构比较 见图1。假手术组大鼠胰腺组织细胞结构完整、未见异常。模型组大鼠胰腺组织细胞结构紊乱,边界模糊并伴有淋巴细胞浸润,部分区域有出血。柚皮苷和乌司他丁治疗后,病理改变较模型组缓解,其中阳性对照组和柚皮苷高剂量组最为明显。
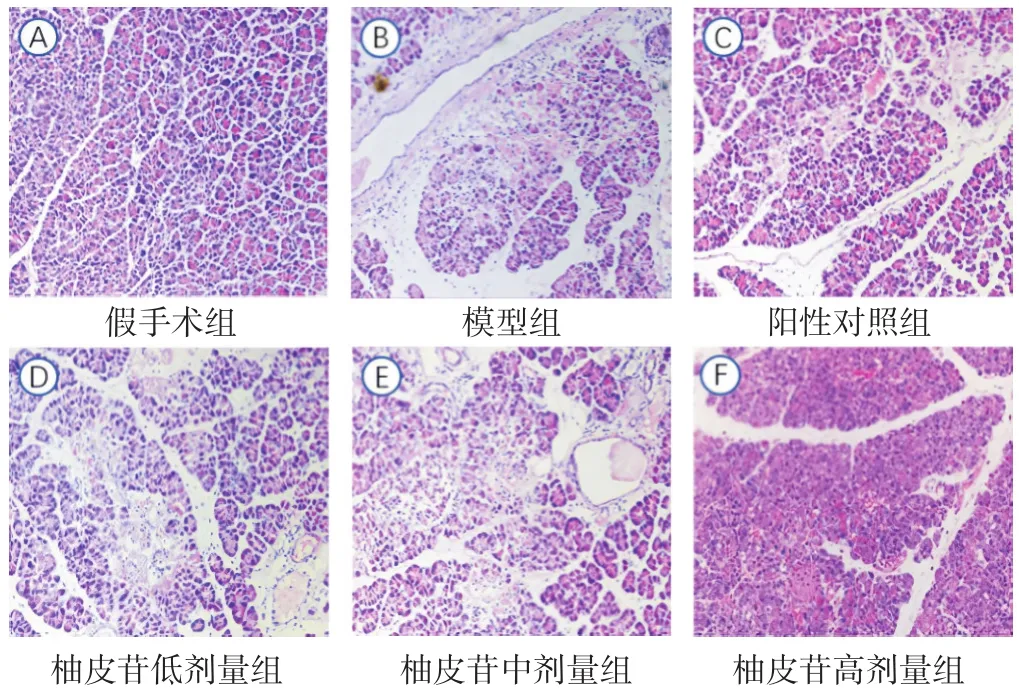
图1 各组大鼠胰腺组织病理图(HE染色,200倍)
2.3 各组大鼠胰腺组织Notch1、DSL和CSL蛋白表达水平比较 见表2,图2。与假手术组比较,模型组胰腺组织Notch1、DSL和CSL蛋白表达水平显著升高(P<0.05);与模型组比较,柚皮苷低、中、高剂量组胰腺组织Notch1、DSL和CSL蛋白表达水平依次降低(P<0.05);柚皮苷高剂量组与阳性对照组胰腺组织Notch1、DSL和CSL蛋白表达水平无显著差异(P>0.05)。
表2 各组大鼠胰腺组织Notch1、DSL和CSL蛋白表达水平比较(±s)
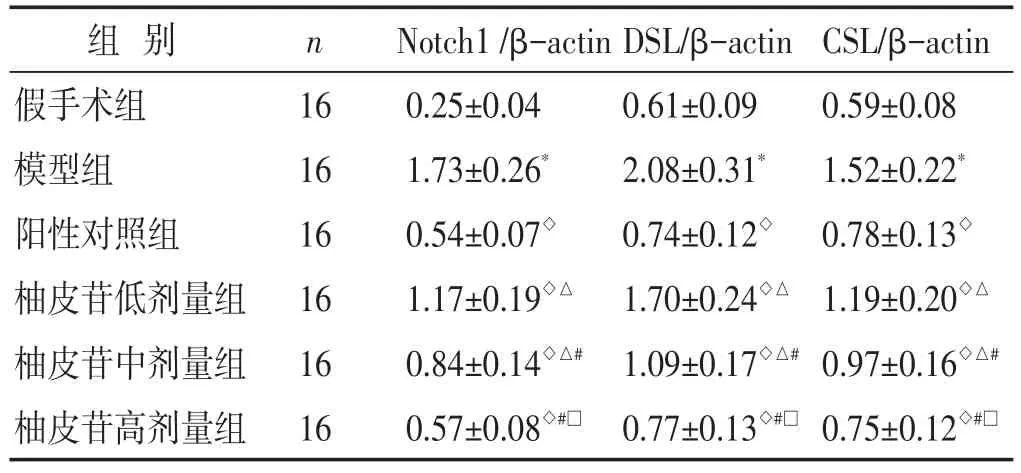
表2 各组大鼠胰腺组织Notch1、DSL和CSL蛋白表达水平比较(±s)
组别假手术组模型组阳性对照组柚皮苷低剂量组柚皮苷中剂量组柚皮苷高剂量组n 16 16 16 16 16 16 Notch1/β-actin 0.25±0.04 1.73±0.26*0.54±0.07◇1.17±0.19◇△0.84±0.14◇△#0.57±0.08◇#□DSL/β-actin 0.61±0.09 2.08±0.31*0.74±0.12◇1.70±0.24◇△1.09±0.17◇△#0.77±0.13◇#□CSL/β-actin 0.59±0.08 1.52±0.22*0.78±0.13◇1.19±0.20◇△0.97±0.16◇△#0.75±0.12◇#□
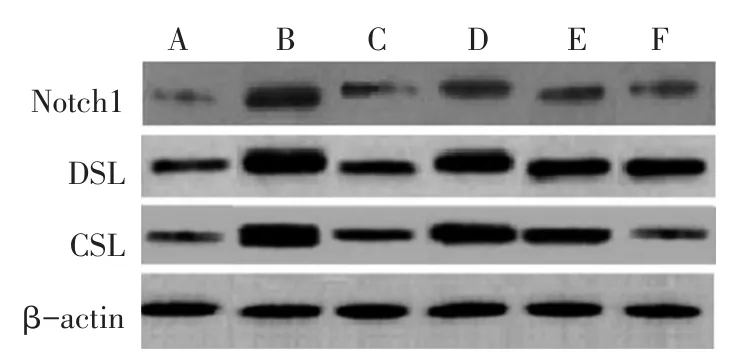
图2 各组大鼠胰腺组织Notch1、DSL和CSL蛋白印迹图
3 讨论
SAP可引起多器官功能发生障碍,当疾病进一步发展时,可导致器官功能发生衰竭,甚至死亡[13]。Agh⁃dassi等[14]研究显示,腺泡细胞蛋白酶的激活会对胰腺组织造成直接损伤,引起急性炎症反应。此外胰腺组织中的中性粒细胞多型体和巨噬细胞浸润胰腺,释放自身的蛋白酶、自由基和细胞因子,进一步激活胰腺外的中性粒细胞多型体和巨噬细胞,释放更多的炎症介质,导致全身炎症反应综合征和器官损伤[2]。因此,探索SAP发生后,保护胰腺免受过激的炎症反应引起的全身损伤,是本文致力研究的一个方向。本研究旨在探讨柚皮苷在SAP中的免疫调节作用,这可能对治疗SAP具有较高的价值。本研究在SAP大鼠模型中,观察到大鼠胰腺形态和功能的致命损伤,表现为胰腺组织细胞结构紊乱,边界模糊并伴有淋巴细胞浸润,部分区域有出血,血清淀粉酶显著上升;柚皮苷给药以后,发现柚皮苷各组以剂量依赖的方式逆转改变。表明柚皮苷可减轻机体免疫损伤引起的胰腺功能障碍。
已有研究证实,柚皮苷具有抗炎作用,一定剂量下的柚皮苷可显著减轻脂多糖诱导的HaCaT细胞炎症反应[15]。TNF-α、IL-1β和IL-6等炎症因子与胰腺的受损程度密切相关[16]。本研究发现,在SAP大鼠模型中,血清TNF-α、IL-1β和IL-6水平均显著增加,炎症因子的过表达导致机体发生自身免疫性损伤。柚皮苷给药后,血清TNF-α、IL-1β和IL-6水平均下调,且柚皮苷剂量越高,血清炎症因子水平越低。表明SAP可引起机体免疫损伤,柚皮苷可调节机体免疫系统,提高机体免疫力,降低过强炎症反应对机体的损伤。
目前已有研究证实Notch信号通路相关蛋白具有免疫调节作用,Notch1、DSL和CSL蛋白是关键的免疫调节蛋白,其表达量的改变与机体T、B淋巴细胞的发育密切相关,同时也可以影响相关炎症因子的分泌[17]。Notch信号通路与人类某些重要疾病(例如肝癌)的发病进程具有强烈的关联性[18]。鉴于它的重要性,目前靶向Notch信号的药物研发成为众多疾病治疗的研究热点。姚弘毅等[19]研究显示,羟基红花黄色素A能抑制Notch信号通路,从而降低骨性关节炎大鼠血清及滑膜中TNF-α、IL-1β、IL-6水平,减轻软骨损伤。本研究结果显示,SAP大鼠胰腺组织Notch1、DSL和CSL蛋白呈高表达,进行柚皮苷给药以后,柚皮苷呈剂量依赖性地抑制SAP大鼠胰腺组织Notch1、DSL和CSL蛋白的表达,这与降低免疫应激反应,减轻大鼠免疫损伤密切相关。
综上所述,柚皮苷对SAP大鼠具有一定的治疗作用,其机制可能是柚皮苷通过靶向Notch信号通路,抑制SAP大鼠胰腺组织Notch1、DSL和CSL蛋白的表达,降低机体炎症反应,减轻大鼠胰腺损伤,Notch可能成为临床上SAP治疗的潜在靶点。
