一种基于苯并噻唑的比色比率荧光探针识别检测HSO3-
2022-06-09王煜高文英
王煜,高文英
(山西大学 化学化工学院,山西 太原 030006)
0 引言
亚硫酸氢盐(HSO3−)作为主要的大气污染物SO2的衍生物,对人体健康及生态系统都有较大的影响[1-3]。研究表明,体内过量的亚硫酸氢盐会对组织和细胞造成不可逆的损伤,诱发呼吸道疾病、心脑血管疾病和多种神经系统疾病[4-7]。联合国粮食及农业组织和世界卫生组织共同提出人体内亚硫酸氢盐水平应低于0.7 mg/kg[8]。鉴于亚硫酸氢盐被广泛用作漂白剂,染料、造纸、皮革制造中的还原剂以及食品防腐剂和植物生长调节剂[9-12],开发有效的分析方法对食品和环境中HSO3−的检测至关重要。
在对亚硫酸氢盐的检测中,传统的电化学法[13-14]、高效液相色谱法[15]、毛细管电泳[16]、化学发光法[17]等方法存在操作复杂、灵敏度低以及费用较高等问题。相比之下,荧光探针因具有响应速度快、操作简单、灵敏度高、生物成像应用方便、可实时检测等优点[18-20]而受到广泛关注。近年来文献报道了不少基于配位作用[21]、对醛的亲核加成[22]、迈克尔加成[23-26]、乙酰丙酸酯分解[27-28]等反应机理的HSO3−荧光探针,但仍然存在探针结构复杂、水溶液中无法检测、响应时间长、灵敏度低以及无法实现实时生物成像等问题。因此,开发性能优良的荧光探针用于HSO3−的检测仍具有很大的发展空间。
本文以3-苄基-2甲基苯并噻唑溴化盐和3,4-二羟基苯甲醛为原料合成了荧光探针BDT,其中邻苯二酚基团和苯并噻唑盐通过C=C双键共轭连接成一个大的π-共轭体系,且具有分子内电荷转移(ICT)特性。带正电荷的苯并噻唑部分作为迈克尔加成的反应位点,还可以增加探针的水溶性。HSO3−与BDT发生加成反应,破坏了探针分子的π-共轭体系,阻断ICT过程,引起溶液颜色及荧光发射波长的显著改变,从而可实现在水体系中比色/比率检测HSO3−。探针BDT对HSO3−表现出高选择性、高灵敏度。此外,BDT对HeLa细胞中内源性和外源性HSO3−具有良好的荧光成像能力。
1 实验部分
1.1 仪器与试剂
紫外可见分光光度计(UV-2450,岛津,日本);荧光分光光度计(F-4600,日立,日本),激发波长分别为300 nm和533 nm,Ex/Em狭缝宽度为10 nm;核磁共振仪(AVANCEIIIHD-600,Bruker,德 国 );高 分 辨 质 谱 仪(Bruker mi⁃crOTOF-Q III);酸度计(pH-FE20,梅特勒-托利多,上海精密仪器公司);共聚焦显微镜(Zeiss LSM-880,德国)。
2-甲基苯并咪唑、3,4-二羟基苯甲醛(98%,上海阿拉丁生化科技有限公司),溴化苄(98%,上海麦克林生化科技有限公司),实验用水为二次蒸馏水。所用其他试剂均为分析纯。
1.2 探针BDT的合成及结构表征
探针BDT的合成路线如图1所示。3-苄基-2甲基苯并噻唑溴化盐按照文献[29]报道方法合成。将 0.5 mmol(0.16 g)3-苄基-2甲基苯并噻唑溴化盐与 0.5 mmol(0.069 g)3,4-二羟基苯甲醛溶于7 mL乙醇中,固体充分溶解后加入2滴哌啶,在N2保护下加热回流10 h,反应结束后,冷却至室温并放入冰箱冷冻24 h,抽滤得到红褐色固体产物(BDT)。1H NMR(600 MHz,DMSO-d6)δ(ppm):10.445 7(1H,s),9.381 4(1H,s),7.473 2(1H,s),8.109 7(1H,d),6.889 8(1H,d),7.881 2(1H,d),8.164 5(1H,d),7.779 6(1H,t),7.731 8(1H,t),8.421 1(1H,d),6.224 9(2H,s),7.395 5(6H,m)。13C NMR(600 MHz,DMSO-d6):173.38,152.16, 151.63, 146.53, 141.71, 134.52,129.85, 129.61, 128.89, 128.58, 128.19,127.30, 126.37, 125.41, 124.87, 117.09,116.94,116.48,109.85,56.48,51.51,19.03。HRMS(ESI):calcd.for C22H18NO2S+(M-Br−)360.105 3,found 360.104 6。
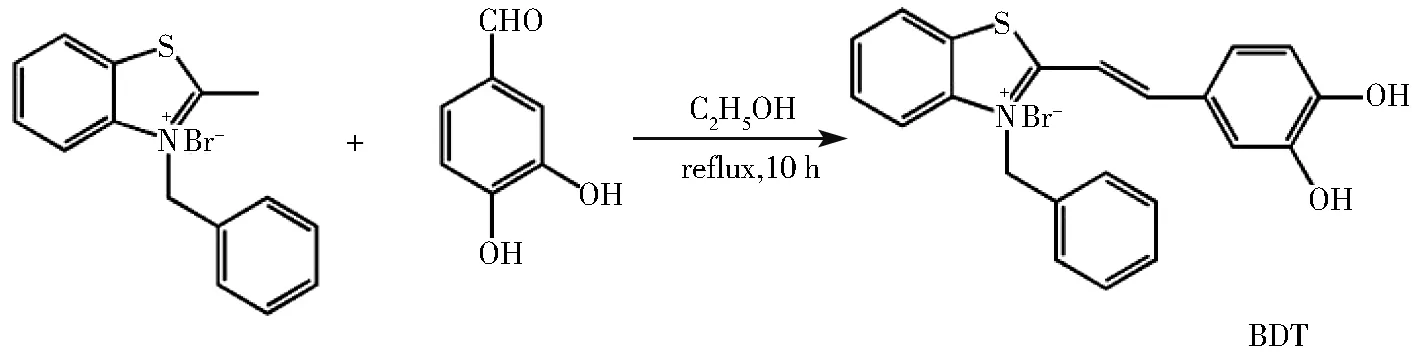
图1 BDT的合成路线图Fig.1 Synthesis of BDT
1.3 光谱研究方法
探针 BDT(1×10−3mol·L−1)和阴离子储备液(1×10−2mol·L−1)分别用DMSO和二次蒸馏水配制。在比色管中加入一定量的探针储备液和一定量的阴离子储备液,而后加入100 μL HEPES缓冲溶液(pH=7.4),使用二次蒸馏水定容至5 mL,混合均匀,进行相应的紫外或荧光光谱测定。紫外及荧光测定中探针的浓度分别为 20 μmol·L−1及 8 μmol·L−1。
1.4 实际样品中HSO3−的检测
白糖、白酒均购自山西大学文瀛超市,于比色管中分别加入0.5 g白糖和100 μL白酒,用二次蒸馏水定容至5 mL作为待测溶液,加入探针 BDT(8 μmol·L−1)后测定荧光发射光谱,并采用标准加入回收法进行实验。
1.5 细胞成像
将HeLa细胞在37℃,含5% CO2的环境中用 10%(V/V)胎 牛 血 清(FBS,Gibco)的DMEM培养基培养。在成像实验中,首先将细胞与 BDT(10 μmol·L−1)在细胞培养基中孵育20 min,然后用磷酸盐缓冲溶液(PBS)冲洗3次,以消除未进入细胞的探针BDT。在共聚焦显微镜下成像。之后,继续加入HSO3−(20 μmol·L−1)共同孵育,PBS 冲洗 3 次后,使用63倍物镜进行细胞成像。在内源性HSO3−的检测实验中,两组HeLa细胞分别用BDT和BDT+Cys共同孵育30 min,用PBS洗涤3次后进行成像。激发波长为405 nm和488 nm,发射光谱波长范围分别为410 nm~481 nm和500 nm~601 nm。
2 结果与讨论
2.1 HSO3−对BDT紫外吸收光谱的影响
BDT的光谱测试在H2O体系(25 mmol·L−1HEPES缓冲溶液,pH 7.4)中进行。图 2(a)为BDT在水体系中加入HSO3−前后紫外吸收光谱的变化。BDT本身在534 nm处有较强的吸收,该吸收峰由邻苯二酚基团到苯并噻唑盐的ICT过程产生。随着HSO3−的逐量加入,由于二者发生亲核加成反应后,阻碍了分子的π-π共轭及ICT效应,使534 nm处的吸收强度逐渐减弱,279 nm处的吸收强度逐渐增加,且在305 nm处出现了一个等吸收点,表明反应中形成了新的稳定化合物。同时,溶液的颜色由紫红色变为无色。图2(b)表明,吸光度比A534nm/A279nm与HSO3−浓度在0~1×10−5mol·L−1范围内线性关系良好,可用于对HSO3−浓度的定量检测。
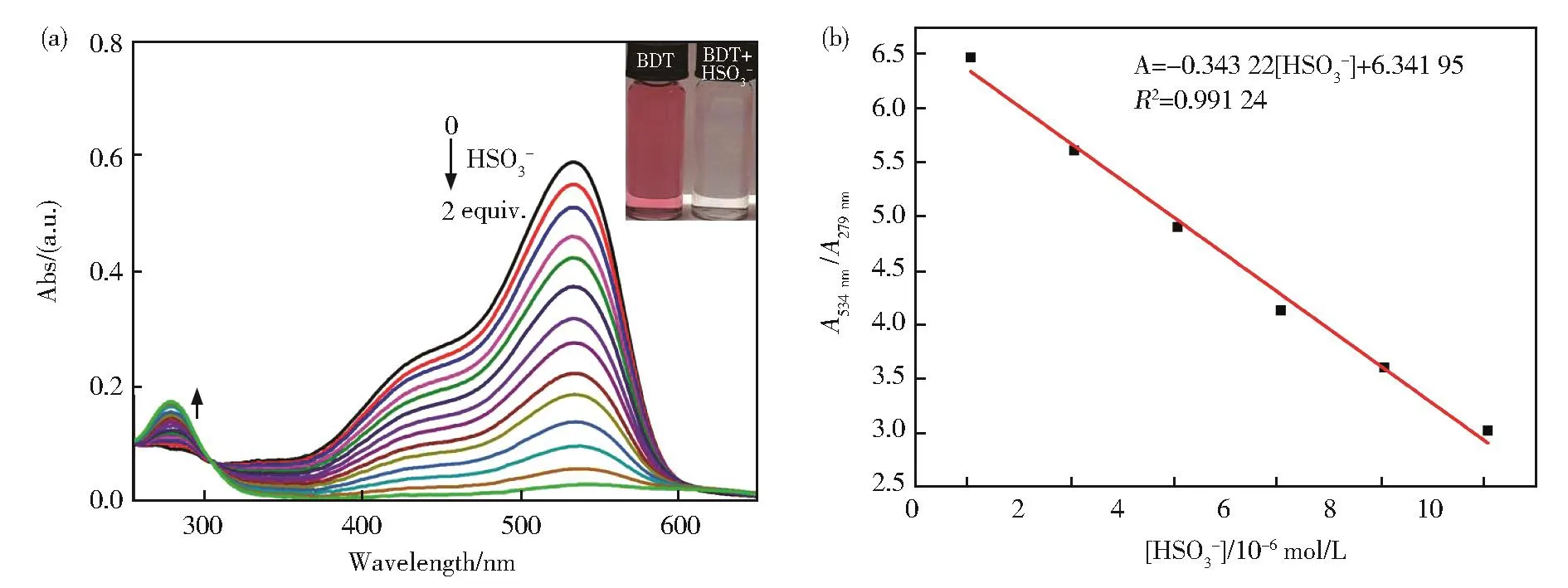
图2 (a)不同浓度HSO3−(0~2 equiv)存在下BDT(2×10−5mol·L−1)的紫外吸收光谱。插图:日光灯下BDT溶液的颜色变化;(b)BDT的吸光度比A534 nm/A279 nm随[HSO3−]的变化Fig.2 (a)Uv-vis absorption spectra of BDT(2×10−5mol·L−1)with the incremental concentration of HSO3− (0-2 equiv.).Inset:The color change of BDT solution under daylight;(b)Curve of absorbance ratio(A534 nm/A279 nm)vs[HSO3−]
图 3(a)为常见阴离子(F−,Cl−,Br−,I−,HSO4−,SO42−,AcO−,NO3−,H2PO4−,HSO3−,CN−,S2−,HCO3−,CO32−,ClO−,H2O2,C2O42−,S2O32−,Cys,Hcy,GSH)与 BDT 作用后紫外吸收光谱的变化情况,结果显示,只有HSO3−能够使BDT的吸收光谱和溶液颜色发生显著变化。此外,共存离子不会对BDT-HSO3−的吸光度值造成影响(图3(b))。表明BDT对HSO3−具有高选择性识别能力,可用于对HSO3-的可视化识别检测。
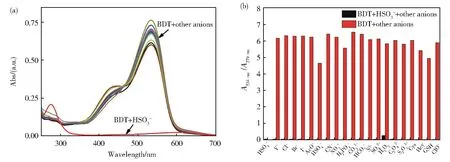
图3 (a)不同阴离子(1×10−4mol·L−1)对探针BDT(2×10−5mol·L−1)紫外吸收光谱的影响;(b)在HSO3− 存在下添加干扰离子后,BDT(2×10−5mol·L−1)的吸光度比(A534 nm/A279 nm)Fig.3 (a)Uv-vis absorption spectra of BDT(2×10−5mol·L−1)after addition of various anions(1×10−4mol·L−1);(b)The absorbance ratio(A534 nm/A279 nm)of BDT(2×10−5mol·L−1)after adding interfering ions in the presence of HSO3−
2.2 HSO3−对BDT荧光光谱的影响
通过荧光发射光谱考察了探针与HSO3−的相互作用。如图4所示,分别以300 nm和533 nm作为激发波长,探针BDT的荧光光谱在337 nm和590 nm处呈现发射峰。随着HSO3−浓度的增加,337 nm处的荧光强度逐渐增强,而590 nm处的荧光强度逐渐降低,显示出良好的比率检测性能。图 4(c)显示,在 0~1.2×10−5mol·L−1范围内,BDT检测HSO3−显示出良好的线性关系,根据方程3σ/S,计算得到检出限为2.86×10−7mol·L−1,低于我国食品添加剂使用卫生标准规定的食品中HSO3−的最大允许值(1.56×10−3mol·L−1)[30]。此外,对浓度为 4×10−5mol·L-1的 HSO3−进行 6次平行测定,计算得到相对标准偏差(RSD)为1.94%,表明探针BDT对HSO3−的荧光响应重复性和精密度良好。
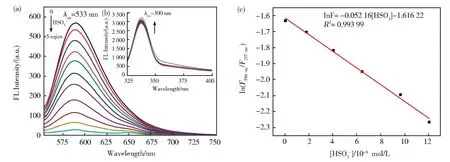
图4 BDT荧光光谱随HSO3−浓度的变化,(a)λex=533 nm;(b)λex=300 nm;(c)校准曲线Fig.4 Change in fluorescence spectrum of BDT with HSO3− concentration,(a)λex=533 nm;(b)λex=300 nm;(c)Calibration curve
实验进一步考察了BDT对HSO3−的选择性及抗干扰能力。如图5(a)所示,除HSO3−外,其他阴离子均不能使探针BDT在590 nm处的荧光强度降低。此外,共存离子(4×10−5mol·L−1)的加入并不会对 BDT 检测 HSO3−的荧光响应产生影响(图5(b))。以上结果表明,探针BDT在水体系中能够对HSO3−进行特异性识别检测,是一种在复杂环境中具有潜在应用价值的HSO3−荧光探针。
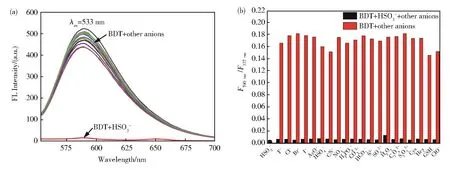
图5 (a)不同阴离子(4×10−5mol·L−1)对探针BDT(8×10−6mol·L−1)荧光光谱的影响;(b)在HSO3−存在下添加干扰离子(4×10−5mol·L−1)后,BDT(8×10−5mol·L−1)的荧光强度比(F590 nm/F337 nm)Fig.5 (a)Fluorescence spectra of BDT(8×10−6mol·L−1)after addition of various anions(4×10−5mol·L−1);(b)the fluorescence intensity ratio(F590 nm/F337 nm)of BDT(8×10−5mol·L−1)after adding interfering ions(4×10−5mol·L−1)in the presence of HSO3−
为了探究探针BDT检测HSO3−的实用性,考察了pH对BDT及BDT-HSO3−荧光光谱的影响。如图6(a)所示,当pH为7~8时,BDT对HSO3−有较好的光谱响应,因此选择pH 7.4进行光谱测试。随后,探究了BDT-HSO3−荧光强度随反应时间的变化情况(图6(b)),可以发现,HSO3−的加入使BDT在590 nm处的荧光强度迅速降低,180 s达到平衡。上述结果表明,探针BDT能够实现在生理pH值下快速检测HSO3−。

图6 (a)pH对BDT和BDT-HSO3− 处荧光强度的影响;(b)BDT-HSO3−荧光强度随时间的变化。([BDT]=8×10−6 mol·L−1,[HSO3−]=4×10−5mol·L−1)Fig.6 (a)Effect of pH on the fluorescence intensity of BDT and BDT+HSO3−;(b)Time dependent fluorescence intensity of BDT-HSO3−.([BDT]=8×10−6mol·L−1,[HSO3-]=4×10−5mol·L−1)
2.3 响应机理
为了考察响应机理,利用等摩尔连续变化法测得BDT与HSO3−以1∶1化学计量比相互作用(图7)。高分辨质谱中m/z440.062 62[计算值,m/z440.070 46]的峰对应于[BDT+HSO3--H],进一步证明BDT与HSO3-形成1∶1的加成产物(图8)。

图7 BDT-HSO3− 的结合比测定,([BDT]+[HSO3−]=20 μmol/L)Fig.7 Determination of BDT-HSO3− binding ratio,([BDT]+[HSO3−]=20 μmol/L)

图8 在CH3CN中BDT加入HSO3−后的质谱图Fig.8 Mass spectrum after adding HSO3−to BDT in CH3CN
以d6-DMSO为溶剂,通过1H NMR进一步研究了BDT与HSO3−的反应模式(图9)。加入 HSO3−后 ,乙 烯 基 质 子 Hb(8.19)和 Hc(7.88)的质子峰信号分别向高场方向移动至4.98和4.81,此外,噻唑N原子邻位的亚甲基Ha从6.23移动至4.05。这些结果表明,探针BDT与HSO3−在不饱和C=C双键处进行作用,使整个分子的共轭程度降低,ICT效应受阻,参与电子离域的质子周围电荷密度增大,进而导致质子向高场方向移动。因此,我们推测HSO3−与BDT以1,4-加成的方式发生迈克尔加成反应。
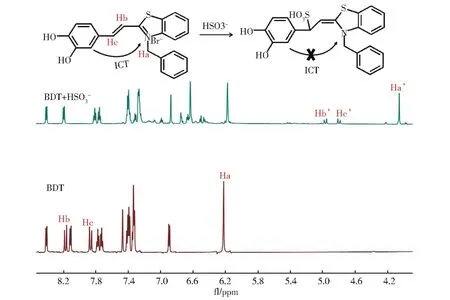
图9 d6-DMSO中BDT和BDT+HSO3−的1H NMR谱及其传感机理Fig.9 1H NMR spectra of BDT and BDT+HSO3−in d6-DMSO and the sensing mechanism
2.4 实际样品检测
HSO3−是一种重要的食品添加剂,已广泛应用于食品工业,但食品中过量的HSO3−可能会导致一些健康问题。为了评估探针BDT对实际样品中HSO3−的检测能力,将BDT应用于白糖和白酒中3个浓度水平的加标回收实验,每个浓度水平平行测定6次后取平均值,通过标准曲线计算得到该实验的回收率,结果如表1所示,白糖和白酒中HSO3−的回收率在90.6%~107.5%之间,精确度良好。说明探针BDT在实际样品检测中具有可靠的应用价值。
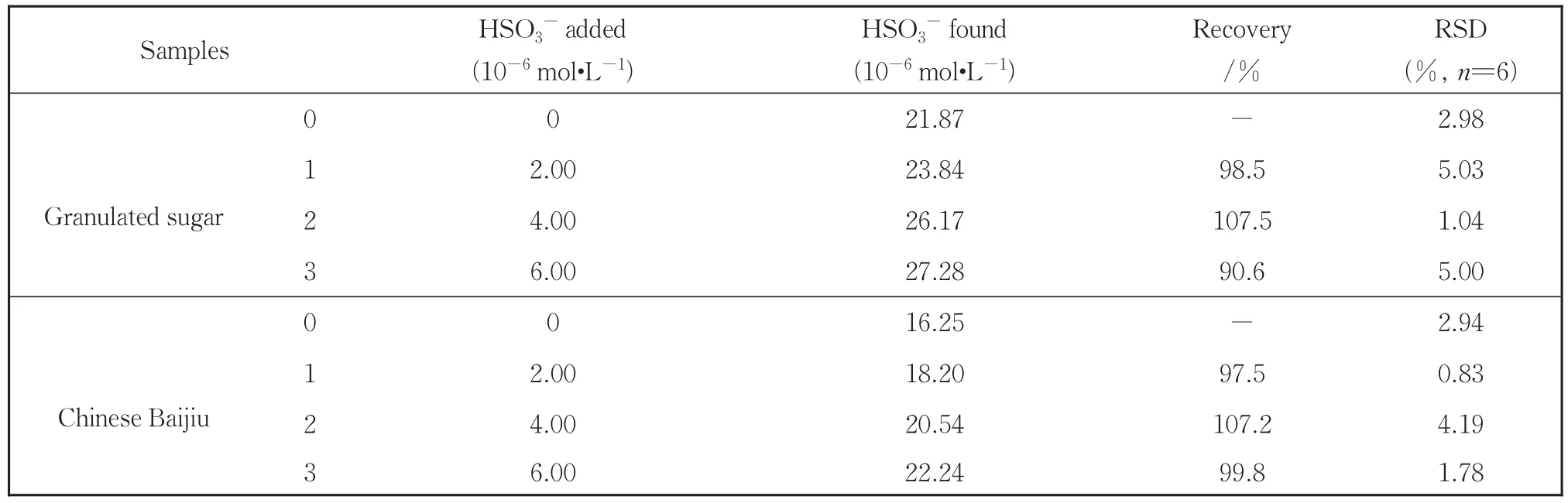
表1 探针BDT对食品样品中HSO3−浓度的测定结果Table 1 Determination of HSO3−in food samples using BDT probe
2.5 细胞荧光成像
采用MTT法检测了探针的细胞毒性。如图10所示,HeLa细胞与不同浓度的BDT溶液(0~30 μmol·L−1)共同孵育 12 h,细胞存活率大于90%,表明探针BDT具有良好的生物相容性和低细胞毒性。
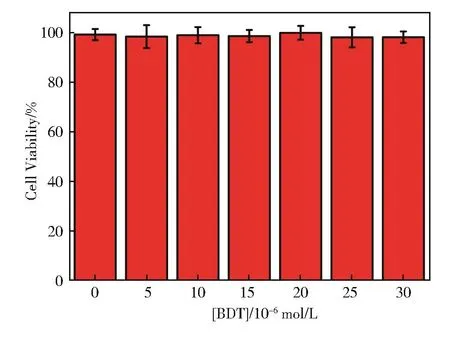
图10 BDT对HeLa细胞的细胞毒性Fig.10 Cytotoxicity of BDT to HeLa cells
为了进一步研究探针BDT在生物体内的潜在应用能力,首先对HeLa细胞中的HSO3−进行了体外荧光成像实验。如图11所示,将探针BDT(10 μmol·L−1)与 HeLa 细 胞 共 同 孵 育 20 min 后,加入 20 μmol·L−1HSO3−继续孵育,随着孵育时间的增加,橙色通道中荧光信号减弱,而蓝色通道中荧光信号逐渐增强,这与该探针在溶液中的光学行为表现一致。且在此过程中,细胞形态较好,表明探针BDT能够检测活细胞中的外源性HSO3−。

图11 探针BDT与HSO3−共同孵育的共聚焦图像Fig.11 Confocal images of BDT(10 μmol·L−1)treated with HSO3−(20 μmol·L−1)in HeLa cells
随后,我们对HeLa细胞中内源性HSO3−的检测进行了评估,使用Cys作为刺激产生SO2的兴奋剂,如图 12 所示,HeLa细胞与 10 μmol·L−1探针共同孵育时只能观察到橙色通道荧光信号,而加入 250 μmol·L−1Cys后,蓝色通道出现荧光信号,橙色通道荧光减弱。表明Cys刺激产生的SO2与探针BDT产生作用。以上结果表明,探针BDT具有良好的细胞膜通透性,在活细胞中监测内源性以及外源性HSO3−均具有良好的应用潜力。
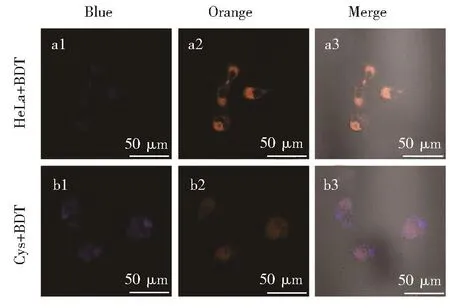
图12 HeLa细胞的共聚焦图像,(a)用10 μmol·L−1BDT孵育;(b)用10 μmol·L−1BDT和250 μmol·L−1Cys共同孵育Fig.12 Confocal images of HeLa cells,(a)incubated with 10 μmol·L−1BDT;(b)incubated with 10 μmol·L−1BDT and 250 μmol·L−1Cys
3 结论
本文以苯并噻唑为荧光团,设计合成了一种比率检测HSO3−的荧光探针BDT。在接近100%的水体系中,探针BDT与HSO3−发生迈克尔加成反应,引起荧光光谱及溶液颜色的显著变化,实现了对HSO3−的荧光传感及裸眼识别。在实际应用中,探针BDT能够有效检测食品样品白糖和白酒中HSO3−的含量,并可用于对活体细胞中HSO3−的荧光成像。因此,该探针在传感、生物样品信号传导及检测方面均具有良好的应用前景。
