湿地水葱根际、根内细菌群落结构及其驱动因素
2022-06-09柴宝峰刘珊珊刘晋仙吴铁航
柴宝峰,刘珊珊,刘晋仙,吴铁航
(1.山西大学 黄土高原研究所 黄土高原生态恢复山西省重点实验室,山西 太原 030006;2.美国佐治亚州南部大学 生物系,佐治亚州 斯泰茨伯勒,30460)
0 引言
与植物相关的微生物群落对于宿主营养获取、发育、免疫活性和抗逆性具有重要作用[1]。在长期的进化过程中,植物通过自身的基因组塑造了其特异的微生物群落结构,其中与植物功能适应性相关的核心菌群称为植物微生物组(plant-associated microbiome)[2]。微生物通过缓解生物和非生物环境胁迫,有利于植物对环境的适应性,影响植物群落的生态功能。根际微生物可以帮助植物获取营养、产生生长激素和防御病原微生物攻击[3-4]。植物和微生物间的互惠关系、植物微生物组的结构和多样性并非随机形成。根系微生物组的构建过程受到宿主和环境因素的影响[5]。研究表明,植物的根际微生物(rhizosphere microbes)和根内微生物(en⁃dophytic microbes)均来自于土壤微生物库[6-7]。植物在不同的发育阶段以及各种环境因子的驱动下,通过根系分泌物组成变化和免疫反应等,筛选和控制根际和根内微生物群落的组成和多样性[8]。“根区理论”认为植物根系通过氧气传递,在根系周围形成好氧、缺氧和厌氧区域,塑造了具有硝化和反硝化功能的微生物群落,是湿地氮污染去除的重要机理[9]。关于植物根际微生物群落结构和功能已有较多的研究,认为根际分泌物、土壤物理和化学性质驱动了根际微生物群落的结构和多样性[10],而植物内生微生物群落的构建机制较为复杂,根内微生物群落并非由根际土壤微生物随机扩散形成。Bulgarelli等[11]提出根内微生物群落形成的“两步法”选择模型,认为根际土壤多种因子决定土壤微生物群落结构的第一步选择,第二步则依赖于宿主基因型的趋同选择作用。关于植物微生物组的构建机制是微生物生态学的重要问题,尤其是环境因子和基因组决定的植物属性对于植物微生物组构建的相对贡献,是植物微生物组学研究的关注点。
本研究选择湿地水生植物水葱(Scirpus vali⁃dus)为研究对象,测定不同污染梯度下水葱根际和根内细菌群落的结构和多样性,通过分析其与环境因子的关联性,试图回答以下问题:(1)水葱根际和根内微生物组多样性和结构的差异性;(2)水葱根际和根内微生物组构建的驱动因素。研究结果以期为人工湿地植物选择,构建高效的污染物去除系统提供数据支持。
1 材料与方法
1.1 研究区概况与样地设置
研究区位于山西省太原市清徐县汾河二坝桥附近湿地(112°23΄E,37°36΄N)。该湿地经过人工改造,全长3 000 m左右。种植有水葱、菖蒲(Acorus calamus)、芦苇(Phragmites australis)、睡莲(Nymphaea tetragona)等水生植物。水体中以颤藻-席藻群落为主,优势种为小席藻(Phormi⁃dium tenue)、窝型席藻(P.fovcolarum)、弱细颤藻(Oscillatoria tenui)、两栖颤藻(O.anphibian)。在湿地污水入口处(EC)、湿地中部(MD)和出口(ET)处设置3个样地,采用5点取样法,选取长势相似的水葱进行根际土采集。
1.2 样品的采集和处理
用铁锹将水葱根系及底泥铲起,整体放入无菌塑料袋中,置于车载冰箱运回实验室。先抖落水葱根系周围的松土,用无菌刷子刷取附在根表面1 cm左右的土壤。收集的根际土分为两部分:一部分在实验室自然风干,测定土壤理化性质;另一部分土样用于Illumina高通量测序。去除根际土后,对根表进行灭菌。首先用无菌水洗涤,使根表不再粘附土壤;接着用70%的乙醇浸泡2 min,用 2.5% NaClO(含0.1%吐温80)浸泡5 min,用70%无水乙醇浸泡30 s,最后用无菌水洗涤3次,放入10 mL离心管中备用。
1.3 土壤理化性质测定
土壤样品经自然风干,过100目筛选后,测定土壤的酸碱度、总氮、总碳、总硫、铵根离子、硝酸根离子。土壤pH的测定使用pH计(HAN⁃NA HI3221),称取水葱根际土10 g,土样与水样比例为1∶2.5,放入50 mL离心管中摇匀。摇床震荡30 min,取出后静置,取上清液测量。用元素分析仪(Elementar Vario MACRO,德国)测定根际土总氮(TN)、总碳(TC)、总硫(TS)。铵态氮(NH4+‒N)、硝态氮(NO3-‒N)采用间断化学分析仪(CleverChem 380,德国)测定。
1.4 DNA提取及Miseq高通量测序
称取0.5 g土壤样品,使用E.Z.N.A.®土壤DNA试剂盒(Omega Bio-tek,USA),按照试剂盒使用说明书步骤提取和纯化土壤微生物DNA。每个采样点3个重复,共9个DNA样品,送上海美吉生物医药科技有限公司进行高通量测序。采用338F(ACTCCTACGGGAG⁃GCAGCAG) 和 806R(GGACTACHVGGGT⁃WTCTAAT)引物对细菌16S rRNA基因的V3~V4高可变区进行PCR扩增,扩增体系总体积为 20 μL,包括 5 μmol·L-1正反引物 0.8 μL,5×FastPfu Buffer 4 μL,2.5 mmol·L-1dNTPs 2 μL,FastPfu Polymerase 0.4 μL,0.2 μL 的 BSA,10 ng DNA模板。通过Illumina Miseq测序平台对扩增产物进行测序。
1.5 生物信息学分析
原始序列经过质控后,剔除嵌合序列,使用UPARSE以97%的相似性作为阈值划分分类操作单元(operational taxonomic units,OTUs)。细菌测序数据与Greengenes数据库进行比对,设置比对阈值为70%。去除样品中丰度小于0.001%的OTU。所获得的序列按最小样本序列数抽平,用于下游分析。细菌16S rRNA基因的原始测序序列保存在NCBI数据库中。
1.6 数据分析
运 用 Mothur(Version v.1.30)软 件 分 析OTU水平的细菌群落的Sobs指数、Shannon多样性指数、Simpson指数、ChaoI指数、ACE指数。采用方差膨胀因子(VIF)分析,先行筛选共线性较小的环境因子。运用PCoA(principal component analysis)分析不同污染梯度细菌群落组成的差异性。使用db-RDA(distance based re⁃dundancy analysis)在门水平分析环境因子、对细菌群落的影响。使用Gephi 0.9.2分析不同污染梯度下水葱根际、根内细菌的共现性网络。使用SPSS对水葱根际土壤的理化性质pH、TN、TC、TS、NH4+-N、NO3--N进行单因素方差分析,检验不同污染梯度下理化性质的差异性,统计分析的置信区间为95%。
2 结果
2.1 土壤环境因子分析
3个样地(EC、MD、ET)的土壤理化性质具有不同程度的差异(表1)。从湿地入口(EC)到出口处(ET),pH 显著降低(P<0.05),由8.52降为7.52;氮污染程度显著减弱(P<0.05),NO3--N浓度由0.033 mg/kg降为0.022 mg/kg,TN浓度由0.041 mg/kg降为0.029 mg/kg,而NH4+-N下降趋势不显著(P>0.05);TC含量由1.68%下降为1.09%,TS含量由0.15%下降为0.11%。说明该湿地可有效去除水体中的氮污染和有机污染物,对水质具有显著的改善作用。而土壤理化性质的变化,对植物和微生物群落可能产生相应的影响。
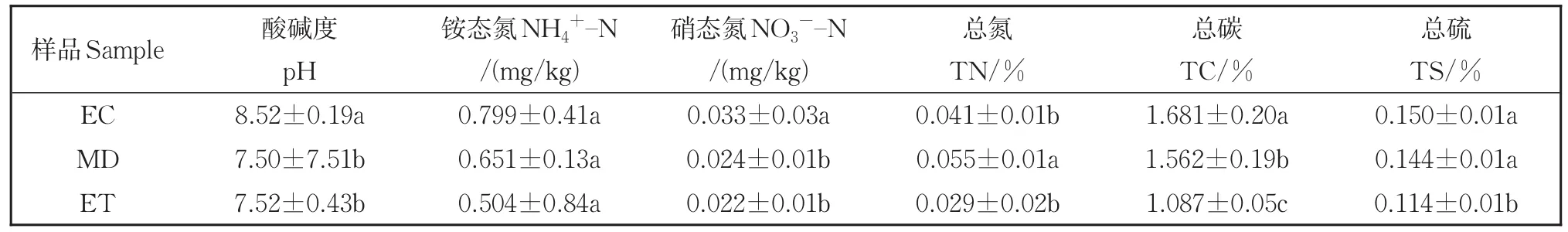
表1 不同取样点水葱根际土壤理化性质Table 1 Physicochemical properties of rhizosphere soil of Scallion at different sampling points
2.2 水葱根际、根内细菌群落多样性
对湿地3个样地内生长的水葱根际和根内细菌群落多样性进行分析。结果如表2所示,从湿地的入口到出口处,根际细菌的Sobs指数显著下降(P<0.05),由 1 303.33降为 868.56,说明根际细菌群落内物种分布的均匀度显著增加(P<0.05),同时Shannon-Weiner指数也显著降低(P<0.05),由5.49降为3.34.说明根际细菌群落的丰富度下降。Simpson指数在中部最低(0.008)、ACE指数和Chao指数在中部最高,分别为2 193.78和2 148.91。但水葱根内细菌群落的多样性在3个样点间差异不显著,说明根内细菌群落的多样性受土壤理化因子的影响不明显。根际和根内细菌群落多样性指数的差异不显著(P>0.05),根内的Shannon-Weiner指数(5.423)略高于根际(4.985)。
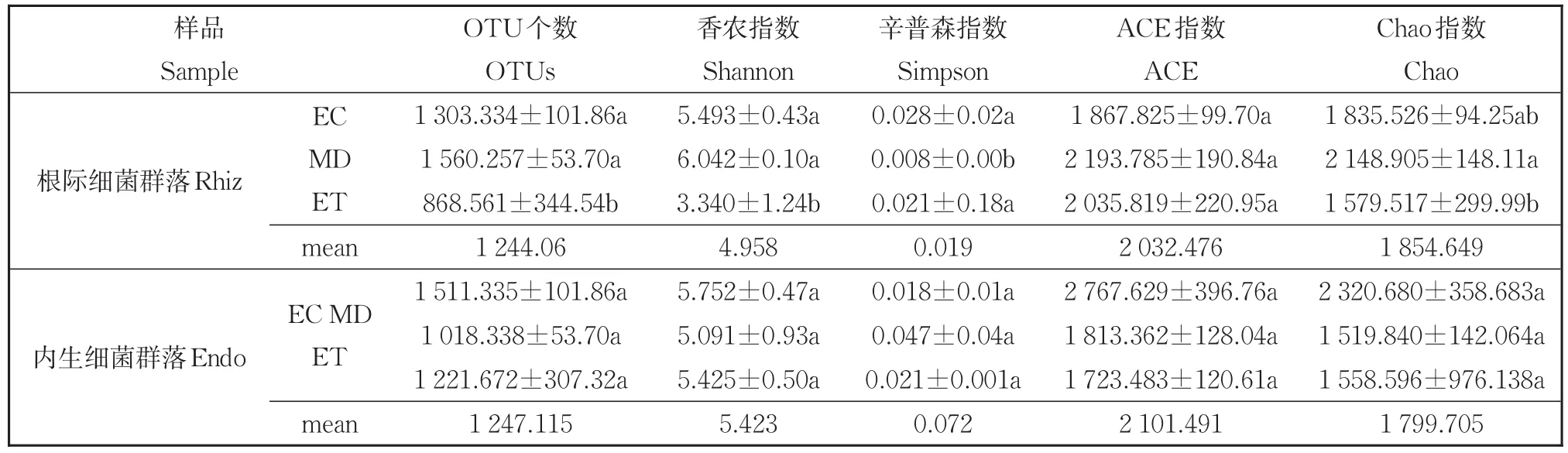
表2 不同污染梯度下根际和根内细菌群落α多样性Table 2 α diversity of rhizosphere and endophytic bacterial communities with pollution gradients
2.3 湿地水葱根际、根内细菌组成
高通量测序的OTU注释结果如图1所示,研究样地水葱根际和根内细菌群落共有52个门、150个纲、341个目、565个科、1 053个属。水葱根际、根内细菌在门的种类组成上具有一定的相似性。丰度大于1%的细菌优势门在根际有 11个(图 1(a)),分别为厚壁菌门(Fir⁃micutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、脱 硫 杆 菌 门(Desulfobacte⁃rota)、绿弯菌门(Chloroflexi)、拟杆菌门(Bacte⁃roidota)、酸杆菌门(Acidobacteriota)、芽单胞菌门(Gemmatimonadota)、疣微菌门(Verrucomicro⁃biota)、黏细菌门(Myxococcota)、纤维杆菌门(Fibrobacterota)。不同取样点根际细菌门的丰度差异显著,变形菌门、放线菌门、脱硫杆菌门的丰度在入口处最高,分别为29.58%、40.71%、6.01%,出口处最低,分别为16.39%、7.58%、2.39%;而丰度最大的厚壁菌门则呈现相反的趋势,入口处和出口处的丰度分别为9.68%和66.05%。可见,环境因子对于根际细菌群落的组成、结构具有较大的影响。水葱根内丰度大于1%的细菌优势门有14个(图1(b)),依次为变形菌门、放线菌门、厚壁菌门、脱硫杆菌门、拟杆菌门、绿弯菌门、硝化螺旋菌门(Nitrospirota)、MBNT15、酸杆菌门、疣微菌门、黏细菌门、Sva0485、芽单胞菌门、梭杆菌门(Fusobacteriota)等。不同取样点根内细菌门的丰度差异不显著,说明环境因子对根内细菌的组成结构影响不显著。除了在丰度上的差异外,在门水平水葱根际和根内细菌群落组成有4个门不同,差异性达30.77%。
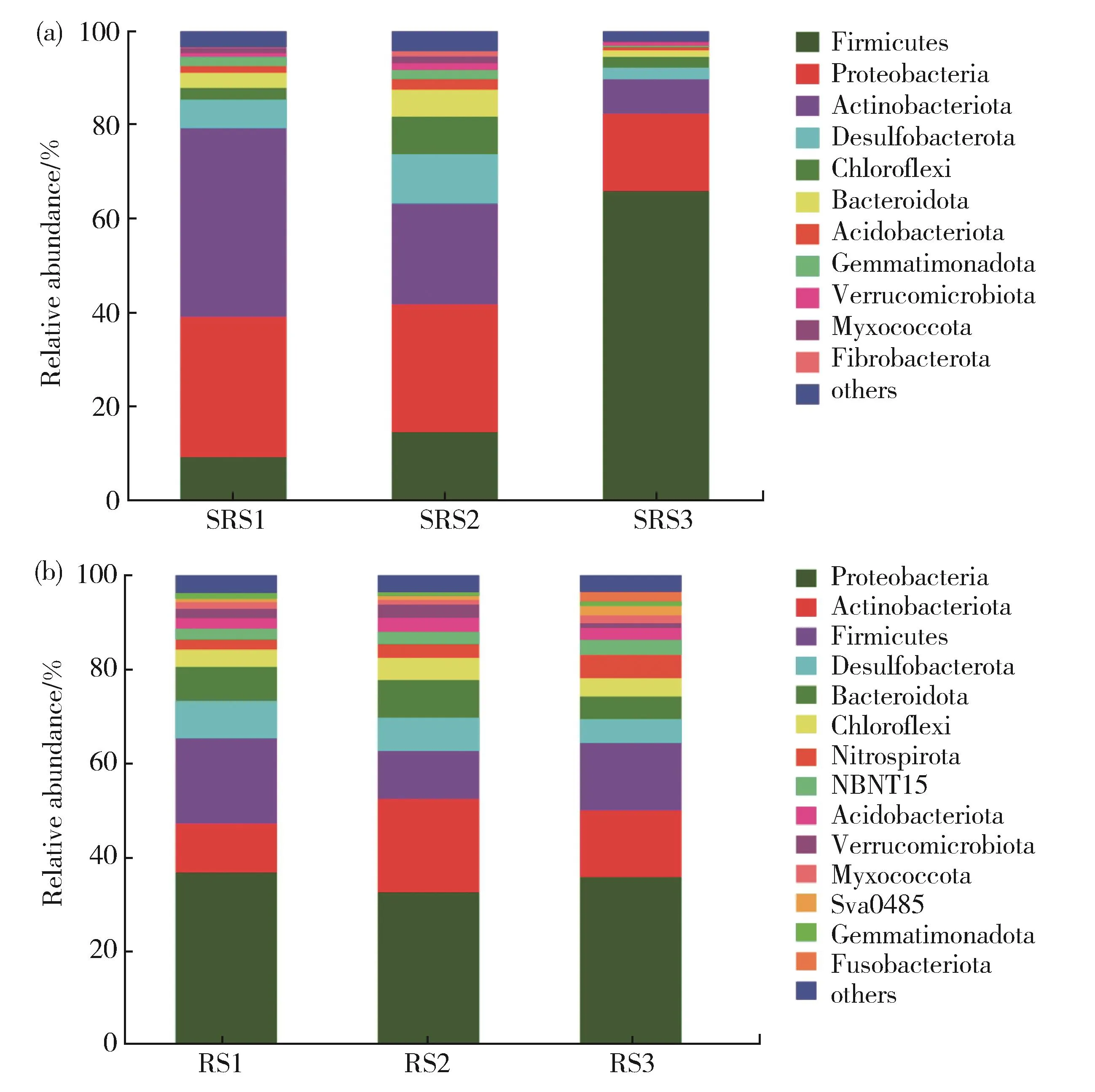
图1 不同污染梯度根际(a)、根内(b)细菌门水平的组成Fig.1 Composition of rhizosphere(a)and endophytic(b)bacterial phylum at different sampling points
水葱根际细菌群落在属水平的组成丰度大于1%的细菌属有12个(图2(a)),从大到小分别为微小杆菌属(Exiguobacterium)、假节杆菌属(Pseudarthrobacter)、类诺卡氏属(Nocardioi⁃des)、芽 孢 杆 菌 属(Bacillus)、毛 球 菌 属(Trichococcus)、芽孢八叠球菌(Paenisporosarci⁃na)、鞘 氨 醇 单 胞 菌 属(Sphingomonas)、Norank_Steroidobacteraceae、Unclssified_Desulfo⁃capsaceae、游球菌(Planococcus)、节杆菌属(Ar⁃throbacter)、Unclassified_Intrasporangiaceae。 水葱根内细菌群落在属水平上丰度大于1%的细菌属有13个(图2(b)),从大到小依次为微小杆菌属、红球菌属(Rhodococcus)、硫杆菌属(Thiobacillus)、芽孢杆菌属、Norank_Steroido⁃bacteraceae、Norank_f_norank_o_norank_c_norank_P_MB、NT15norank_f_norank_o_SJA-15、El⁃lin6067、norank_f_norank_o_norank_c_4-29-1、norank_f_SC-I-84、norank_f_Rhizobiales_incer⁃tae_sedis、norank_f_norank_o_norank_c_Sva0485、Hypnocyclicus。水葱根际和根内细菌群落的组成在属水平的差异显著,有3个共有属,差异性达76.92%。

图2 不同污染梯度根际(a)、根内(b)细菌属水平下的组成Fig.2 Composition of rhizosphere(a)and endophytic(b)bacterial genus at different sampling points
在OTU水平分析3个样地水葱根际和根内细菌的共有菌和特异菌,韦恩图分析(图3)可见,12 478个OTU中,607个OTU共存于根际和根内,根际特有的OTU数量为385,而根内特有的OTU达759个。水葱根际OTU在中间样点的个数最多为793个,而根内OTU在出口处最多,达904个。
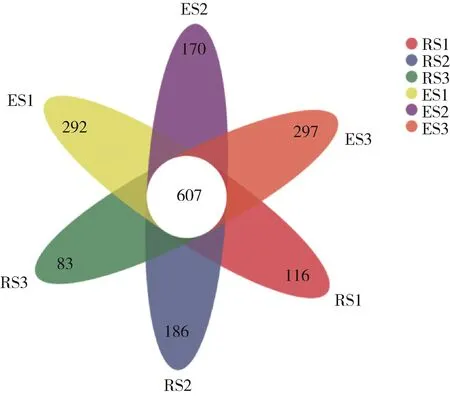
图3 韦恩图分析三个样地根际(RS)、根内(ES)OTU的分布Fig.3 Venn diagram analysis of distribution of rhizosphere(RS)and endophytic(ES)OTU at three sampling points
2.4 水葱根际和根内细菌群落差异性分析
在OTU水平对水葱根际和根内细菌群落的差异性进行PCoA分析。结果表明不同取样点水葱根际细菌群落结构有极显著差异(P<0.01)(图 4(a))。PCoA 分析第一轴和第二轴的解释率分别为66.13%和13.92%,总解释率达80.05%。水葱根际细菌群落呈现离散型分组,表明不同取样点土壤理化性质对水葱根际细菌群落结构有显著影响。不同取样点水葱根内细菌群落结构有一定差异,但差异不显著(图 4(b))(P=0.132),第一轴和第二轴的解释率分别为28.79%和25.71%,总解释率为54.50%。说明不同取样点土壤环境因子对水葱根内细菌群落的影响较小。水葱根际、根内细菌群落的差异极显著(P<0.01),且根内群落更为聚集(图4(c)),PCoA第一轴和第二轴解释率分别为27.20%和23.00%,总解释率达50.20%。说明水葱根内细菌群落组成相似性高,受环境影响较小,而根际土壤细菌群落受环境影响较大。
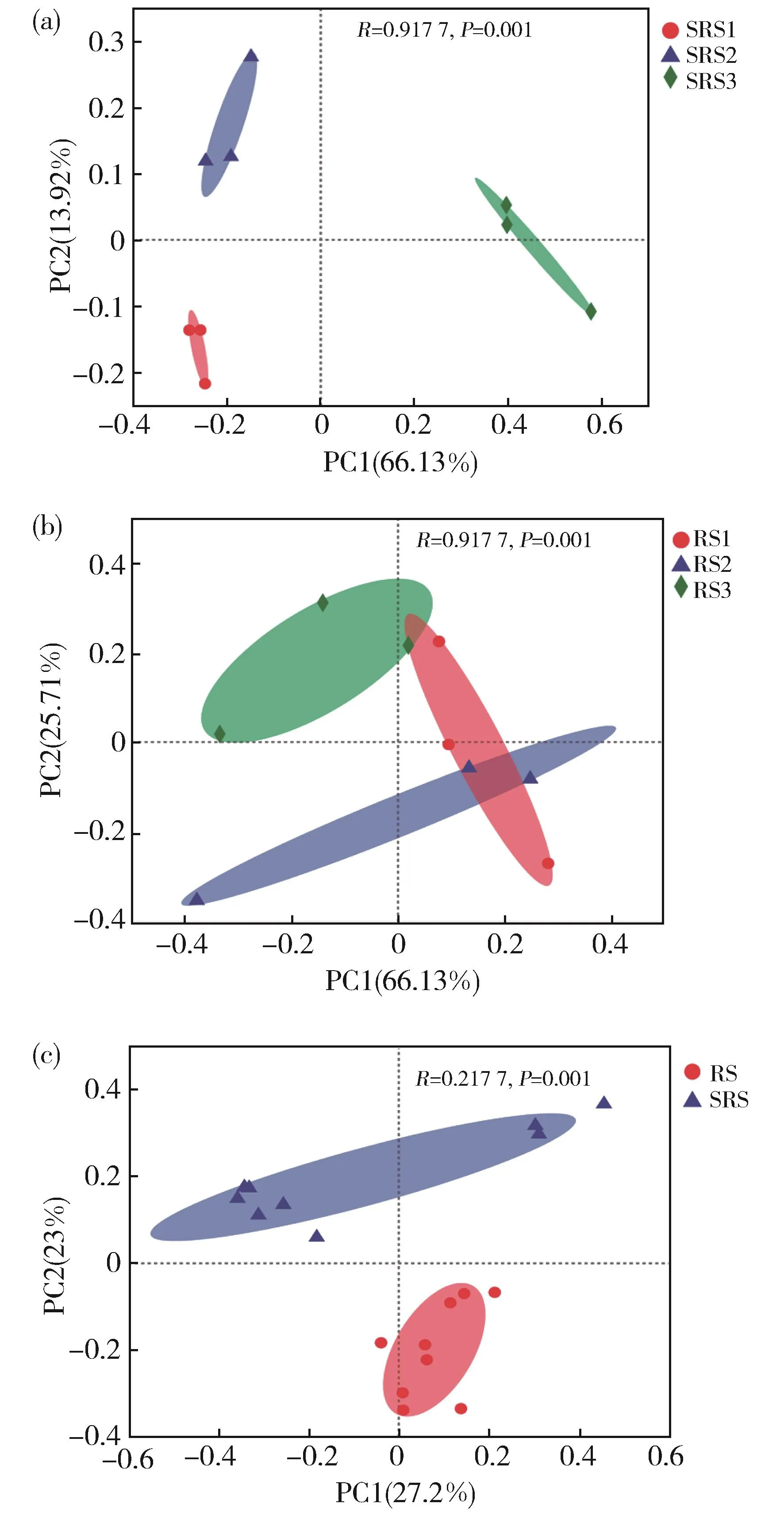
图4 沿污染梯度根际(a)、根内(b)以及根际和根内间(c)细菌群落的β多样性Fig.4 β diversity of rhizosphere(a)and rhizosphere(b)bacterial communities,and between them(c)at different sampling points
2.5 水葱根际、根内细菌群落结构与环境因子的关系
利用db-RDA方法进一步分析水葱根际和根内细菌群落组成结构与环境因子的关系。根际细菌群落结构在门水平主要受pH、NO3--N、NH4+-N和TN的影响,其中第一轴和第二轴的解释率分别为43.85%和8.08%,总解释率达51.93%(图5(a))。变形菌和放线菌与NH4+-N、pH、NO3--N有显著的相关性(P<0.05),说明水葱根际细菌群落结构受环境因子的影响较大。水葱根内细菌群落结构在门水平主要受pH和NH4+-N的影响(图5(b)),第一轴和第二轴的解释率分别为23.18%和16.81%,总解释率为39.99%,低于环境因子对根际细菌的解释率,其中pH与根内放线菌和MBNT15菌的相关性最大。
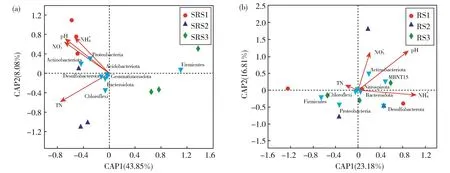
图5 不同环境因子对根际(a)和根内(b)细菌的影响Fig.5 Effects of different environmental factors on rhizosphere(a)and endophytic(b)bacterial communities
2.6 水葱根际、根内细菌群落的分子生态网络
利用共现性分子生态网络(molecular eco⁃logical network,MEN)分析水葱根际和根内细菌群落结构复杂性和稳定性特征(图6)。网络的拓扑学属性参数如表3所示。根际细菌群落的节点数(158个)、边数(2 620)和连接度(16.58)都远大于根内细菌群落,说明根际细菌群落的复杂性较高。网络密度参数表现出类似的特征,根内细菌群落的模块化程度(0.657)高于根际细菌群落(0.396),说明根内细菌群落的生态位分化更为明显。根内细菌群落节点间平均路径距离(5.864)显著大于根际细菌群落(3.032),说明节点间物质、能量和信息的传递距离在根内更长,速率更慢。不同污染梯度下水葱根际、根内有不同水平的连接性,根据BC(betweeness centrality)值可判别网络图中的关键物种。根据BC值的大小筛选出根际的关键属有5个分别为unclassified_f__Geobacteraceae、Longivirga、链霉菌属(Strepto⁃myces)、unclassified_o__Gaiellales、norank_f__Rubritaleaceae(BC>1 000)。根内的关键属有7个分别为unclassified_p__Proteobacteria、冷杆菌属(Cryobacterium)、norank_f_Methyloligellaceae、Subgroup_10、 norank_f__Geobacteraceae、 Paeni⁃sporosarcina、Confluentibacter(BC>1 800)。
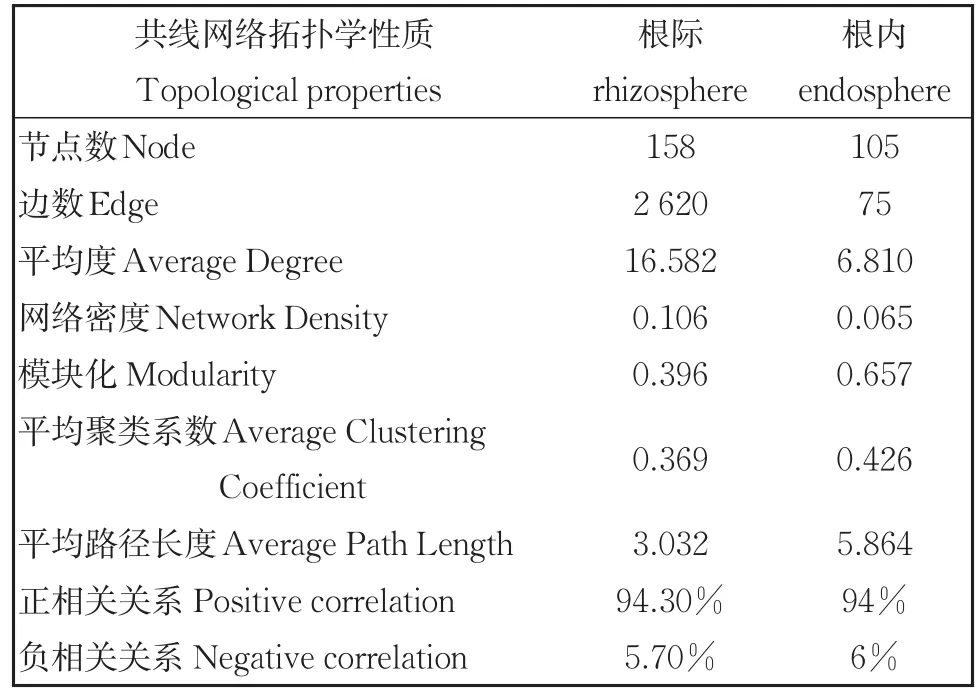
表3 水葱根际和根内细菌群落分子生态网络图的拓扑学属性Table 3 Topological properties of molecular ecological net‐work of rhizosphere and endophytic bacterial communities from Scalonion
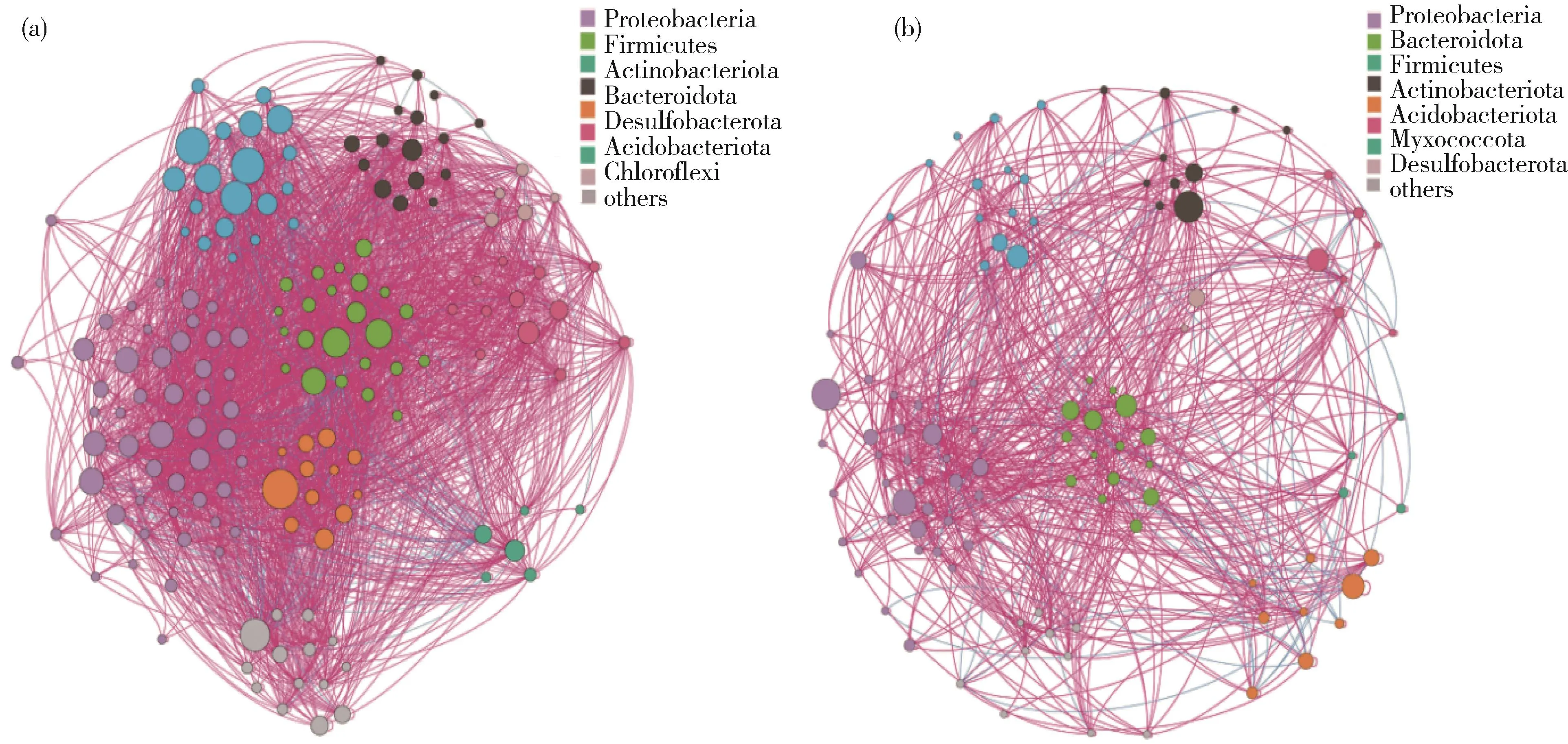
图6 根际(a)和根内(b)细菌群落属水平分子生态网络图Fig.6 Molecular ecological network diagram of rhizosphere(a)and endophytic(b)bacterial community at genus level
3 讨论
3.1 根际和根内微生物群落特征
水葱根际和内生细菌群落在门水平上的主要类群相对丰度沿环境梯度呈现一定的格局。厚壁菌门、变形菌门和放线菌门的分布,与宋延静等[12]对黄河三角洲湿地芦苇根际固氮微生物的细菌群落结构的研究结果相似,说明这些细菌门在氮素去除过程中有重要的作用。随氮污染浓度的下降,变形菌门和放线菌门均呈递减的趋势,说明二者的丰度与氮的浓度密切相关。放线菌在污水及有机固体废物的生物处理中有重要作用[13]。随着氮浓度降低,厚壁菌门呈现增加的趋势,可能是厚壁菌在高污染生境中(污水入口)进入休眠状态形成芽孢和孢子[14],出口处污染物浓度降低,其丰度增加。Hardoim(2015)等[15]总结了迄今为止鉴定的原核内生细菌,共有21个门,其中4个门占内生细菌序列总数的96%,分别为变形菌(54%),放线菌(20%),厚壁菌(16%),拟杆菌门(6%),这与本研究对湿地水葱根内细菌群落组成的结果相类似。不同宿主物种内生细菌群落关键组分的相似性分析表明,水葱根内微生物定殖不是一个被动过程,植物有能力选择某些微生物群落,或者某些微生物更擅长填充根系定植生态位。与水稻[16]和杨树[17]的研究类似,从根际土壤到根内,酸杆菌的相对丰度降低,而变形菌的相对丰度在根内层增加,表明在湿地中水葱根内细菌门变化可能与陆地植物相似,酸杆菌可能缺乏在内生环境中增殖所必需的特性。微小杆菌属在根内外较丰富,其具有广泛的植物有益特性,促进植物生长,包括磷酸盐溶解、固氮、细胞分裂素以及植物激素吲哚-3乙酸(IAA)和赤霉素的合成[18]。由于研究样地为处理低污染水排放的湿地,所以污染物的存在对植物根内外相关细菌产生选择性,导致能够利用这些污染物作为替代能源的分类群的丰度较大。如水葱根际假节杆菌属与胁迫条件有关,它能够使用多种基质作为碳源和能源,且通常对有毒化合物具有耐受性[19];鞘氨醇菌属[20]和类诺卡氏菌属[21]具有较好的利用石油烃能力,并能适应高浓度的石油烃污染环境。根内的红球菌属对有机污染化合物二苯并噻吩(DBT)具有较强的脱硫能力,其最终产物为羟基联苯,从而减少对环境的污染[22];硫杆菌属具有除硝态氮和硫化物利用的双重特性[23]。不同污染梯度下,根际细菌多样性和丰度变化比根内显著,根际微生物群落更容易受到土壤环境的影响,植物内生环境相对稳定。Hardoim(2015)等[15]研究认为根际细菌多样性大于根内细菌多样性,但本研究结果与此不同,可能是取样时间的不同所致。比如植物衰老期根内机会性病原体增多,降低了植物适应性,并在特定条件下宿主植物暴露于生物或非生物胁迫,导致植物、微生物和环境之间的多营养相互作用关系被破坏,最终表现为内生微生物群落多样性多于根际土壤。例如在被细菌病原体欧文氏胡萝卜亚种(Erwinia carotovorasubsp.carotovora)感染的植物中,马铃薯根茎中细菌内生菌的多样性增加[24]。土壤细菌群落的这些广泛变化暗示土壤微生物组根据植物的需要发生变化,通常根系微生物组可以在植物生长的一定阶段表现特定的功能[25]。
PCoA分析表明,水葱根际和根内细菌群落结构出现了明显的分化,且根际和根内细菌出现了不同的指示性OTU。这主要是由于根际细菌定殖主要是由大量碳的沉积(例如根分泌物、根冠粘液等)驱动[26]。但植物相关细菌必须具有高度的竞争力才能成功定居根区[27]。与根际和根面定殖不同,内生能力(即成功定殖宿主植物的能力)可能需要特定的性状,例如,趋化性相关基因的表达、鞭毛的形成、细胞壁降解酶的产生等[15],以及根际土传细菌和宿主植物先天免疫系统之间复杂的相互作用。杨树[28]、鸭跖草[29]和水稻[16],根际和根内生微生物群之间的这种结构分化也有报道。根内特有的OTU260隶属于弧菌属[30],其成员能够通过释放抗微生物化合物来抑制真菌植物病原体,有益于植物的健康生长。
根际网络的复杂性很可能是由于根和周围土壤的局部环境的持续变化所引起,如养分有效性、酸碱度、水分、氧气含量和CO2水平的变化[31]。与根际相比,根内的细菌群落的物种、多样性和网络复杂性较低,表明有限数量的物种被植物组织物理分离,或微生物与宿主植物的相互作用的强度,远远大于微生物-微生物间的相互作用[23]。无论在根际还是根内,节点之间94%以上为正相关,表明在水体环境中根际和根内细菌群落物种间的共生、共栖关系更为紧密。在特定环境因素下,具有相似适应能力的细菌群落通常可共存且具有相似的环境偏好,享有共同或者相似的生态位。无论在根际还是根内,变形菌具有最多的连接线,表明它们可能是网络相互作用关系的枢纽。这些类群是微生物组结构和功能的驱动因素,可能对植物健康和生态系统功能至关重要。BC值越大代表微生物在群落结构和功能中发挥的作用越重要。链霉菌属具有增强植物抗逆性,在协助植物固氮和促进植物吸收营养方面发挥着重要作用[32]。Paenisporosarcina是具有多种代谢功能的细菌,有多种活性,如营养循环、有机化合物降解等[33]。
3.2 土壤理化因子对根际、根内微生物的影响
土壤因子对根系微生物群落的形成起着重要作用,根际微生物栖息的微生境中的土壤因子,可以局部影响微生物的生存状态[34]。pH值、C、N、温度等非生物因素会影响微生物群落的分布,因此土壤性质会直接影响根际细菌群落,或通过影响植物根系的生理学特征而间接影响根际微生物群落[35]。大多数研究认为,土壤pH值是决定不同土壤细菌多样性和门组成的主要因素。本研究中门水平的根际、根内细菌群落都受到pH的显著影响。Li等[29]对根部细菌群落结构的多因素分析结果显示,pH值对根内细菌影响较小,可能是植物体内的酸碱度相对稳定。Lafay 和 Burdon[36]却认为,虽然影响较小,但土壤酸碱度对细菌群落的影响可以延伸到植物内部。本研究根际土壤细菌群落结构与土壤总氮也有显著相关性。凃月等[37]认为,TC、TN对湿地植物根际细菌群落结构发挥更为重要的作用,与本研究结果类似。水葱根际细菌放线菌门与NO3--N显著相关,其对NO3--N的去除发挥着重要的作用[38];变形菌门与NO3--N和NO4+-N成正相关,是生态系统的重要的微生物类群,与硝酸盐和亚硝酸盐的氨化有关系[39]。总之,本研究中环境因子对细菌群落格局和多样性的总解释率达51.93%,说明了微生物群落与环境之间的紧密联系。
4 结论
在污染湿地中,水葱根际、根内细菌在门和属水平上各自具有不同的优势类群,门水平上物种组成具有一定的相似性,但属水平物种组成差异较大。环境因子对根际细菌多样性的影响较大,而对根内细菌多样性影响较小。pH、NO3-、NH4+、TN对根际细菌群落结构的形成起主要作用,根内细菌群落结构受pH和NH4+的影响。根际和根内细菌群落结构的复杂性具有显著差异,根际细菌群落的复杂性较高,根内细菌群落的物种、多样性和网络复杂性较低,根内细菌群落的生态位分化更为明显。
