设施菜地种植年限对土壤nosZ型反硝化微生物群落结构和丰度的影响
2022-06-09王喜英赵辉谭智勇余高
王喜英 赵辉 谭智勇 余高

摘要:反硝化微生物在土壤氮素损失和温室气体转化方面具有重要的作用,研究设施菜地土壤反硝化微生物群落结构和数量变化,对评价设施菜地长期种植土壤质量状况和提高氮转化认知水平具有重要意义。应用荧光定量PCR和 Illumina Miseq高通量测序技术,以nosZ基因为靶标,研究设施菜地种植3、5、7年和露天菜地(CK)对土壤反硝化微生物群落结构和数量的影响。结果表明:露天菜地(CK)nosZ基因丰度显著高于其他处理,分别是3、5、7年的1.32倍、1.45倍和1.69倍。随种植年限延长,nosZ基因丰度逐渐降低。不同处理土壤反硝化微生物群落α多样性指数差异显著,α多样性指数随种植年限延长逐渐降低,且露天菜地(CK)的Chao1指数和ACE指数最高。门水平上优势类群为变形菌门;属水平上优势类群为慢生根瘤菌属和无色杆菌属;变形菌门和慢生根瘤菌属相对丰度随设施种植年限延长逐渐降低。主成分分析(PCA)结果表明,随种植年限延长nosZ群落结构差异较大;其中3年和5 年群落结构相似,7、3、5 年群落结构差异较大。土壤速效钾、铵态氮和硝态氮含量是nosZ型反硝化微生物数量、α多样性和群落结构的主要影响因素。综上可知,设施菜地长期种植显著降低了nosZ型反硝化微生物数量,并对群落结构有显著影响。
关键词:设施菜地;种植年限;反硝化微生物;nosZ基因;群落结构
中图分类号:S182 文献标志码: A
文章编号:1002-1302(2022)09-0240-07
设施蔬菜是现代农业集约化发展的一个重要分支,对提高自然资源利用率和增加农民收入具有重要的意义。随着人口的不断增长和对蔬菜消费需求的增加以及有限的耕地资源,设施蔬菜在过去的40年里得到了高度发展[1]。截至2016年,我国设施蔬菜种植面积已达387多万hm2,位居世界第一,产值占蔬菜总产值的50%以上[2]。然而,设施蔬菜具有种植指数高、农业投入大、棚内温湿度较高的封闭或半封闭环境,且无雨水淋溶等特点。因此,设施蔬菜长期种植已经引起了人们对土壤质量退化、土壤和蔬菜潜在污染以及对人类健康的负面影响的担忧[3-4]。
土壤微生物在土壤生态系统中起着养分循环、有机质转化、污染物降解和土传病害防治等作用[5]。相关研究认为,设施蔬菜长期种植对土壤微生物群落结构和功能有负面影响,主要指从细菌为主到以真菌为主的群落演替,功能相关微生物群落成员和物种相互作用的减少,导致一些土传病原菌替代了对生态有益的微生物群落[6-9]。目前,研究者更多关注的是土壤微生物群落的整体变化或某些选定的与土传病害有关的微生物。由于土壤微生物具有高度的结构和功能多样性,不同类型的土壤生物过程由所涉及的功能群微生物驱动完成。迄今为止,在设施蔬菜生产中,土壤功能微生物对蔬菜长期生产的响应仍然知之甚少,尤其是与养分循环相关的微生物。
氮(N)是植物生长的主要限制因子,土壤氮有效性在决定植物氮素吸收和产量方面起着重要作用[10]。氮转化主要包括氮固定、礦化、硝化和反硝化过程[11]。反硝化作用产生的温室气体(N 2O)是大气臭氧的主要消耗物质,变暖潜力是二氧化碳的298倍[12]。其中,由土壤微生物驱动的反硝化作用对调节氮循环及维持全球氮平衡起着重要的作用[13]。N 2O主要由反硝化作用产生,耕地土壤是最大的来源[14-15]。设施菜地由于投入大量氮肥和大水漫灌,导致土壤反硝化作用强烈,N 2O释放通量比大田高1.41倍[16]。因此,如何通过微生物来调控N 2O转化已经成为许多学者关注的焦点[17-18]。目前,反硝化中唯一已知的是通过nosZ基因编码的N 2O还原酶还原N 2O的生物过程[19]。在森林、草地和耕地中已开始利用nosZ基因来研究反硝化微生物群落结构和多样性[20-21]。然而,关于设施蔬菜长期种植对土壤nosZ型反硝化微生物群落结构和数量的研究未见报道。
为此,本研究运用荧光定量PCR和Illumina MiSeq高通量测序技术对不同种植年限设施菜地土壤nosZ型反硝化微生物群落结构及丰度进行研究,主要目的在于:(1)随设施菜地种植年限延长,反硝化微生物群落结构和多样性如何变化?有哪些优势类群发生变化?(2)设施蔬菜长期种植中,哪些土壤环境因子对反硝化微生物群落结构影响较大?揭示设施蔬菜长期种植过程中的反硝化能力,为深入了解设施蔬菜土壤氮循环过程提供科学依据。
1 材料与方法
1.1 研究区域概况
试验样地位于贵州省铜仁市和平乡(109°07′44″E,27°46′46″N),属于亚热带季风气候,年均温18 ℃,年降水量1 313 mm,土壤类型为黄壤,有机碳含量为22.32 g/kg,全氮含量为1.05 g/kg,pH值为6.15,容重为1.23 g/cm3。
1.2 试验设计
选择3个种植年限(3、5和7 年)设施大棚(长、宽规格分别为8、40 m)各3个,以周围种植的露天蔬菜为对照(CK)。设施菜地基肥施用氮磷钾复合肥80~100 kg/667 m2,追施氮肥40~50 kg/667 m2。露天菜地施用基肥40~50 kg/667 m2,追肥20~30 kg/667 m2。设施大棚每年蔬菜种植类型一致,主要种植黄瓜和豇豆等。在整个试验处理中,除种植年限差异外,其余生产管理措施一致。
于2017年7月取样,当季种植的作物均为黄瓜,每个样地按“S”形(五点法)采集0~10 cm土壤样品,用低温冰盒保存带回实验室进行2 mm过筛处理。土样分为3份,一份新鲜土壤用于铵态氮和硝态氮含量测定;一份-80 ℃冰箱保存用于nosZ基因群落结构和丰度分析;一份室内风干处理用于土壤化学指标测定。
1.3 测定方法
1.3.1 土壤化学性质测定 采用鲍士旦的方法[22]进行测定。土壤pH值采用电位法测定;有机碳(SOC)含量采用重铬酸钾氧化法测定;全氮(TN)含量采用凯氏定氮法测定;速效磷(AP)含量采用碳酸氢钠浸提-钼锑抗比色法测定;速效钾(AK)含量采用乙酸铵提取-火焰光度法测定;铵态氮(NH+ 4-N)含量采用靛酚蓝比色法测定;硝态氮(NO- 3-N)含量采用酚二磺酸比色法测定。
1.3.2 土壤DNA提取及nosZ基因扩增和荧光定量PCR 称取0.5 g土壤,按照E.Z.N.A. Mag-BindSoil DNA Kit(Omega,GA,USA)试剂盒操作步骤提取土壤DNA。用1%的琼脂糖凝胶电泳检测DNA完整性,用核酸定量仪(Nanodrop-NC2000)检测DNA浓度和纯度。采用引物nosZ-F(5′-GGGCTBGGGCCRTTGCA-3′)与nosZ-R(5′-GAAGCGRTCCTTSGARAACTTG-3′)扩增nosZ基因高变区片段[23]。
PCR产物纯化回收后,将其连接至pMD8-T载体,转化至大肠杆菌DH5α感受态中进行培养,筛选阳性克隆,提取nosZ基因重组质粒,质粒浓度经核酸定量仪测定后,计算基因拷贝数,按照10倍梯度稀释至103~108拷贝数,制备标准曲线[24]。
1.3.3 高通量测序 PCR产物扩增后,样品送至上海派森诺生物科技有限公司,运用Illumina MiSeq测序平台进行测序。使用QIIME软件调用UCLUST序列比对工具,按照97%的序列相似度进行OTU划分和归并,并选取丰度最高的序列作为该OTU的代表序列。利用QIIME软件将OTU的代表序列与功能基因数据库进行比对,获取每个OTU对应的分类学信息。
1.4 数据分析
采用SPSS 21.0软件进行土壤化学性质、反硝化细菌α多样性指数、丰度和群落组成相对丰度的差异显著性分析(α=0.05)和相关性分析。采用R软件进行主成分分析和冗余分析。
2 结果与分析
2.1 土壤化学性质
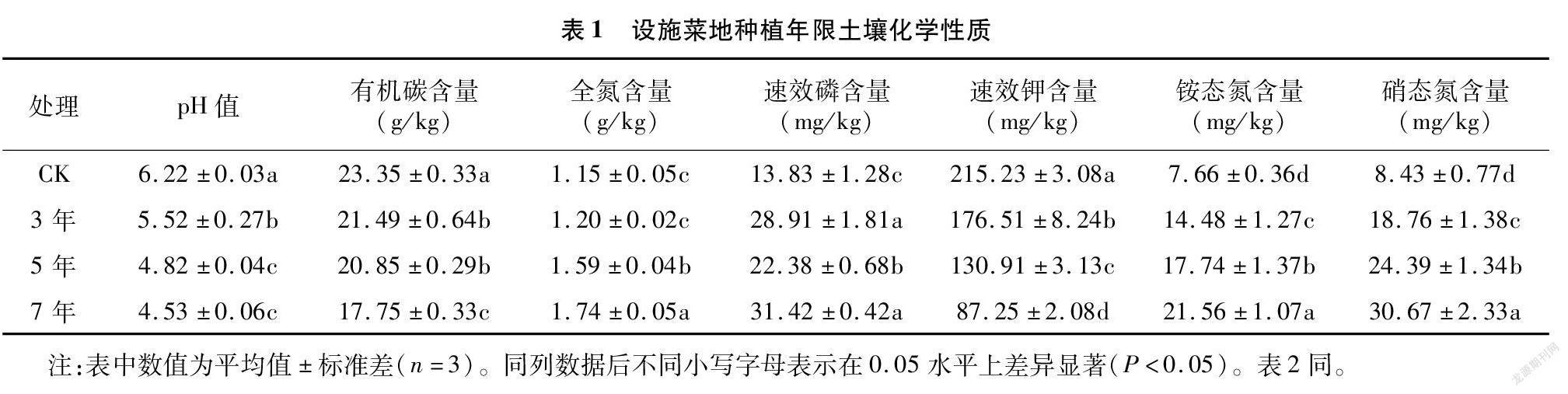
由表1可知,不同设施菜地种植年限土壤pH值及有机碳、速效钾含量均显著小于CK,随种植年限延长逐渐降低。种植3、5、7 年土壤全氮、速效磷、铵态氮和硝态氮含量均高于CK。种植5、7年土壤全氮含量分别比CK显著增加38.26%、51.30%,种植3 年和CK差异不显著。不同处理土壤速效磷含量大小顺序为7年>3年>5年>CK。土壤铵态氮和硝态氮含量随种植年限延长而增加,大小顺序为7年>5年>3 年>CK。
2.2 nosZ基因豐度
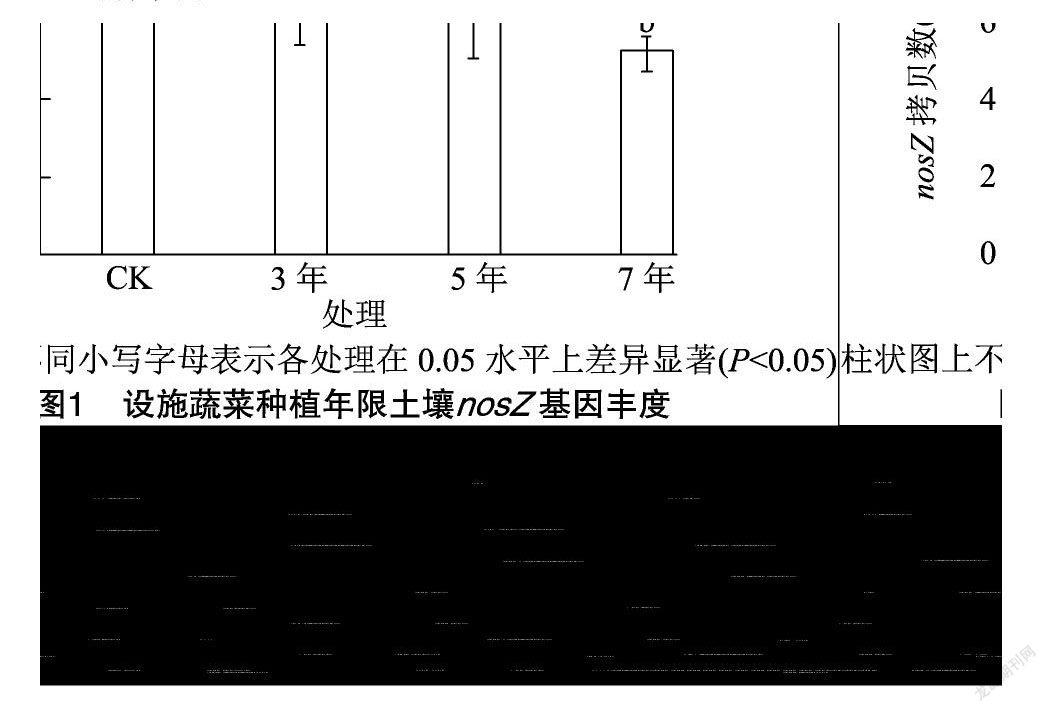
由图1可知,不同设施菜地种植年限土壤nosZ基因拷贝数变化范围为5.19×106~8.78×106拷贝/g。不同设施种植年限nosZ基因拷贝数均显著小于CK(P<0.05),CK分别是设施种植3、5、7年的1.32倍、1.45倍、1.69倍。设施种植3、5、7年的nosZ基因拷贝数之间差异不显著,随种植年限延长逐渐降低。
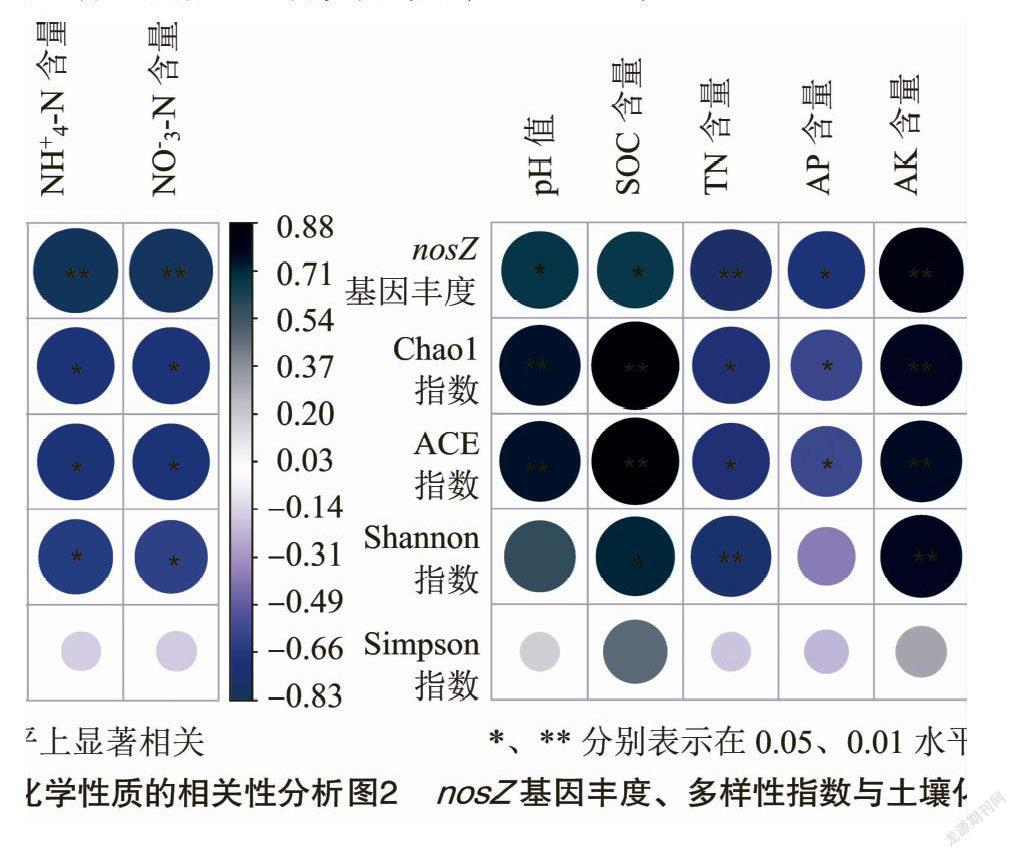
为明确nosZ基因丰度差异的影响因素,由nosZ基因丰度与土壤化学性质进行相关性分析。由图2可知,nosZ基因丰度分别与土壤pH值和有机碳含量呈显著正相关(P<0.05);与土壤全氮、铵态氮和硝态氮含量呈极显著负相关(P<0.01);与速效磷含量呈显著负相关(P<0.05);与速效钾含量呈极显著正相关(P<0.01)。
2.3 nosZ型反硝化微生物α多样性指数
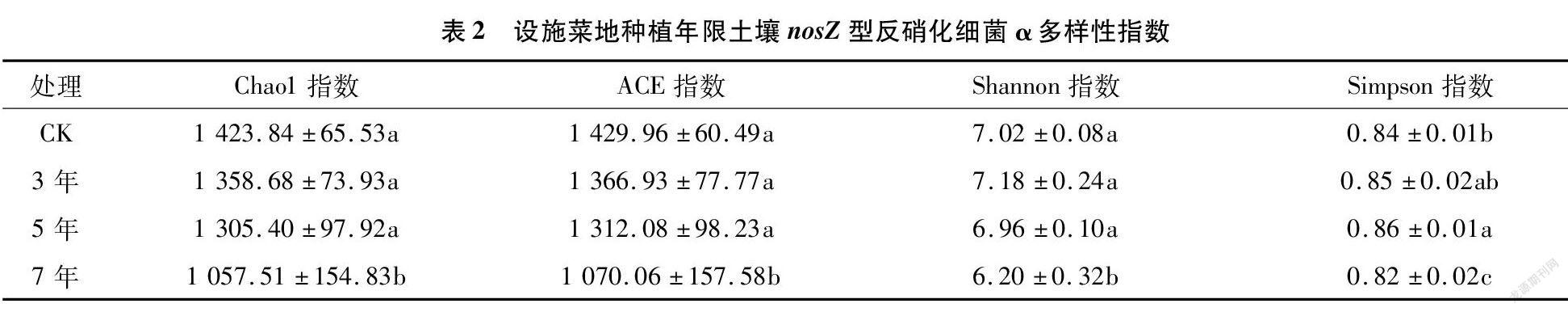
由表2可知,Chao1指数和ACE指数变化趋势相同,范围分别为1 057.51~1 423.84和1 070.06~1 429.96,各设施蔬菜种植年限的Chao1指数和ACE指数均小于CK,随种植年限延长而逐渐降低。Shannon指数和Simpson指数范围为6.20~7.02和0.82~0.86,种植7年均显著小于其他处理(P<0.05)。Shannon指数在种植3 年时最高,大小顺序为3年>CK>5 年>7年。Simpson指数在种植5年时最高,大小顺序为5年>3年>CK>7年。
由相关性分析(图2)可知,Chao1指数和ACE指数分别与土壤pH值、有机碳和速效钾含量呈极显著正相关(P<0.01);与全氮、速效磷、铵态氮和硝态氮含量呈显著负相关关系(P<0.05)。Shannon指数与土壤有机碳含量呈显著正相关(P<0.05);与全氮含量呈极显著负相关(P<0.01);与速效钾含量呈极显著正相关(P<0.01);与铵态氮和硝态氮呈显著负相关(P<0.05)。
2.4 nosZ群落组成
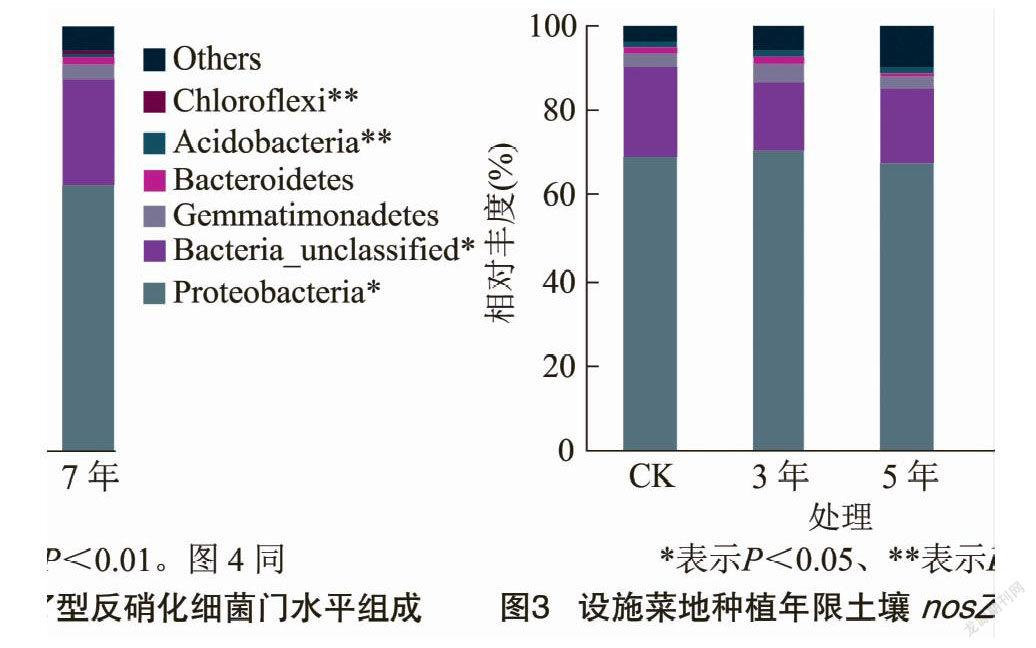
由图3可知,通过对样品获得的nosZ群落OTUs进行归类,在门水平上共获得6个类群,分别为变形菌门(Proteobacteria)、Bacteria_unclassified、芽单胞菌门(Gemmatimonadetes)、拟杆菌门(Bacteroidetes)、酸杆菌门(Acidobacteria)和绿弯菌门(Chloroflexi)。 不同设施蔬菜种植年限土壤变形菌门、Bacteria_unclassified、酸杆菌门和绿弯菌门相对丰度差异显著或极显著。变形菌门、Bacteria_unclassified和芽单胞菌门为主要优势类群,相对丰度范围为62.27%~70.42%、16.66%~25.19%和2.88%~3.82%。种植5、7年的变形菌门相对丰度均小于CK,分别比CK降低2.69%、10.34%。Bacteria_unclassified相对丰度在种植7年中最高,显著高于种植3年和5年。芽单胞菌门相对丰度在3年中最高,种植5年中最低,大小顺序为3年>7年>CK>5年。设施菜地种植年限对变形菌门有抑制作用,随种植年限增加抑制作用增强。
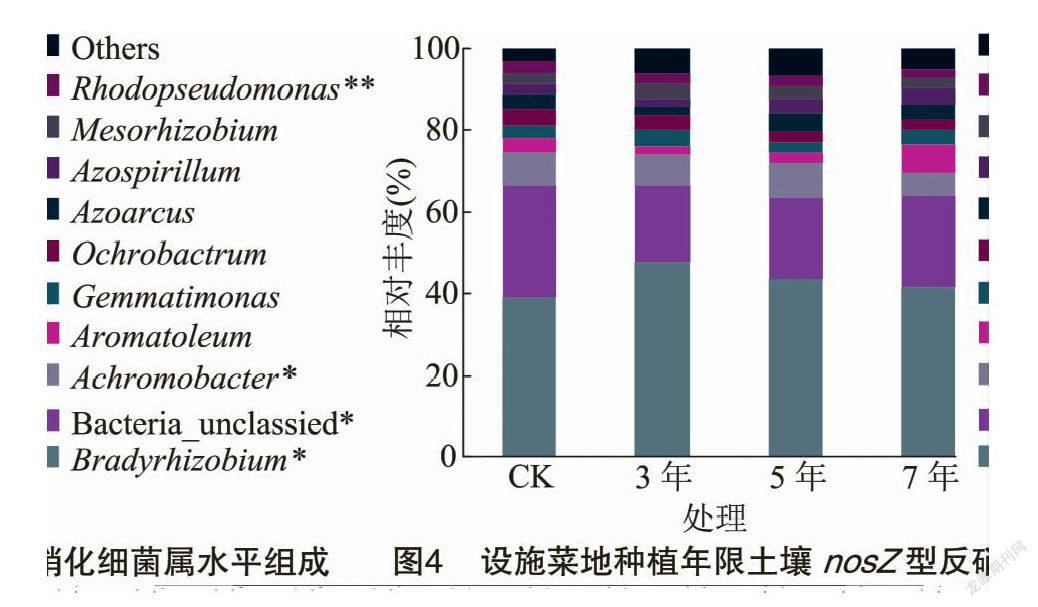
在属水平上,可得到平均相对丰度>1%的10个类群(图4),分别为慢生根瘤菌属(Bradyrhizobium)、Bacteria_unclassified、无色杆菌属(Achromobacter)、Aromatoleum、芽单胞菌属(Gemmatimonas)、苍白杆菌属(Ochrobactrum)、Azoarcus、固氮螺菌属(Azospirillum)、中慢生根瘤菌属(Mesorhizobium)和红假单胞菌属(Rhodopseudomonas)。其中慢生根瘤菌属、Bacteria_unclassified、无色杆菌属和红假单胞菌属相对丰度在不同设施蔬菜种植年限中差异显著或极显著。慢生根瘤菌属、Bacteria_unclassified和无色杆菌属为主要优势类群,相对丰度范围为39.01%~47.88%、18.48%~27.68%和5.28%~8.57%。慢生根瘤菌属相对丰度在不同设施种植年限均大于CK,分别是CK的1.23倍、1.12倍、1.07倍。无色杆菌属相对丰度在种植7 年显著小于其他处理,大小顺序为5年>CK>3年>7年。Aromatoleum相对丰度随设施蔬菜种植年限的延长逐渐增加,种植3年和5年均小于CK。
2.5 nosZ群落结构及其与土壤化学性质的关系
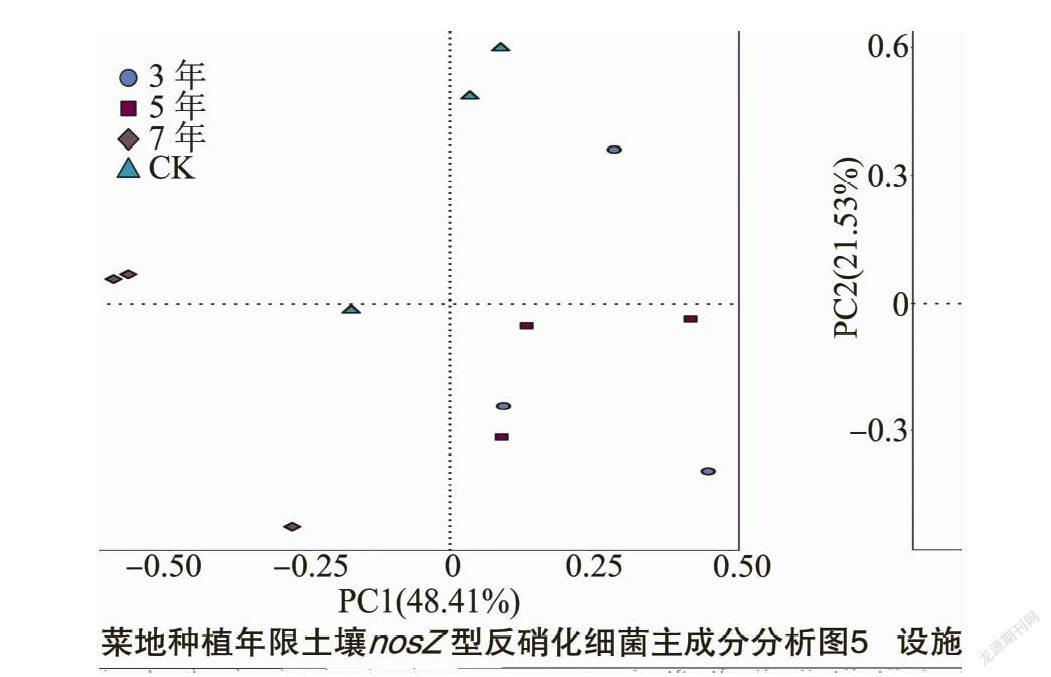
通过对nosZ群落进行主成分分析(图5)可知,不同设施种植年限土壤nosZ群落结构差异明显,第1、第2主成分轴共解释了细菌群落结构变异的69.94%,其中第1主成分轴解释了总变异的48.41%,第2主成分轴解释了总变异的21.53%。种植7年分别与种植3、5年在PC1和PC2上分离都较大,说明随设施蔬菜种植年限延长,nosZ群落结构变化较大;种植3、5年的群落相聚较近,说明群落相似度较大。
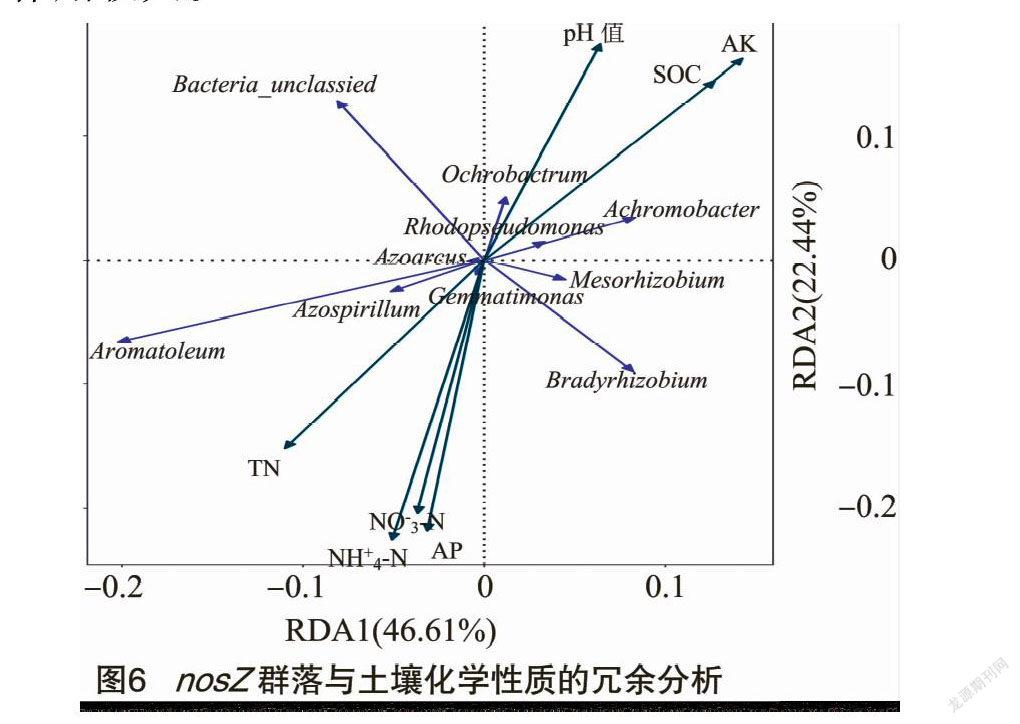
为分析土壤化学性质对nosZ群落结构的影响,对nosZ群落结构与土壤化学指标进行冗余分析。由图6可知,第1主轴能够解释所有信息的46.61%,第2主轴解释22.44%,两者累计解释信息量达69.05%。由此可知,前2轴很好地反映了nosZ群落组成与土壤化学性质的关系,且第1主轴作用较大。
在属水平上,进一步对nosZ群落和土壤化学性质进行相关性分析(表3)。Bacteria_unclassied与土壤速效磷含量呈显著负相关(P<0.05)。无色杆菌属与土壤有机碳含量呈极显著正相关(P<0.01),与速效钾含量呈显著正相关(P<0.05)。Aromatoleum与土壤有机碳含量和速效钾呈显著负相关,与全氮、铵态氮呈显著正相关(P<0.05),与速效钾呈显著负相关。苍白杆菌属与土壤pH值呈显著正相关(P<0.05)。固氮螺菌属与土壤全氮、铵态氮含量呈显著正相关,与速效钾含量呈显著负相关(P<0.05)。红假单胞菌属与土壤pH值、有机碳和速效钾含量呈极显著正相关(P<0.01),与全氮含量呈极显著负相关(P<0.01),与铵态氮和硝态氮含量呈显著负相关(P<0.05)。
3 讨论与结论
长期种植设施蔬菜对土壤化学指标有显著影响,土壤全氮、铵态氮和硝态氮含量随设施种植年限增加而显著增加,同时也高于露天菜地(CK),可能由于设施栽培集约化种植,肥料持续高投入且长期连作限制植物生长,影响植物对养分的吸收,大部分养分在土壤中逐年积累[25-26]。由本研究结果可知,设施菜地土壤有机碳含量低于露天菜地(CK),随种植年限延长逐渐降低,与前人研究结果[27-28]相反,但与Song等的研究结果[29]相似,可能与该区域很少施用有机肥及植物残体归还较少等因素有关。本研究中土壤pH值随种植年限延长逐渐降低,与许多研究结果[30-31]相同,可能是由于长期过量施(氮)肥导致SO2- 4和NO- 3等不断积累,最终引起土壤酸化增强。
反硝化作用主要由微生物驱动完成,与土壤施肥密切相关[32]。本研究中,nosZ数量随设施种植年限增加逐渐下降,且显著小于露天菜地(CK),可能由于设施蔬菜高水肥投入,土壤pH值降低,不利于微生物的N 2O还原酶组装,降低N 2O还原酶活性,导致微生物对N 2O还原能力下降[33-34]。Hallin等研究认为,nosZ基因拷贝数随施氮量增加快速下降[32]。本研究中nosZ基因丰度与土壤pH值、有机碳含量呈显著正相关,由于反硝化微生物为化能异养型生物,有机质可作为能量来源[35]。Matlou等研究认为,土壤有机碳含量与土壤微生物群落结构关系紧密,有机碳为土壤微生物活动提供需要的底物以及能量来源[36]。在本研究,随设施蔬菜种植年限延长,土壤有机碳含量逐渐降低,不能为反硝化微生物提供充足的能量来源。Bowden等研究认为,土壤有机碳积累是因为微生物生物量减少导致[37]。土壤pH值是反硝化微生物数量变化的主要环境因子[38]。土壤pH值随设施蔬菜种植年限延长逐渐降低,土壤酸化会引起铁、铝等积累,铁、铝氢氧化物通過吸附土壤可溶性碳来降低微生物对碳源的利用[39];土壤酸性越强,Al3+积累越多,对土壤细菌细胞膜损害越大[40]。Bauhus等研究表明,在酸性森林土壤中,添加磷可以促进土壤反硝化[41]。本研究中,nosZ基因拷贝数与速效磷含量呈显著相关,进一步支撑了土壤磷对反硝化微生物具有调控作用,然而关于磷如何调控反硝化微生物生长的机制仍不清楚。硝态氮可作为反硝化底物和反硝化过程的电子受体,影响反硝化微生物生长[42]。本研究中,nosZ反硝化微生物群落ɑ多样性指数在各处理差异显著。Chao1指数和ACE指数均是露天菜地(CK)最高,随种植年限延长逐渐降低,可能由于设施蔬菜长期种植,土壤酸化和盐渍化严重,导致土壤反硝化细菌物种丰度降低。Shannon指数和Simpson指数是种植3年较高,7年较低,随种植年限延长土壤反硝化微生物物种多样性降低;可能是由于设施蔬菜长期种植,导致土壤有机碳含量下降,不能为反硝化微生物生长提供丰富碳源。
nosZ型反硝化细菌中优势类群均为变形菌门,与许多研究结果[12,43]一致。变形菌门的高低可反映土壤有机质等养分含量高低,同时在pH值较高的土壤环境中生长较好[44]。本研究中,变形菌门丰度随种植年限延长表现出递降趋势,露天菜地(CK)和种植3年土壤最高,可能与土壤养分含量高及pH值较高有关,有利于变形菌门生长。属水平上共有优势类群为慢生根瘤菌属,相对丰度平均占nosZ基因序列的43%。种植3、5、7 年的慢生根瘤菌属相对丰度均大于露天菜地(CK),随种植年限延长逐渐降低。
相关研究人员认为,反硝化微生物对施肥的反映差异性在于土壤pH值、全氮、铵态氮和硝态氮含量[32]。土壤pH值被认为是影响反硝化微生物群落结构的主要因子,pH值对反硝化微生物具有选择效应,其变化可以影响反硝化微生物的群落结构,并进而影响它们对环境变化的响应[38]。本研究中,土壤pH值在不同处理中存在显著差异,并且土壤pH值与nosZ相对丰度之间存在显著相关关系,说明土壤pH值是引起反硝化微生物群落结构发生变化的主要因素。硝态氮是反硝化的底物,硝态氮含量直接影响反硝化微生物的利用程度[45]。
nosZ基因丰度、Chao1指数和ACE指数变化趋势一致,随种植年限延长逐渐降低。门水平上,变形菌门相对丰度占nosZ型反硝化微生物总量的62.27%~70.42%,是设施菜地土壤共有优势类群,在种植3年土壤中最高。属水平上,慢生根瘤菌属和无色杆菌属为共有优势类群。为准确评价设施土壤反硝化作用变化规律,需要开展长期试验,同时还需要对涉及反硝化途径的其他功能微生物群落进行研究。
参考文献:
[1]Hu W Y,Zhang Y X,Huang B,et al. Soil environmental quality in greenhouse vegetable production systems in eastern China:current status and management strategies[J]. Chemosphere,2017,170:183-195.
[2]荣勤雷.有机肥/秸秆替代化肥模式对设施菜田土壤团聚体微生物特性的影响[D]. 北京:中国农业科学院,2018.
[3]宁德富,孔丽琼,汤 娜,等. 不同种植年限蔬菜地土壤养分变化规律研究[J]. 四川农业大学学报,2016,34(1):67-72.
[4]Sun J T,Pan L L,Zhan Y,et al. Contamination of phthalate esters,organochlorine pesticides and polybrominated diphenyl ethers in agricultural soils from the Yangtze River Delta of China[J]. Science of the Total Environment,2016,544:670-676.
[5]van der Heijden M G A,Wagg C.Soil microbial diversity and agro-ecosystem functioning[J]. Plant and Soil,2013,363(1/2):1-5.
[6]Yao Z Y,Xing J J,Gu H P,et al. Development of microbial community structure in vegetable-growing soils from open-field to plastic-greenhouse cultivation based on the PLFA analysis[J]. Journal of Soils and Sediments,2016,16(8):2041-2049.
[7]Li X G,Ding C F,Zhang T L,et al. Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing[J]. Soil Biology and Biochemistry,2014,72:11-18.
[8]Xiong W,Li R,Ren Y,et al. Distinct roles for soil fungal and bacterial communities associated with the suppression of Vanilla Fusarium wilt disease[J]. Soil Biology and Biochemistry,2017,107:198-207.
[9]Liu X,Zhang Y,Ren X J,et al. Long-term greenhouse vegetable cultivation alters the community structures of soil ammonia oxidizers[J]. Journal of Soils and Sediments,2019,19(2):883-902.
[10]李生秀.中國旱地土壤植物氮素[M]. 北京:科学出版社,2008:3-5.
[11]Kuypers M M M,Marchant H K,Kartal B.The microbial nitrogen-cycling network[J]. Nature Reviews Microbiology,2018,16(5):263-276.
[12]Thomson A J,Giannopoulos G,Pretty J,et al. Biological sources and sinks of nitrous oxide and strategies to mitigate emissions[J]. Philosophical Transactions of the Royal Society(B:Biological Sciences),2012,367(1593):1157-1168.
[13]杨亚东,宋润科,马俊永,等. 长期氮磷不同施用量对土壤细菌、硝化与反硝化微生物数量的影响[J]. 中国农业大学学报,2018,23(9):81-88.
[14]Hu H W,Chen D L,He J Z.Microbial regulation of terrestrial nitrous oxide formation:understanding the biological pathways for prediction of emission rates[J]. FEMS Microbiology Reviews,2015,39(5):729-749.
[15]Shcherbak I,Millar N,Robertson G P.Global meta-analysis of the nonlinear response of soil nitrous oxide (N 2O) emissions to fertilizer nitrogen[J]. PNAS,2014,111(25):9199-9204.
[16]Ravishankara A R,Daniel J S,Portmann R W.Nitrous oxide (N 2O):the dominant ozone-depleting substance emitted in the 21st century[J]. Science,2009,326(5949):123-125.
[17]Hallin S,Philippot L,L ffler F E,et al. Genomics and ecology of novel N 2O-reducing microorganisms[J]. Trends in Microbiology,2018,26(1):43-55.
[18]Schreiber F,Wunderlin P,Udert K M,et al. Nitric oxide and nitrous oxide turnover in natural and engineered microbial communities:biological pathways,chemical reactions,and novel technologies[J]. Frontiers in Microbiology,2012,3:372.
[19]Domeignoz-Horta L,Putz M,Spor A,et al. Non-denitrifying nitrous oxide-reducing bacteria-An effective N 2O sink in soil[J]. Soil Biology and Biochemistry,2016,103:376-379.
[20]陳秀波,朱德全,赵晨晨,等. 凉水国家自然保护区不同林型红松林土壤nosZ型反硝化微生物群落组成和多样性分析[J]. 林业科学,2019,55(8):106-117.
[21]Dandie C E,Burton D L,Zebarth B J,et al. Changes in bacterial denitrifier community abundance over time in an agricultural field and their relationship with denitrification activity[J]. Applied and Environmental Microbiology,2008,74(19):5997-6005.
[22]鲍士旦.土壤农化分析[M]. 3版.北京:中国农业出版社,2000:25-114.
[23]Chen Z,Hou H J,Zheng Y,et al. Influence of fertilisation regimes on a nosZ-containing denitrifying community in a rice paddy soil[J]. Journal of the Science of Food and Agriculture,2012,92(5):1064-1072.
[24]Kloos K,Mergel A,Rosch C,et al. Denitrification within the genus Azospirillum and other associative bacteria[J]. Functional Plant Biology,2001,28(9):991-998.
[25]宋蒙亚,李忠佩,吴 萌,等. 不同种植年限设施菜地土壤微生物量和群落结构的差异[J]. 中国农业科学,2015,48(18):3635-3644.
[26]王学霞,陈延华,王甲辰,等. 设施菜地种植年限对土壤理化性质和生物学特征的影响[J]. 植物营养与肥料学报,2018,24(6):1619-1629.
[27]Liu Y,Liu X Y,Feng Y F,et al. Composition of a soil organic carbon increment under different vegetable cultivation patterns:a study using three SOC pools[J]. Sustainability,2018,11(1):35.
[28]Wang Y,Xu H,Wu X,et al. Quantification of net carbon flux from plastic greenhouse vegetable cultivation:a full carbon cycle analysis[J]. Environmental Pollution,2011,159(5):1427-1434.
[29]Song Y,Xu M,Li X N,et al. Long-term plastic greenhouse cultivation changes soil microbial community structures:a case study[J]. Journal of Agricultural and Food Chemistry,2018,66(34):8941-8948.
[30]高新昊,张英鹏,刘兆辉,等. 种植年限对寿光设施大棚土壤生态环境的影响[J]. 生态学报,2015,35(5):1452-1459.
[31]Yang L Q,Huang B A,Hu W Y,et al. The impact of greenhouse vegetable farming duration and soil types on phytoavailability of heavy metals and their health risk in Eastern China[J]. Chemosphere,2014,103:121-130.
[32]Hallin S,Jones C M,Schloter M,et al. Relationship between N-cycling communities and ecosystem functioning in a 50-year-old fertilization experiment[J]. The ISME Journal,2009,3(5):597-605.
[33]田 浩,杨柳青,曹文超,等. 设施菜田与棚外粮田土壤菌群和反硝化气体产生的比较分析[J]. 微生物学通报,2015,42(5):835-844.
[34]Bergaust L,Mao Y J,Bakken L R,et al. Denitrification response patterns during the transition to anoxic respiration and posttranscriptional effects of suboptimal pH on nitrous oxide reductase in Paracoccus denitrificans[J]. Applied and Environmental Microbiology,2010,76(19):6387-6396.
[35]Menyailo O V,Huwe B.Activity of denitrification and dynamics of N 2O release in soils under six tree species and grassland in central Siberia[J]. Journal of Plant Nutrition and Soil Science,1999,162(5):533-538.
[36]Matlou M C,Haynes R J.Soluble organic matter and microbial biomass C and N in soils under pasture and arable management and the leaching of organic C,N and nitrate in a lysimeter study[J]. Applied Soil Ecology,2006,34(2/3):160-167.
[37]Bowden R D,Davidson E,Savage K,et al. Chronic nitrogen additions reduce total soil respiration and microbial respiration in temperate forest soils at the Harvard Forest[J]. Forest Ecology and Management,2004,196(1):43-56.
[38]Enwall K,Philippot L,Hallin S.Activity and composition of the denitrifying bacterial community respond differently to long-term fertilization[J]. Applied and Environmental Microbiology,2005,71(12):8335-8343.
[39]Tang Y Q,Zhang X Y,Li D D,et al. Impacts of nitrogen and phosphorus additions on the abundance and community structure of ammonia oxidizers and denitrifying bacteria in Chinese fir plantations[J]. Soil Biology and Biochemistry,2016,103:284-293.
[40]Yaganza E S,Rioux D,Simard M,et al. Ultrastructural alterations of Erwinia carotovora subsp. atroseptica caused by treatment with aluminum chloride and sodium metabisulfite[J]. Applied and Environmental Microbiology,2004,70(11):6800-6808.
[41]Bauhus J,Khanna P K.Carbon and nitrogen turnover in two acid forest soils of southeast Australia as affected by phosphorus addition and drying and rewetting cycles[J]. Biology and Fertility of Soils,1994,17(3):212-218.
[42]Liu C X,Dong Y H,Sun Q W,et al. Soil bacterial community response to short-term manipulation of the nitrogen deposition form and dose in a Chinese fir plantation in southern China[J]. Water,Air,& Soil Pollution,2016,227(12):1-12.
[43]彭衛福.土壤肥力对水稻氮素利用效率和氮循环相关微生物的影响[D]. 南昌:江西农业大学,2017.
[44]万 盼,胡艳波,张弓乔,等. 甘肃小陇山油松与柴胡栽培土壤细菌群落特征[J]. 生态学报,2018,38(17):6016-6024.
[45]King D,Nedwell D B.The influence of nitrate concentration upon the end-products of nitrate dissimilation by bacteria in anaerobic salt marsh sediment[J]. FEMS Microbiology Letters,1985,31(1):23-28.
