小鼠IL-1Ra蛋白的原核表达及其多克隆抗体制备
2022-06-09战俊澎邹德颖常江杨馨郭珣张凯刘益辛胡盼卢士英李岩松柳增善任洪林
战俊澎 邹德颖 常江 杨馨 郭珣 张凯 刘益辛 胡盼 卢士英 李岩松 柳增善 任洪林

摘要:以小鼠脾脏cDNA为模板,用降落PCR扩增IL-1Ra基因片段,IL-1Ra基因片段长约为537 bp。将IL-1Ra扩增片段和原核表达载体pET-30a(+)连接构建重组表达质粒,在37 ℃诱导表达,重组表达的小鼠IL-1Ra蛋白的分子质量为19 ku。用纯度较好的小鼠IL-1Ra重组蛋白免疫兔子,制备特异性多克隆抗体;测定多克隆抗体的效价达到1 ∶4 096 000。经Western-Blot鉴定该抗体可与Raw264.7细胞中表达的小鼠IL-1Ra天然蛋白发生特异性结合。利用实时荧光定量PCR和Western-Blot检测表明布鲁氏菌S2弱毒株感染Raw264.7细胞(小鼠单核巨噬细胞)后小鼠IL-1Ra上调表达。本研究成功制备了小鼠IL-1Ra重组蛋白和兔抗多克隆抗体,为深入探讨小鼠IL-1Ra与布鲁氏菌感染之间的关系提供工具。
关键词:小鼠;IL-1Ra;原核表达;多克隆抗体;IL-1Ra重组蛋白
中图分类号:S858.91 文献标志码: A
文章编号:1002-1302(2022)09-0037-06
白介素-1(IL-1)家族是最早报道的细胞因子家族之一,由8个细胞因子(IL-1β、IL-1α、IL-18、IL-33、IL-36α、IL-36β、IL-36γ、IL-37)和3个受体拮抗剂(IL-1Ra、IL-36Ra、IL-38)组成[1]。IL-1Ra是IL-1的1个结构变体,与 IL-1R 结合的亲和力几乎与IL-1相同,但不能激活细胞[2-3]。尽管IL-1及IL-1Ra与 IL-1RⅠ 具有相似的亲和力,但是由于少数IL-1与IL-1RⅠ结合便足以完全激活细胞免疫应答,而且多数细胞中IL-1RⅠ表达水平较高,在表达 IL-1Ra 的细胞中至少需要100~1 000倍过量的IL-1Ra才能抑制50%的IL-1反应[4-5]。IL-1Ra 包括4个亚型,1个分泌型(sIL-Ra1)和3个胞内型(icIL-1Ra1、icIL-1Ra2、icIL-1Ra3),其中sIL-Ra1和icIL-1Ra1与IL-1R结合良好,而icIL-1Ra3与受体结合能力较弱[6]。IL-1Ra可以减轻被注射脂多糖(LPS)的兔子产生严重的低血压,并在免疫复合物诱导的炎症性肠病动物模型中减轻IL-1介导的肠道炎症和坏死,证明IL-1Ra在一些病理情况下有助于逆转IL-1所引起的炎症反应[7-8]。
IL-1β与IL-1Ra已经证明在维持肠道稳态,炎症性肠病(IBD)和炎症性结直肠癌(CRC)的发病机制中存在2种不同的甚至相反的功能[9-10]。过量的IL-1释放会引起严重的炎症反应及自身免疫类疾病[11]。而IL-1Ra重组蛋白与不同药物联用可以有效治疗一些疾病,目前IL-1Ra也可应用于基因治疗[12]。目前已有研究证明,IL-1Ra重组蛋白对治疗类风湿关节炎是有效果的[13]。笔者所在课题组前期通过构建布鲁氏菌强毒株、弱毒株感染绵羊白细胞层抑制性消减杂交(SSH)cDNA文库,筛选到2种差异表达的基因——IL-1β和 IL-1Ra,并证明了布鲁氏菌S2疫苗株与野毒株感染可引起这2个基因差异表达[14]。且目前国内外未见同时针对IL-1β及IL-1Ra与布鲁氏菌之间关系的研究报道,因此对IL-1Ra分子特征与生理病理功能的研究将有助于探究其与布鲁氏菌感染之间的关系。
本研究拟通过构建重组质粒pET-30a-Ra并进行原核表达,对重组蛋白进行纯化,免疫动物制备抗小鼠IL-1Ra重组蛋白的多克隆抗体,以期探究小鼠IL-1Ra与布鲁氏菌感染之间的关系。
1 材料与方法
试验在吉林大学人兽共患病研究所细菌实验室内进行,试验时间为2020年7月至2021年9月。
1.1 材料
布鲁氏菌S2弱毒株、原核表达载体pET-30a(+),大肠杆菌BL21(DE3)和大肠杆菌DH5α感受态细胞、Raw264.7细胞由笔者所在实验室保存;SPF级雌性兔子购自辽宁长生生物技术股份有限公司;TRIzol、反转录试剂盒,ES-Taq酶,DL2000 DNA maker,限制性内切酶NdeⅠ、XhoⅠ,T 4 DNA 連接酶和pMDTM18-T Vector Cloning Kit均购自TakaRa公司;质粒小提试剂盒和胶回收试剂盒购自天根生物科技(北京)有限公司;彩虹预染蛋白marker和M5 HiPer ECL Western HRP Substrate(超敏ECL发光液)购自北京聚合美生物科技有限公司;弗氏不完全和弗氏完全佐剂购自美国Sigma公司;TMB显色液A液和B液购自北京梅科万德生物科技有限公司;HRP标记的山羊抗兔IgG抗体购自安诺伦生物科技有限公司。
1.2 引物设计与合成
鼠源IL-1Ra基因的CDS序列(登录号:NM 001039701.3)来源于NCBI数据库。引物序列如下:上游引物,5′-GGAATTCCATATGCGCCCTTCTGGGAAAAGACCCTGCAAGATGCAAGCCTTCA-3′;下游引物,5′-CCGCTCGAGCTAATGGTGATGGTGATGATGTTGGTCTTCCTGGAAGTAGAACTT-3′(下划线部分分别为NdeⅠ和XhoⅠ酶切位点)。引物合成自吉林省库美生物科技有限公司。
1.3 目的片段的扩增
用TRIzol法提取小鼠脾脏总RNA,用反转录试剂盒反转录合成cDNA,-80 ℃分装,保存。以小鼠脾脏cDNA为模板,降落PCR扩增得到小鼠IL-1Ra基因的CDS区序列。PCR反应总体系为 20 μL:模板2 μL,2×Es Taq MasterMix(Dye) 10 μL,上下游引物各1 μL,ddH 2O 6 μL。降落PCR扩增程序为:95 ℃ 7 min;95 ℃ 1 min、72 ℃ 40 s、72 ℃ 1 min,每1个循环降低1 ℃,共23个循环;94 ℃ 1 min、60 ℃ 40 s、72 ℃ 1 min,共25个循环;72 ℃ 10 min。1.0%琼脂糖凝胶电泳验证产物正确后,用胶回收试剂盒回收目的片段。将纯化好的目的片段与pMD-18T载体连接后转化入DH5α感受态细胞,用西林瓶涂布于含有氨苄的LB固体平板上,37 ℃培养12 h后挑取单个菌落进行菌液PCR鉴定,将鉴定正确的菌株送去测序,鉴定正确的质粒命名为pMD-18T-Ra。3C7D4F95-0118-493B-927E-EE6BECA5C702
1.4 pET-30a-Ra重组质粒的構建
从测序正确的重组菌株和保种的pET-30a(+)菌株中提取质粒。将pMD-18T-Ra质粒和 pET-30a(+) 空质粒分别用NdeⅠ和XhoⅠ这2种限制性核酸内切酶在37 ℃进行双酶切5 h,利用T 4 DNA连接酶将IL-1Ra与pET-30a(+)载体 16 ℃ 过夜连接,连接产物转化至DH5α感受态细胞,用西林瓶涂布于含有卡那霉素的LB固体平板上,37 ℃培养12 h后挑取单个菌落进行菌液PCR鉴定,取正确的重组质粒进一步用NdeⅠ和xhoⅠ进行双酶切验证,将鉴定正确的菌液送去测序,将正确的质粒命名为pET-30a-Ra。
1.5 IL-1Ra重组蛋白的诱导表达及可溶性分析
将重组克隆质粒pET-30a-Ra转入BL21(DE3)感受态细胞中,用西林瓶涂布于含有卡那霉素的LB固体平板上,挑取单克隆菌株,接种于LB液体培养基中培养并测序。小鼠IL-1Ra表达菌分别在37 ℃和16 ℃,加入终浓度为1 mmol/L异丙基硫代半乳糖苷(IPTG)对菌液进行诱导表达。一段时间后收集菌体重悬(缓冲液:50 mmol/L Tris-HCl(pH值7.6)、10%甘油、0.5 mol/L NaCl、10 mmol/L咪唑)后并超声破碎,分别对上清和包涵体进行聚丙烯酰氨凝胶(SDS-PAGE)电泳,分析目的蛋白表达形式,确定目的蛋白上清表达的最佳表达条件。
1.6 IL-1Ra重组蛋白的纯化
将pET-30a-Ra阳性菌液以1 ∶100接种至 1 L 含卡那霉素的液体LB培养基中,按照“1.5”节诱导表达步骤进行诱导表达。超声破碎后的细菌裂解液12 000 r/min离心40 min,取上清与 Ni-NTA Beads 于4 ℃孵育结合1 h,分别用含有不同咪唑浓度(40、60、80、150、250 mmol/L)的洗脱缓冲液(50 mmol/L Tris-HCl(pH值7.6)、10%甘油、0.5 mmol/L NaCl、10 mmol/L咪唑)进行梯度洗脱,分别收集洗脱液进行SDS-PAGE电泳鉴定,以确定将目的蛋白洗脱下来的缓冲液咪唑浓度。纯化好的蛋白装进透析袋中,在磷酸缓冲盐溶液(PBS缓冲液)中24 h内透析4次,PEG2000浓缩后用BCA标准蛋白试剂盒检测蛋白浓度为1.2 mg/mL。
1.7 多克隆抗体制备
免疫前耳缘静脉采集阳性血清,将重组IL-1Ra蛋白采用背部皮下多点注射的方式免疫新西兰大白兔,每次间隔7 d,共免疫5次。初次免疫时800 μg重组蛋白与弗氏完全佐剂等体积混合均匀,之后的加强免疫用400 μg重组蛋白与弗氏不完全佐剂等体积混匀,5次免疫后3 d耳缘静脉采集血液分离血清。
1.8 多克隆抗体效价的测定
采用间接酶联免疫吸附试验(ELISA)测定采集分离血清中的抗体效价。用重组IL-1Ra蛋白 5 μg/mL 100 μL/孔包被ELISA酶标板,37 ℃培养箱包被2 h;PBST洗涤3次,5%脱脂乳(5 g脱脂奶粉溶解于100 mL PBST中) 200 μL/孔,37 ℃封闭 1 h;PBST洗涤3次,将兔抗IL-1Ra多克隆抗体进行倍比稀释,免疫前血清作为对照的阴性血清,100 μL/孔,37 ℃孵育1 h;PBST洗涤3次,HRP标记的山羊抗兔IgG抗体1 ∶4 000倍稀释,100 μL/孔,37 ℃孵育1 h;PBST洗涤3次,将TMB显色A液和B液等体积混合,100 μL/孔,37 ℃避光 8 min,加入终止液,50 μL/孔,立即使用酶标仪450 nm波长处测量D值。
1.9 多克隆抗体反应原性鉴定
收集Raw264.7细胞沉淀,用混合好的RIPA裂解液(1%PMSF)裂解细胞,4 ℃ 10 000 r/min 离心10 min,吸取上清后加入蛋白上样缓冲液,煮沸 10 min,经SDS-PAGE电泳后转印至聚偏二氟乙烯(PVDF)膜上,将PVDF浸没在5%脱脂乳(5 g脱脂奶粉溶解于100 mL TBST中)中在水平摇床上室温封闭2 h,将多克隆抗体1 ∶500倍稀释作为一抗,4 ℃ 过夜孵育,TBST洗涤3次,每次10 min;HRP标记山羊抗兔IgG抗体1 ∶5 000倍稀释作为二抗,室温孵育1 h,TBST洗涤4次,每次10 min;超敏ECL发光液显色。
1.10 布鲁氏菌S2弱毒株感染宿主细胞后对小鼠IL-1Ra表达的影响
以细胞数 ∶细菌数=1 ∶100的剂量感染Raw264.7细胞,并以PBS组为对照组,收集0、4、8、12、24 h样品,用qPCR检测小鼠IL-1Ra基因的mRNA水平变化,用蛋白质印迹法(Western-Blot)检测小鼠IL-1Ra蛋白表达水平变化。引物序列见表1。PCR扩增程序:95 ℃ 2 min;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 32 s,共40个循环,每个样本设置3个重复孔。采用2-ΔΔC T法对试验结果进行统计分析。
1.11 统计分析
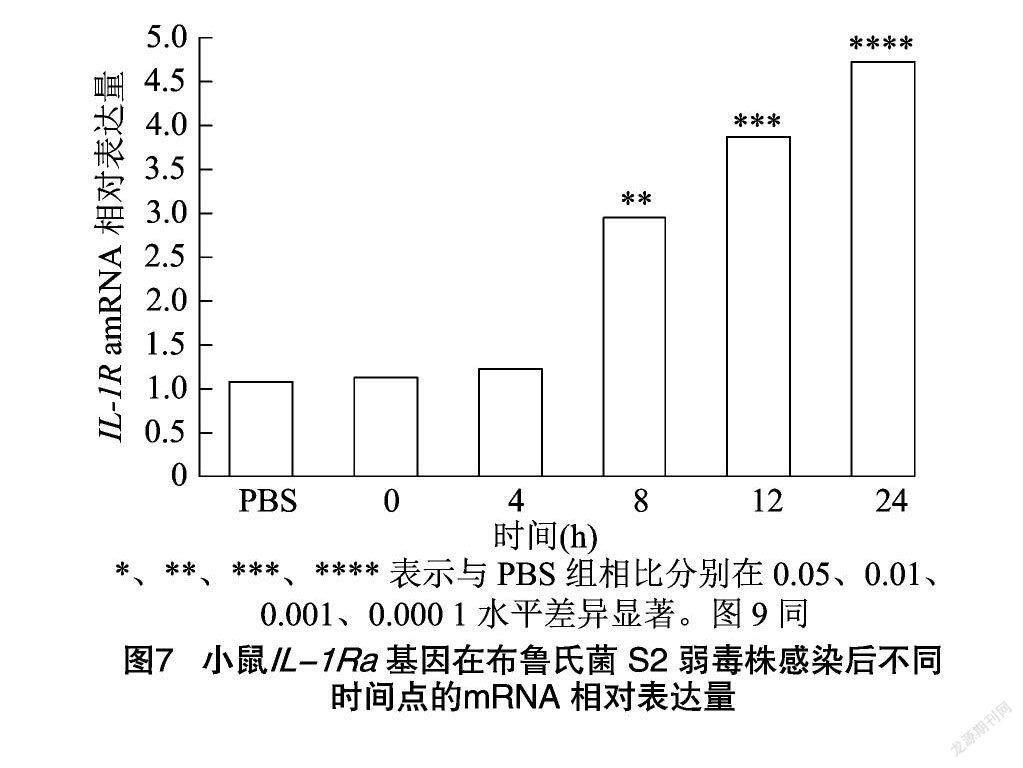
采用GraphPad Prism 7.0软件进行统计学分析,P<0.05、P<0.01、P<0.001、P<0.000 1分别表示在0.05、0.01、0.001、0.000 1水平差异显著,分别用*、**、***、****表示。
2 结果与分析
2.1 小鼠IL-1Ra基因扩增
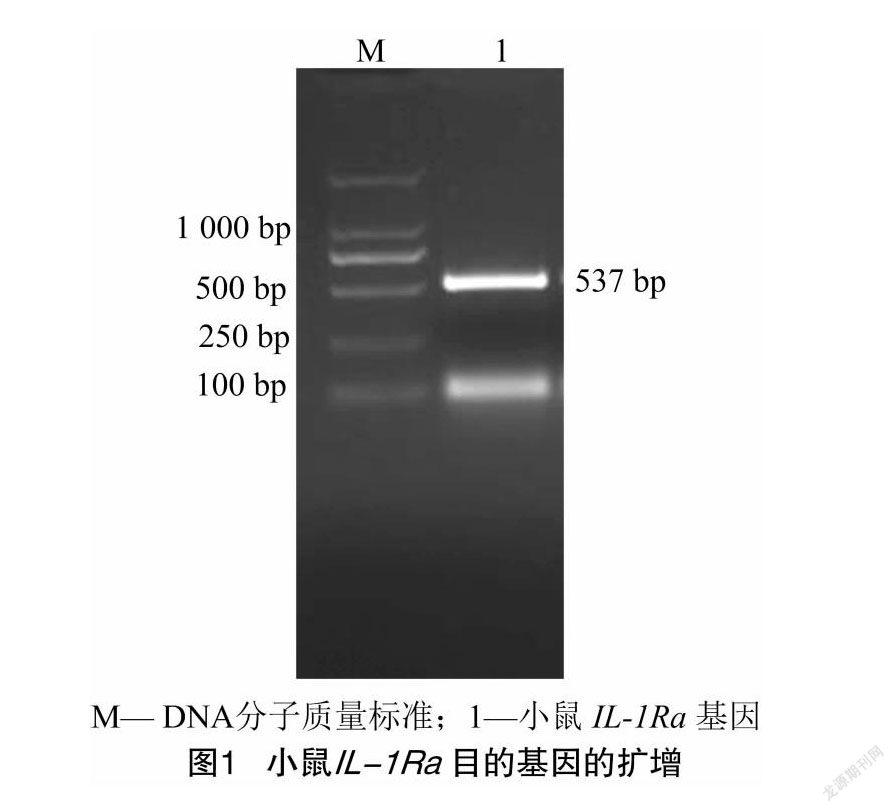
琼脂糖凝胶电泳显示,在537 bp处有明亮的条带(图1),与预期大小相符。
2.2 pET-30a-Ra重组质粒的构建
对重组质粒pET-30a-Ra经NdeⅠ和XhoⅠ进行双酶切鉴定,可以看到1条5 400 bp的条带和1条537 bp 的条带(图2),片段大小符合预期,经测序表明重组质粒与目的基因序列比对完全一致,证明pET-30a-Ra原核表达载体构建成功。3C7D4F95-0118-493B-927E-EE6BECA5C702
2.3 IL-1Ra重组蛋白的诱导表达
从图3可以看出,重组蛋白在37、 16 ℃均能诱导表达且重组蛋白在上清中的表达量都高于包涵体, 但是37 ℃时重组蛋白的表达量高,因此诱导条件确定为终浓度1 mmol/L IPTG,37 ℃诱导 8 h,此时重组蛋白主要以上清形式表达,分子量约为19 ku。
2.4 IL-1Ra重组蛋白的纯化
SDS-PAGE结果显示,用40 mmol/L咪唑洗3遍后再用60 mmol/L咪唑洗2遍,对杂蛋白的洗涤效果最好,最后用250 mmol/L咪唑可以将重组蛋白完全洗脱下来,此时重组蛋白的纯度较好(图4)。
2.5 多克隆抗体的制备及抗体效价的测定
利用纯化的IL-1Ra重组蛋白免疫兔子制备多克隆抗体,采用间接ELISA法测定5次免疫后多克隆抗体的效价已经达到1 ∶4 096 000(图5),表明纯化的IL-1Ra重组蛋白能够诱导新西兰大白兔产生高效价的抗体。
2.6 多克隆抗体反应原性鉴定
Western-Blot 结果显示,制备的多克隆抗体能够很好地识别Raw264.7中表达的天然IL-1Ra蛋白(图6),该抗体可以用于检测布鲁氏菌感染Raw264.7细胞后IL-1Ra蛋白的变化。
2.7 布鲁氏菌S2弱毒株感染宿主细胞后对小鼠IL-1Ra表达的影响
运用qPCR技术检测不同时间点小鼠IL-1Ra基因mRNA表达水平变化,与PBS组相比,8、12、24 h 小鼠IL-1Ra基因表达量显著升高,在24 h时达到峰值(图7)。Western-Blot检测结果发现,与PBS组相比,4、8、12、24 h小鼠IL-1Ra蛋白的表达量均显著升高,其上升趋势与mRNA转录结果一致,与预期结果相符(图8、图9)。
3 讨论与结论
IL-1与IL-1Ra的平衡在炎症性肠病(IBD)中起重要作用,在疾病早期IL-1就在结肠中产生,且IL-1水平与组织炎症程度相关,在炎症消退之前,结肠中IL-1Ra的水平是IL-1的10倍[15]。在该动物模型中,加入IL-1Ra的中和抗体会导致炎症延长和死亡率增加,表明了内源性IL-1Ra抗炎的重要性,且外源加入IL-1Ra重组蛋白可以抑制炎症[16-17]。大量IBD动物模型的研究表明,IL-1 和IL-1Ra的差异表达与IBD之间存在一定的相关性,且随着病情的好转,IL-1、IL-1Ra表达异常也得到缓解。笔者所在课题组前期通过构建布鲁氏菌强毒株、弱毒株感染绵羊白细胞层抑制性消减杂交(SSH)cDNA文库,筛选到差异表达基因IL-1β与IL-1Ra[12],并且建立了IL-1β及其拮抗因子的荧光定量PCR检测方法[18],双荧光ELISA检测方法[19]和双T线胶体金免疫层析试纸条检测方法[20],初步探讨了IL-1β与IL-1Ra之间关系对布鲁氏菌病自然感染与疫苗免疫的鉴别诊断作用,提示 IL-1Ra 与布鲁氏菌感染之间可能存在某种联系。因此,为了建立区别鉴定布鲁氏菌病自然感染与疫苗免疫的检测方法,掌握IL-1Ra分子特征与生理病理功能至关重要。
本研究针对小鼠的IL-1Ra基因构建了原核表达重组质粒pET-30a-Ra,成功获得了可溶性表达的小鼠IL-1Ra重组蛋白,通过镍柱纯化后,经 SDS-PAGE 验证获得纯度较好的重组蛋白。将纯化后的重组蛋白作为免疫原免疫兔子获得多克隆抗体,经间接ELISA测定,兔抗多克隆抗体效价能够达到1 ∶4 096 000,经过Western-Blot检测结果表明,多克隆抗体能够特异性识别Raw264.7细胞中表达的天然IL-1Ra蛋白,可用于检测布鲁氏菌弱毒株感染Raw264.7细胞后小鼠IL-1Ra的表达水平,为进一步研究小鼠IL-1Ra与布鲁氏菌感染的关系提供了良好的试验材料。
参考文献:
[1]Garlanda C,Dinarello C A,Mantovani A.The interleukin-1 family:back to the future[J]. Immunity,2013,39(6):1003-1018.
[2]Arend W P. Interleukin-1 receptor antagonist[M]//Advances in immunology Volume 54.Amsterdam:Elsevier,1993:167-227.
[3]Arend W P,Malyak M,Guthridge C J,et al. Interleukin-1 receptor antagonist:role in biology[J]. Annual Review of Immunology,1998,16:27-55.
[4]Benedetti F,Dallaspezia S,Melloni E M T,et al. Effective antidepressant chronotherapeutics (sleep deprivation and light therapy) normalize the IL-1β:IL-1ra ratio in bipolar depression[J]. Frontiers in Physiology,2021,12:740686.
[5]郭 興. 绵羊白介素1β及其受体拮抗因子全长cDNA克隆、分子特性及差异表达分析[D]. 长春:吉林大学,2015:6.
[6]Haskill S,Martin G,van Le L,et al. cDNA cloning of an intracellular form of the human interleukin 1 receptor antagonist associated with epithelium[J]. Proceedings of the National Academy of Sciences of the United States of America,1991,88(9):3681-3685.3C7D4F95-0118-493B-927E-EE6BECA5C702
[7]Muro M,Mrowiec A. Interleukin (IL)-1 gene cluster in inflammatory bowel disease:is IL-1RA implicated in the disease onset and outcome?[J]. Digestive Diseases and Sciences,2015,60(5):1126-1128.
[8]水一鸣,刘楠楠,郭 兴,等. 羊IL-1Ra基因全长cDNA克隆及生物信息学分析[J]. 中国畜牧兽医,2018,45(3):598-603.
[9]Arend W P. The balance between IL-1 and IL-1Ra in disease[J]. Cytokine & Growth Factor Reviews,2002,13(4/5):323-340.
[10]Aksentijevich I,Masters S L,Ferguson P J,et al. An autoinflammatory disease with deficiency of the interleukin-1-receptor antagonist[J]. The New England Journal of Medicine,2009,360(23):2426-2437.
[11]Horai R,Saijo S,Tanioka H,et al. Development of chronic inflammatory arthropathy resembling rheumatoid arthritis in interleukin 1 receptor antagonist-deficient mice[J]. The Journal of Experimental Medicine,2000,191(2):313-320.
[12]Saad K,Abdallah A E M,Abdel-Rahman A A,et al. Polymorphism of interleukin-1β and interleukin-1 receptor antagonist genes in children with autism spectrum disorders[J]. Progress in Neuro-Psychopharmacology and Biological Psychiatry,2020,103:109999.
[13]Altomare A,Corrado A,Maruotti N,et al. The role of Interleukin-1 receptor antagonist as a treatment option in calcium pyrophosphate crystal deposition disease[J]. Molecular Biology Reports,2021,48(5):4789-4796.
[14]唐 峰. 布鲁氏菌强弱毒株感染羊白细胞层SSH cDNA文库建立及CD96分子初步研究[D]. 长春:吉林大学,2013.
[15]Dionne S,Hiscott J,DAgata I,et al. Quantitative PCR analysis of TNF-α and IL-1β mRNA levels in pediatric IBD mucosal biopsies[J]. Digestive Diseases and Sciences,1997,42(7):1557-1566.
[16]Isaacs K L,Sartor R B,Haskill S.Cytokine messenger RNA profiles in inflammatory bowel disease mucosa detected by polymerase chain reaction amplification[J]. ZooKeys,1992,103(5):1587-1595.
[17]Harrell C R,Markovic B S,Fellabaum C,et al. The role of Interleukin 1 receptor antagonist in mesenchymal stem cell-based tissue repair and regeneration[J]. BioFactors,2020,46(2):263-275.
[18]水一鳴. IL-1β和IL-1Ra双荧光ELISA检测方法的建立及其初步应用[D]. 长春:吉林大学,2018.
[19]迟 丹. 绵羊白介素1β及其受体拮抗因子荧光定量PCR检测方法的建立与应用[D]. 长春:吉林大学,2016.
[20]鞠丹迪. IL-1Ra/IL-1β试纸条检测方法建立及其在布鲁氏菌病感染与免疫鉴别诊断中的应用探讨[D]. 长春:吉林大学,2019.3C7D4F95-0118-493B-927E-EE6BECA5C702
