抗血管内皮生长因子治疗糖尿病黄斑水肿患者短期疗效影响因素分析△
2022-06-07贺梦霞陈祉帆孟倩丽
贺梦霞 崔 颖 谢 洁 黄 天 陈祉帆 孟倩丽
至2021年,我国约有1.41亿糖尿病患者[1],位居全世界首位;糖尿病患者中约34.6%合并糖尿病性视网膜病变(DR),6.81%合并糖尿病黄斑水肿(DME)[2]。目前认为,长期高血糖状态引起氧化应激、晚期糖基化终末产物形成和蛋白激酶C激活,促使VEGF表达上调、内皮细胞和周细胞丢失以及基底膜毛细血管通透性增加,继而导致炎症反应及视网膜血流受损,引起视网膜缺氧和血-视网膜屏障破坏,最终导致黄斑水肿[3]。DME可导致视力下降,严重影响患者的视觉和生活质量,因此,探寻其有效治疗方法及其相关影响因素成为研究焦点。目前DME治疗方法主要包括视网膜激光光凝术、玻璃体内注射抗血管内皮生长因子(VEGF)或皮质类固醇药物等[4]。多项大型临床研究已证实,抗VEGF治疗能为DME患者带来更多的视力获益[5-6],但临床应用中发现,23%~66%的DME患者在抗VEGF治疗后黄斑水肿仍持续存在,视网膜解剖结构及视功能均未能获得较好改善,提示个体间不同的全身或眼部因素可能影响抗VEGF治疗DME的效果[7-11]。
既往研究发现,全身或眼部的诸多因素与DME的发生发展、形态结构以及治疗效果等相关[8,12-18]。载脂蛋白B/载脂蛋白A比值(ApoB/ApoA)等与DME的发生发展相关[12];血红蛋白(Hb)浓度和红细胞计数(RBC)等与DME患者特定的影像学形态改变有关[13];糖化血红蛋白水平(HbA1c)、基线黄斑中心凹下视网膜厚度(CMT)、浆液性视网膜脱离(SRD)、高反射点(HF)、椭圆体区(EZ)及外界膜(ELM)的破坏、视网膜内层结构紊乱(DRIL)等与抗VEGF疗效有关[8,14-18]。然而,由于各研究存在所纳入的观察指标欠客观全面、观察时间不一致、观察结果不尽相同等不足,限制了其进一步的临床应用。因此,本研究拟通过收集患者一般信息、全身和眼部病史及相关检查指标,进行单因素及二元logistic回归分析,探讨影响抗VEGF治疗DME患者短期疗效的相关因素。
1 资料与方法
1.1 一般资料回顾性分析。收集2017年1月至2021年4月于广东省人民医院眼科就诊的DME患者的临床资料。纳入标准:(1)经眼底彩色照相、OCT或者荧光素眼底血管造影(FFA)检查诊断为DME并接受玻璃体内注射抗VEGF治疗的患者(抗VEGF药物包括雷珠单抗、康柏西普和阿柏西普);(2)OCT测量CMT≥300 μm。排除标准:(1)合并有视网膜静脉阻塞、老年性黄斑变性、青光眼等其他眼病者;(2)既往2个月内接受过白内障手术者;(3)既往3个月内接受过抗VEGF治疗者;(4)屈光间质明显混浊影响OCT检查或结果判读者;(5)接受血液透析等治疗导致生化结果不稳定者。最终纳入67例(67眼)患者的临床资料。其中,男40例40眼,女27例27眼。年龄19~86(57.03±12.38)岁。本研究符合《赫尔辛基宣言》原则,通过广东省人民医院医学研究伦理委员会批准,患者均知情同意。
1.2 方法
1.2.1 一般信息患者基本信息包括年龄、性别、收缩压(SBP)、舒张压(DBP)、体重。相关病史主要包括糖尿病(糖尿病类型、病程及治疗方式)、高血压、高血脂及糖尿病肾病史,既往眼部治疗史[如玻璃体切割术(PPV)、玻璃体内药物注射术(IVI)、视网膜激光光凝术、白内障手术史等]以及此次发病时视力下降的时间等。
1.2.2 眼部指标所有患者均进行以下检查:(1)采用国际标准视力表测量患者最佳矫正视力(BCVA),并转换为logMAR视力;(2)采用NT-2000自动非接触式眼压测量仪(日本NIDEK公司)进行眼压测量,测量3次取平均值;(3)OCT相关影像学指标:采用SPECTRALIS OCT 仪器(德国海德堡公司)在黄斑区进行线性扫描及容积扫描,测量CMT、黄斑中心凹1 mm直径范围内的视网膜平均厚度(1 mm CMT)、黄斑中心凹1 mm直径范围内的视网膜体积(1 mm TMV),并根据图像记录以下指标:黄斑前膜(ERM)、SRD、DRIL、EZ及ELM的破坏、HF、中心凹外翻、中心凹锥突(FB)、外核层长度(ONL)、感光细胞内节长度(IS)、感光细胞外节长度(OS);(4)DME分型[19]:1型为海绵样视网膜增厚(DRT),2型为黄斑囊样水肿(CME)或CME+DRT,3型为SRD、SRD+CME或SRD+CME+DRT;(5)依据FFA和眼底彩色照相对DR进行分期(2019年国际DR临床分级标准[20]):轻度非增生型DR(NPDR)、中度NPDR、重度NPDR、增生型DR(PDR)。
1.2.3 血液检查指标收集患者以下血液学指标:HbA1c、空腹血糖、白细胞计数(WBC)、RBC、Hb、红细胞压积、血小板计数、中性粒细胞计数(NEUT)、淋巴细胞计数、单核细胞计数、中性粒细胞/白细胞比值、中性粒细胞/淋巴细胞比值、血小板计数/淋巴细胞比值、单核细胞/淋巴细胞比值、血小板分布宽度、平均血小板体积、血小板压积、纤维蛋白原、血浆凝血酶时间、ApoA、ApoB 、ApoB/ApoA、脂蛋白、血清白蛋白、总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、血肌酐、尿素氮、肾小球滤过率、尿酸、尿微量白蛋白、尿蛋白肌酐比、尿白蛋白肌酐比、C反应蛋白、总25-羟基维生素D。
1.2.4 分组分别根据黄斑水肿消退程度和视力改善情况进行分组和评估。抗VEGF治疗后1个月CMT、1 mm CMT或1 mm TMV分别降低≥30%为黄斑水肿疗效达标,反之为未达标;BCVA提高1行及以上为视力疗效达标,反之为未达标。
1.3 统计学处理使用SPSS 25.0进行统计学分析。使用Shapiro-Wilk对数据进行正态性检验,所有计量资料符合正态分布者采用独立样本t检验,以均数±标准差表示,不符合正态分布者采用秩和检验,以中位数(上、下四分位数)表示。计数资料用卡方检验和Fisher精确检验,以率(%)表示。单因素分析中P<0.05及有临床意义的指标代入二元logistic回归中分析,同时校正年龄、性别,得出抗VEGF治疗DME患者的短期疗效的独立影响因素,以比值比(OR)及95%置信区间(CI)表示。检验水准:α=0.05。
2 结果
2.1 疗效达标组和疗效未达标组患者的基线特征如表1~4所示,分别在基于CMT、1 mm CMT、1 mm TMV和视力的分组中,疗效达标组和疗效未达标组患者的年龄、性别、SBP、DBP、体重、PPV史、IVI史、视网膜激光光凝史、白内障手术史、糖尿病类型、糖尿病病程及治疗方式、高血压史、高血脂史、糖尿病肾病史之间差异均无统计学意义(均为P>0.05)。在基于CMT、1 mm CMT和1 mm TMV的分组中,疗效达标组与疗效未达标组患者的视力下降时间差异均无统计学意义(均为P>0.05)。在基于视力的分组中,视力下降时间与治疗后视力改善有关(P<0.05)。
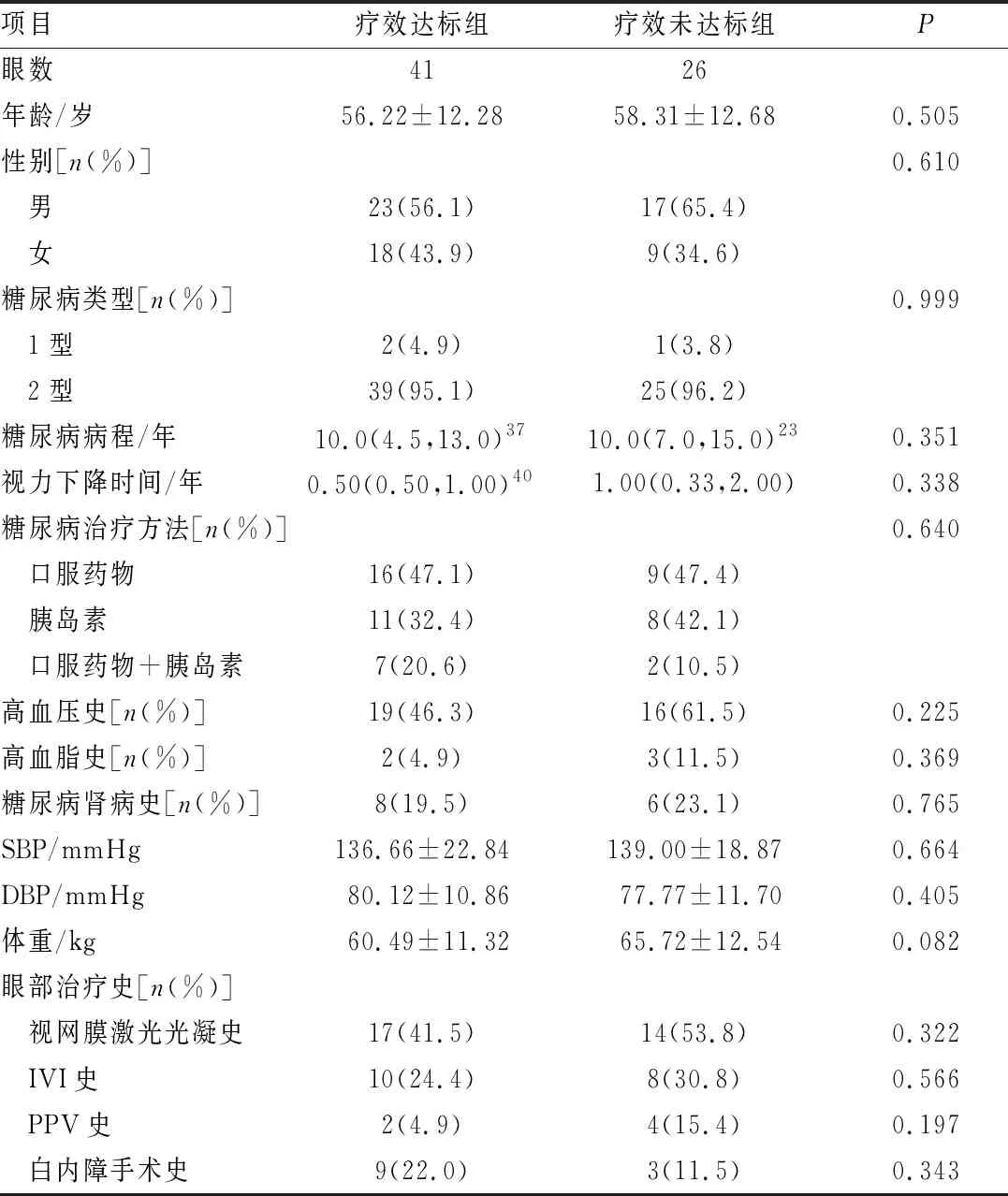
表1 基于CMT的疗效达标组与疗效未达标组患者的基线资料对比
2.2 影响DME患者抗VEGF治疗后短期疗效的单因素分析结果如表5所示,在基于CMT的分组中,EZ破坏、SRD、OS、基线CMT、基线1 mm CMT、基线1 mm TMV均与治疗后黄斑水肿消退有关(均为P<0.05)。在基于1 mm CMT的分组中,EZ破坏、ELM破坏、基线CMT、基线1 mm CMT、基线1 mm TMV、基线BCVA、WBC、Hb、红细胞压积、NEUT、ApoB/ApoA均与治疗后黄斑水肿消退有关(均为P<0.05)。在基于1 mm TMV的分组中,EZ破坏、ELM破坏、OS、基线CMT、基线1 mm CMT、基线 1 mm TMV、基线BCVA、RBC、Hb、红细胞压积、ApoB/ApoA均与治疗后黄斑水肿消退有关(均为P<0.05)。在基于视力的分组中,基线OCT相关影像学指标、血常规、血脂均与治疗后视力改善无关(均为P>0.05)。
2.3 影响DME患者抗VEGF治疗后短期疗效的二元logistic回归分析结果如表6所示,在基于CMT的分组中,基线1 mm CMT薄是黄斑水肿消退未达标的独立影响因素。在基于1 mm CMT的分组中,基线1 mm TMV小、WBC低及Hb高是黄斑水肿消退未达标的独立影响因素。在基于1 mm TMV的分组中,基线1 mm TMV小及RBC高是黄斑水肿消退未达标的独立影响因素。在基于视力的分组中,视力下降时间长及基线BCVA低是视力改善未达标的独立影响因素。图1为以CMT、1 mm CMT、1 mm TMV和视力为标准分组所建立的ROC曲线及相对应的AUC值。
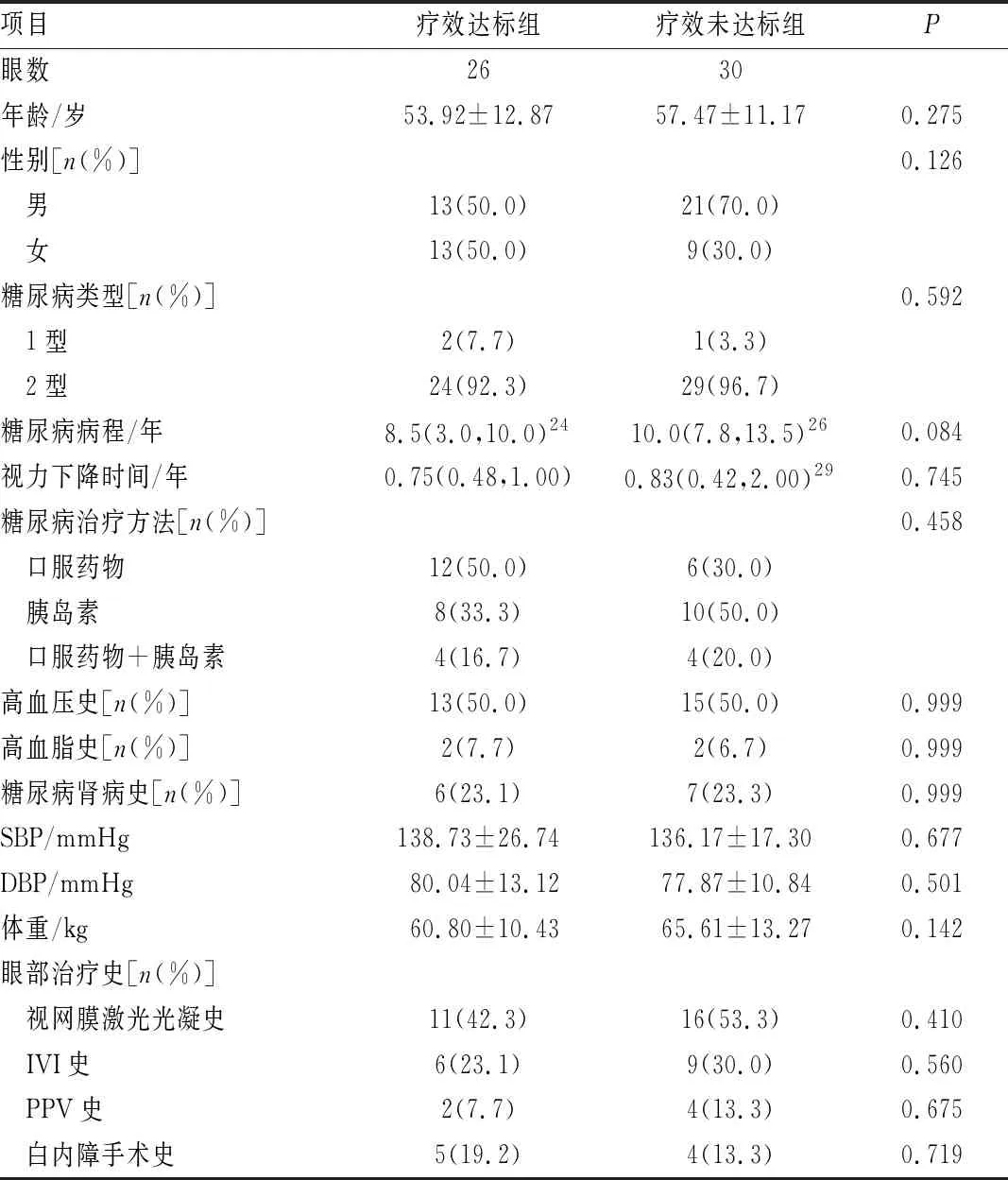
表2 基于1 mm CMT的疗效达标组与疗效未达标组患者的基线资料对比
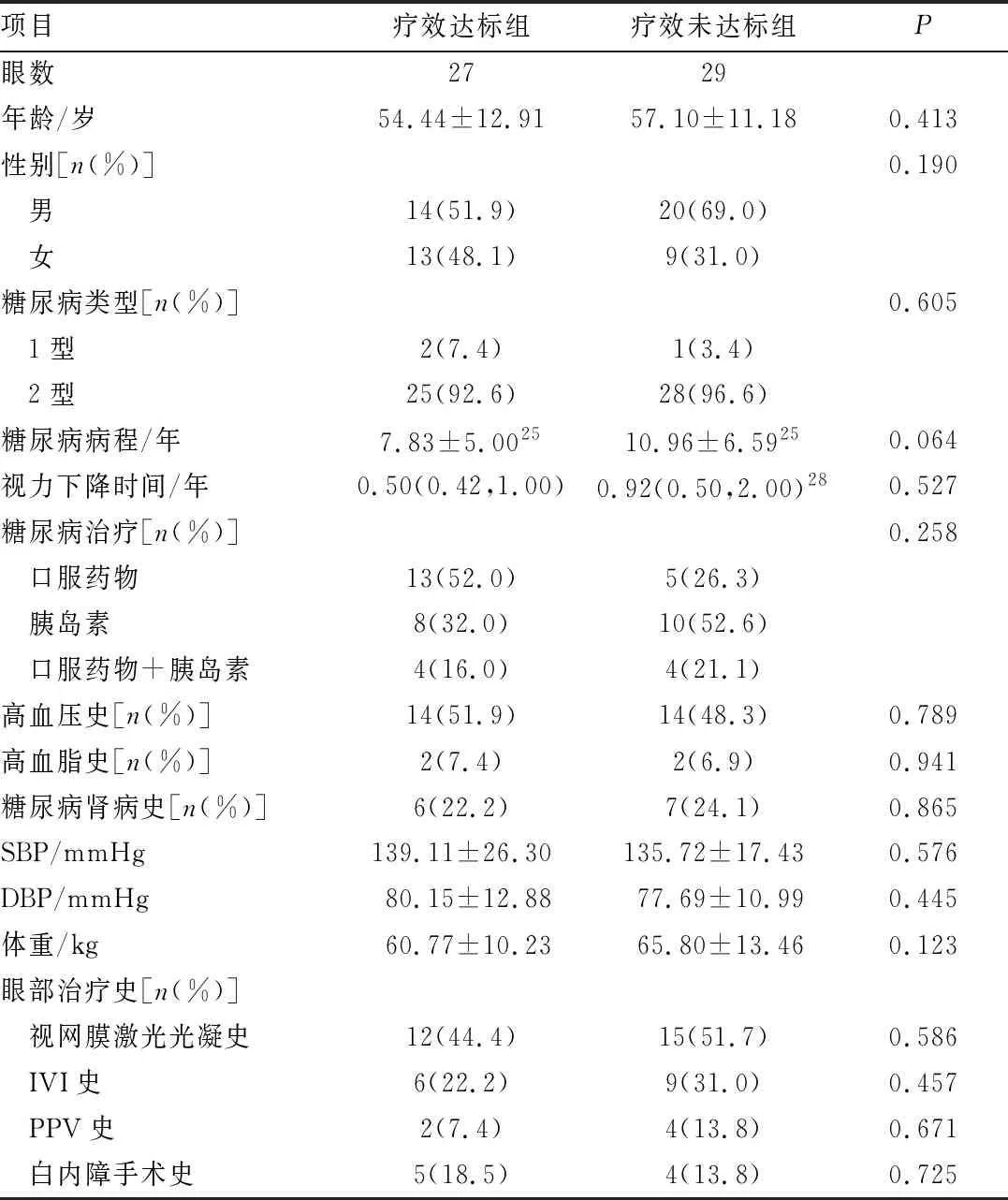
表3 基于1 mm TMV的疗效达标组与疗效未达标组患者的基线资料对比
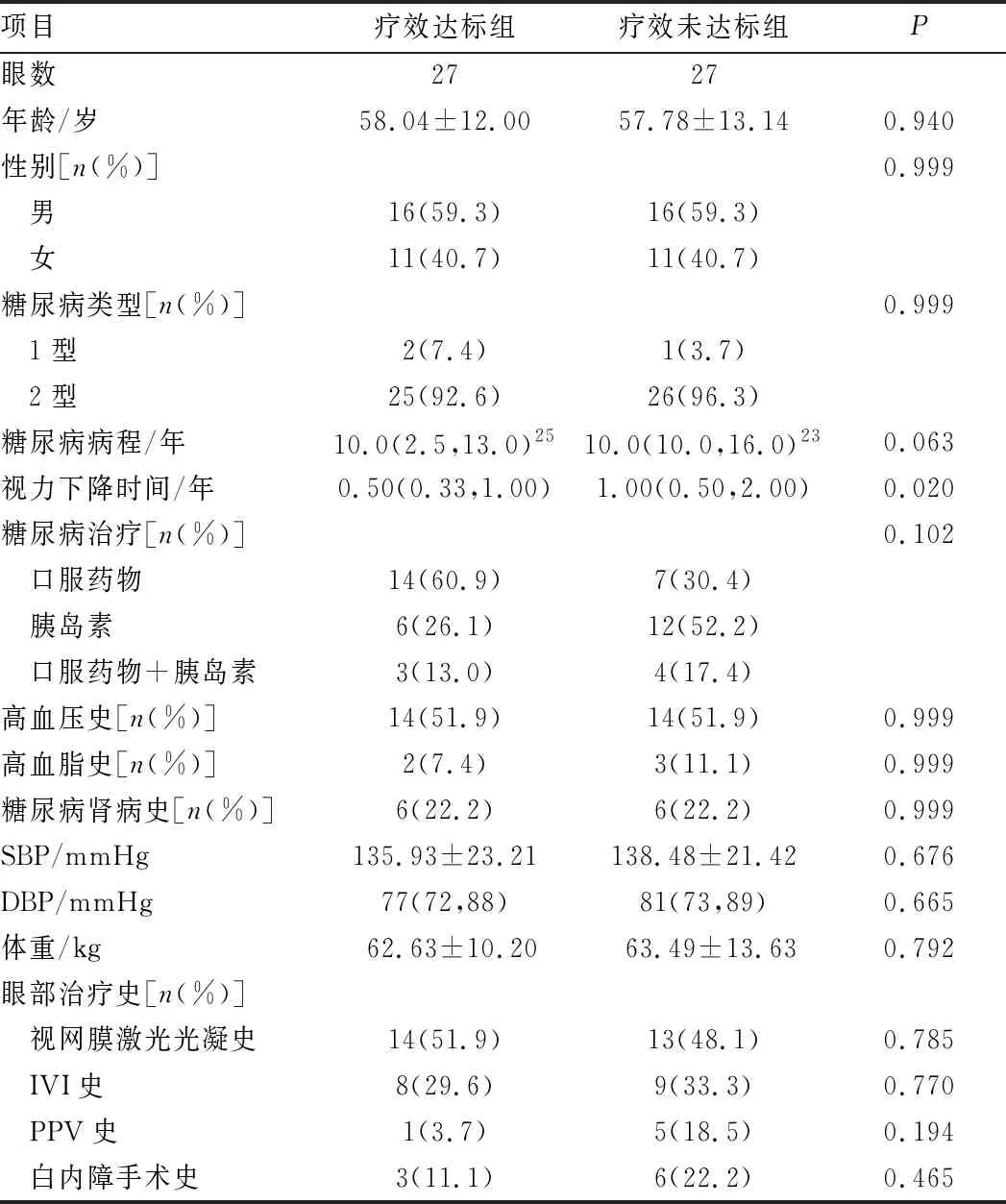
表4 基于视力的疗效达标组与疗效未达标组患者的基线资料对比

表6 影响DME患者抗VEGF治疗后短期疗效的二元logistic回归分析结果
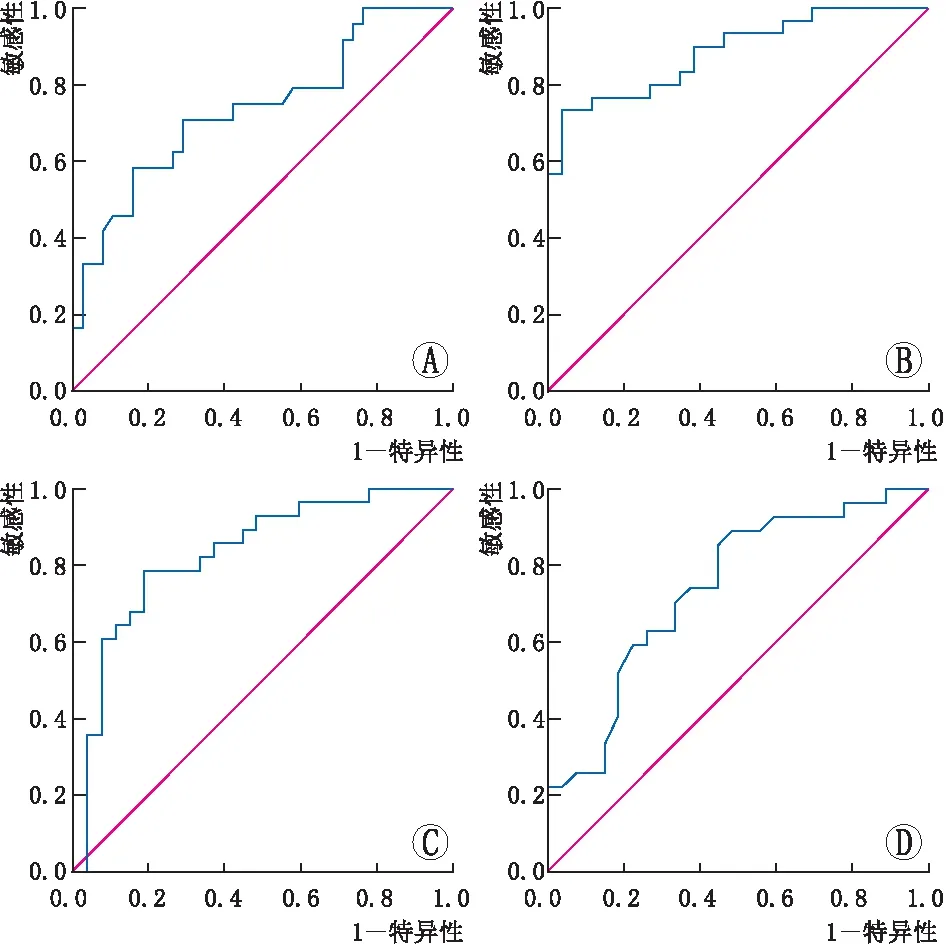
图1 依据各分组指标建立的ROC曲线 A:基于CMT的分组,AUC=0.738;B:基于1 mm CMT的分组,AUC=0.885;C:基于1 mm TMV的分组,AUC=0.832;D:基于BCVA的分组,AUC=0.742。
3 讨论
本研究分别以黄斑水肿消退程度和视力改善情况为标准进行分组比较,较全面详细地分析了影响抗VEGF治疗DME疗效的相关因素。其中,在以黄斑水肿消退程度为标准的分组中,我们纳入了CMT、1 mm CMT和1 mm TMV来判断疗效。1 mm CMT是黄斑中心凹1 mm直径范围内的视网膜平均厚度,显示了该区域黄斑水肿的平均厚度,与单纯测量一个点的CMT比较,可以较准确地反映黄斑中心凹1 mm直径范围的水肿程度。1 mm TMV是黄斑中心凹1 mm直径范围内的视网膜体积,显示了该区域黄斑水肿的体积,与单纯测量CMT或1 mm CMT相比,从三维层面更准确地反映黄斑水肿的程度。既往研究发现,基线CMT或1 mm CMT较薄是抗VEGF治疗DME后黄斑水肿消退不佳的独立影响因素[21-22],这与我们的分析结果一致。但目前尚未检索到评价1 mm TMV对DME疗效影响的相关研究。Elman等[9]研究发现,与单独即时激光治疗相比,雷珠单抗或曲安奈德联合激光治疗后患者CMT和TMV下降更明显。基于此,我们同时分析了患者基线黄斑区视网膜厚度(CMT、1 mm CMT)和体积(1 mm TMV)对DME疗效的影响。本研究二元logistic回归分析结果显示,基线1 mm CMT薄、1 mm TMV小是抗VEGF治疗后黄斑水肿消退不佳的独立影响因素。此外,所建立的ROC曲线显示,基于1 mm CMT及1 mm TMV分组的AUC值均较高,提示1 mm CMT与1 mm TMV可能较准确地反映了黄斑中心凹周围水肿程度的变化。因此我们推测,1 mm CMT及1 mm TMV可能是更有利于判断DME患者黄斑水肿消退效果的OCT指标。
既往研究发现,EZ破坏与RBC减少、Hb降低有关[13]。本研究结果显示,黄斑水肿消退达标组的患者基线EZ破坏较多,RBC和Hb减少较显著。二元logistic回归分析结果显示,RBC减少、Hb降低及WBC增加是抗VEGF治疗后黄斑水肿显著消退的独立影响因素。血红蛋白是存在于红细胞内的色素蛋白,而红细胞的主要生理功能是通过血红蛋白来实现的。当红细胞数量减少时,血红蛋白含量降低,携氧能力下降。有研究表明,红细胞减少与糖尿病患者的微血管并发症比例增加及糖尿病病程长有关[23-24]。长期慢性高血糖会导致红细胞膜蛋白的非酶糖基化,减少表面负电荷[25]。红细胞电荷的减少可能与视网膜基底膜特性有关,所产生的变化可能导致血-视网膜屏障的破坏,从而导致毛细血管通透性增加以及液体渗漏到视网膜各层[26],因此红细胞减少可能预示更严重的DME。白细胞是人体免疫系统的重要组成部分,DME患者白细胞水平升高可能提示慢性高血糖诱导炎症细胞因子大量释放,引发较严重的炎症反应[27]。因此我们推测,基线水平较重的DME对抗VEGF治疗所产生的应答更显著。
有研究发现,DME病程长、基线BCVA较低的患者抗VEGF治疗后视力改善不佳[22,28],这与我们的研究结果基本一致。本研究二元logistic回归分析结果显示,视力下降时间长、基线BCVA低是抗VEGF治疗后视力改善不佳的独立影响因素。这可能是由于长期的高血糖状态加重血-视网膜屏障破坏,致使黄斑区结构和功能较难恢复[3,27]。
综上所述,基线1 mm CMT薄、1 mm TMV小、WBC低、Hb高、RBC高、视力下降时间长、基线BCVA低是DME患者抗VEGF治疗后短期疗效不佳的独立影响因素。因此,临床中或许可以根据患者病程、血常规、视力和OCT检查相关的简单、客观的指标来评估抗VEGF治疗DME的效果,并据此为患者制定个体化的治疗方案,以期提高患者的疗效及预后。由于本研究为回顾性研究,纳入样本量较少,随访时间较短,未来需要前瞻性大样本研究加以证实。
