羚牛骨髓间充质干细胞的分离培养与鉴定
2022-06-07郭含星王娟娟罗伟强耿阳阳高梦溪王君建潘广林贾康胜严兴荣
贾 佳,郭含星,王娟娟,罗伟强,耿阳阳,高梦溪,王君建,潘广林,贾康胜,严兴荣
(1. 西北大学 生命科学学院 西部资源生物与现代生物技术教育部重点实验室,西安 710068;2. 陕西省野生动物保育重点实验室,西安 710068;3. 陕西省珍稀野生动物抢救饲养研究中心,西安 710402)
间充质干细胞(Mesenchymal stem cells,MSCs)是一种具有自我更新与多向分化能力的基质细胞,可分化为中胚层细胞,如脂肪细胞、骨细胞、软骨细胞以及其他胚胎谱系的细胞。MSCs可从多种器官组织中分离得到,如脐带、子宫内膜息肉、月经血、骨髓及脂肪组织[1]。来源于骨髓的MSCs(Bone-marrow-derived MSCs,BM-MSCs)通过与免疫细胞的相互作用可实现效应功能的调节[2]。近年来的多项研究结果表明,MSCs具有的多能性使其成为临床医疗应用上极具吸引力的选择,如细胞治疗、再生医学和组织修复等[3]。此外,MSCs在野生动物保护方面发挥重要作用。目前,已有研究实现恒河猴、大熊猫、棕熊和小熊猫MSCs的分离鉴定[4]。研究表明,濒危野生动物MSCs的超低温保存可作为就地保护和迁地保护的有效补充措施,最大限度保存种群的遗传多样性[5]。
羚牛(Budorcastaxicolor),属偶蹄目,牛科,主要分布在中国西北、西南高海拔地区以及印度、不丹等地[6-9]。受过度捕猎和栖息地丧失等因素影响,羚牛被世界自然保护联盟(International Union for Conservation of Nature,IUCN)红色名单列为易危物种[10],是国家一级重点保护动物。为保护和改善羚牛及其他野生动物的宜居环境,中国已实施包括退耕还林工程和天然林保护工程在内的多项保护计划[11-12]。然而,就地保护策略难以维持羚牛这类小种群的繁殖和足够的遗传多样性,因此,亟需开发更加可行的保护途径以应对羚牛种群规模的不断减少[13]。近年来,集中在行为生态学领域的研究使得羚牛种群数量有所上升[14-16];线粒体全基因组等分子水平的测定与分析为羚牛遗传多样性的保护提供了资料[17-19]。但是,细胞治疗与体细胞克隆等技术作为濒危物种保护的重要措施[20],围绕其开展的羚牛保护学研究较少。BM-MSCs具有的易获取、易培养、低免疫等特性可能作为羚牛干细胞疾病临床治疗与胚胎克隆的有效载体。因此,本研究从羚牛骨髓中分离BM-MSCs,在细胞水平上进行鉴定,为羚牛生物多样性保护以及间充质干细胞在野生濒危物种中的应用研究提供依据。
1 材料与方法
1.1 试验材料
1.1.1 动物材料 动物样品采自楼观台珍稀野生动物抢救饲养研究中心(陕西省西安市周至县)12岁正常死亡6 h后的雄性羚牛。将无菌分离的羚牛股骨用含青霉素-链霉素的磷酸缓冲液洗涤3次,4 ℃保存,备用。本研究涉及的所有动物试验程序均已获得西北大学实验动物伦理委员会批准[许可证号:SYXK(陕)2021-004]。
1.1.2 试剂与仪器 试剂:胎牛血清(Fetal bovine serum,FBS)、高糖培养基(Dulbecco’s modifified Eagle medium,DMEM)、胰岛素-转铁蛋白-硒(Insulin-Transferrin-Selenium,ITS)、胰岛素(Insulin,IS)、胰蛋白酶(Gibco);乙二胺四乙酸(Ethylenediaminetetraacetic acid,EDTA)、吉姆萨染液(Giemsa stain solution)、3-异丁基-1-甲基黄嘌呤(3-Isobutyl-1-methylxanthine,IBMX)、地塞米松(Dexamethasone,DM)、吲哚美辛(Indometacin,ID)、抗坏血酸(Ascorbic acid,AA)、秋水仙素(北京索莱宝科技有限公司);转化生长因子β3(Transforming growth factor-β3,TGF-β3)、β-甘油磷酸酯(β-Glycerophosphate,β-GP)、油红(Oil Red O)、茜素红(Alizarin Red S)、阿利新蓝(Alcian blue)、胰蛋白酶(Sigma Aldrich);多聚甲醛(PFA)、氯化钾、无水乙醇、甲醇、冰醋酸(上海阿拉丁生化科技股份有限公司)。
仪器:超净工作台(北京昊诺斯科技有限公司ECO 0.9),高温高压灭菌锅(上海赛默生物科技发展公司SX-300),体视显微镜(上海舜宇恒平科学仪器有限公司S10),二氧化碳培养箱(恒生实验设备有限公司CHP-80Q),倒置荧光显微镜(Nikon),医用冷藏箱(厦门蓝冰生物科技有限公司QBLL0812),-20 ℃冰箱(海尔DW-25L256),-80 ℃冰箱(赛默飞世尔科技公司ULTS1490),流式细胞仪(BD Biosciences FACSAriaTM III),高速离心机(赛默飞世尔科技公司H1850)。
1.2 试验方法
1.2.1 羚牛骨髓间充质干细胞的分离与培养 无菌条件下分离死亡羚牛股骨,去除附着在骨头上的所有结缔组织,用套管针连接10 mL注射器抽吸骨髓。抽吸后将骨髓置于直径10 cm培养皿中,加入10 mL的含20% FBS的DMEM培养基,在37 ℃,5% CO2,饱和湿度条件下培养7 d,期间2 d更换1次培养基。原代细胞生长至80%左右时传代。用0.25%胰蛋白酶和0.04% EDTA消化,含10% FBS的DMEM中和,1 000 r/min离心3 min后弃上清,加入新鲜培养基制成单细胞悬液。将1 mL浓度为1×106mL-1的细胞悬液置于直径10 cm的培养皿中,加入9 mL DMEM和10% FBS培养至80%融合度时冷冻保存,冻存时间不超过3代[21]。
1.2.2 染色体组型分析 用0.3 μg/mL的秋水仙素处理羚牛骨髓间充质干细胞6 h。细胞经胰蛋白酶(0.25%胰蛋白酶,0.04% EDTA)消化后,加入低渗溶液(0.075 mol/L KCl)重悬,37 ℃处理30 min后离心去上清。加入固定液(甲醇∶冰醋酸=3∶1,体积比)固定细胞3次,制成细胞悬液。将细胞悬液滴至高度大于10 cm的 -20 ℃预冷载玻片上,风干后用染色液(Giemsa∶PBS=1∶9)染色[22]。显微镜下观察染色体形态并进行组型分析。
1.2.3 细胞表面抗原鉴定 采用流式细胞技术对骨髓间充质干细胞表面抗原进行鉴定[23]。 0.25%胰蛋白酶消化细胞,10% FBS中和培养基,PBS洗涤3次。用移液器反复吹打,获得均匀细胞悬液。将细胞稀释至浓度为0.5~1×106mL-1后用2% PFA固定细胞20 min,PBS洗涤3次,采用以下抗体进行流式细胞免疫反应:CD14-FITC(Fluorescein isothiocyanate),CD19-FITC,CD34-FITC,CD45-FITC,HLA-DR-FITC,CD105-PE(phycoerythrin),CD166-PE,CD44-PE,CD73-PE,CD90-PE(表1)。使用安装FACSComp软件的FACSCalibur流式细胞仪进行分析。

表1 流式细胞免疫反应使用抗体Table 1 Antibodies for flow cytometry
1.2.4 骨髓间充质干细胞的定向分化培养 细胞的成脂分化培养[24]:将P3代间充质干细胞消化处理制成单细胞悬液。将8×104个细胞接种于直径3.5 cm的培养皿中培养24 h。随后将培养基替换为成脂分化培养基(含10% FBS的DMEM ,500 μmol/L IBMX,1 μmol/L DM,10 μmol/L IS,200 μmol/L ID)进行定向诱导培养,期间每周更换2次培养基。21 d后,PBS冲洗2次,4% PFA固定10 min。用染色液(0.3% Oil Red O溶于60%异丙醇)处理细胞20 min后,60%乙醇漂洗2次,在倒置荧光显微镜下观察细胞分化情况。
细胞的成骨分化培养[25]:P3代细胞消化处理后,将5×104个细胞接种于直径3.5 cm的培养皿中培养24 h。用成骨分化培养基(含10% FBS的DMEM,0.1 μmol/L DM,300 μmol/L AA,10 mmol/L β-GP)进行定向诱导培养21 d。经固定处理后的细胞用Alizarin Red S染色30 min,漂洗后观察细胞状态。
细胞的成软骨分化培养[26]:P3代细胞消化处理后,将2×105个细胞接种于直径3.5 cm的培养皿中培养24 h。用成软骨分化培养基(含10% FBS的DMEM,0.1 μmol/L DM,300 μmol/L AA,10 ng/mL TGF-β3,1% 100×ITS)进行定向诱导培养21 d。经固定处理后的细胞染色30 min(1% Alcian blue溶于3%乙酸),在倒置显微镜下观察细胞的定向分化状态。
1.2.5 数据处理 所有试验至少独立进行3次。数据以“平均数±标准差” 的形式表示。
2 结果与分析
2.1 羚牛骨髓间充质干细胞的分离培养与核型分析
光镜下可见成纤维细胞状的羚牛BM-MSCs贴壁生长,中间密度大,随着代数增加逐渐向外扩散(图1-A)。传代培养至P5时,细胞仍维持正常形态(图1-B)。观察统计50 个分散较好的中期细胞,发现从羚牛骨髓分离出的MSCs染色体数目正常(2n=52)(图1-C)。常染色体中有4对近中着丝点染色体和21对端着丝点染色体;在性染色体中,X染色体为端着丝点染色体,Y染色体长度最小,为近中着丝点染色体(表2)。
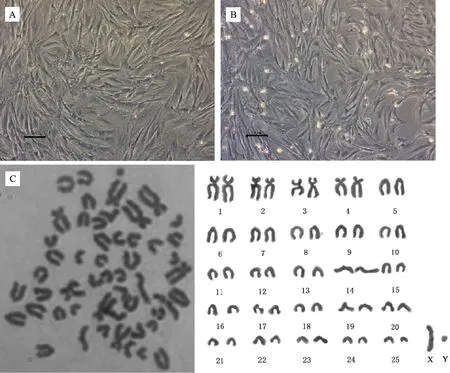
A. P1代 BM-MSCs 形态; B. P5 代 BM-MSCs 形态; C. 染色体组型分析。 标尺为100 μmA. Cell morphologies at P1; B.Cell morphologies at P5; C. Karyotype analysis of takin BM-MSCs. Bar=100 μm图1 羚牛骨髓间充质干细胞形态与染色体组型分析Fig.1 Morphological and karyotype analysis of takin BM-MSCs

表2 羚牛染色体相对长度Table 2 Relative length of chromosomes in takin
2.2 羚牛骨髓间充质干细胞表面抗原分析
采用流式细胞术检测细胞表面抗原CD105、CD166、CD44、CD73、CD90、CD14、CD19、CD34、CD45和HLA-DR。羚牛BM-MSCs对特异性表面标记CD105(97.1%)、CD73(95.9%)和CD90(97.6%)呈阳性,对CD14(单核细胞和巨噬细胞标记,3.1%)、CD19(b细胞标记,2.4%)、CD34(造血干细胞标记,1.4%)、CD45(泛白细胞标记,1.8%)和HLA-DR(3.7%)呈阴性。此外,羚牛BM-MSCs对CD166(94.7%)和CD44(97.2%)均呈阳性。同型对照显示非特异性荧光(图2)。

图2 羚牛骨髓间充质干细胞表面特异性抗原的鉴定Fig.2 Identification of surface specific antigens of takin BM-MSCs
2.3 羚牛骨髓间充质干细胞分化潜能的检测
为了鉴定羚牛BM-MSCs的分化潜能,将细胞分别置于成脂、成骨与成软骨分化培养基中进行诱导分化。
细胞的成脂分化:与对照组细胞相比,分化诱导培养后的细胞生长速度逐渐下降并停止。分化前细胞呈正常梭形(图3-A),分化诱导21 d后细胞形态发生改变(图3-B)。Oil Red O染色呈阳性,可见橘红色的空泡状脂滴(图3-E)。结果表明,羚牛BM-MSCs在体外具有向脂肪细胞分化的潜力。
细胞的成骨分化:置于分化培养基中的细胞与对照组细胞(图3-A)相比,生长逐渐放缓,最终停止生长。细胞经成骨诱导培养21 d后呈方形或五角形(图3-C)。Alizarin Red染色可观察到骨细胞外基质沉积(图3-F),这表明细胞具有成骨分化潜能。
细胞的成软骨分化:BM-MSCs经诱导分化后可见形态均一,呈三角形、不规则多边形或铺路石样的软骨细胞(图3-D)。诱导21 d后软骨基质增多,经Alcian blue染色后呈现蓝色(图3-G);未诱导组细胞呈梭形生长(图3-A)。上述结果显示羚牛BM-MSCs具有成软骨分化潜能。
3 讨 论
MSCs已在小鼠[27]、大鼠[28]、兔子[29]、狗[30]、猫[31]、马[32]、牛[33]、山羊[34]、绵羊[35]等实验动物 或家畜中实现分离与体外培养。然而,包括羚牛在内的濒危野生动物MSCs的相关研究较少。本研究成功分离的羚牛MSCs具有以下特性:维持正常核型的MSCs表现出贴附塑料表面生长的特性,细胞表面存在特异性抗原表达,具有多向分化潜能。上述研究结果均符合国际细胞治疗学会(the International Society for Cellular Therapy,ISCT)宣布的MSC定义最低标准[36],这表明本研究从正常死亡羚牛骨髓中分离的细胞系确为MSCs。
MSCs可以从多种器官或组织中获得,包括胎儿肝脏、骨髓、血液和羊水、出生时的脐带组织和脐血、青年时发育中的牙齿、成年时的骨髓组织和脂肪组织[1]。研究显示,来源于同一物种的不同组织或器官的MSCs在增殖能力、分化能力和/或其他生物学特性方面表现出不同的特征[37]。从濒危动物分离的MSC活细胞冷冻保存技术是目前野生动物遗传资源保护的有效策略之一[5]。因此,本研究成功分离鉴定的羚牛BM-MSCs可作为种质资源保护的种子细胞,实现羚牛遗传资源的长期保存。然而,已有研究表明,来自脐带的MSCs比骨髓等其他组织来源的MSCs具有更强的分化能力,易获取且无伤害性,更加适合濒危物种体外试验与细胞治疗相关研究[37-38]。因此,未来笔者将进一步尝试提取脐带组织以及其他来源的MSCs,为开展细胞水平的野生濒危动物保护研究提供更多有效资源。
MSCs具有成脂、成骨与成软骨多向分化潜能。研究表明,不同因子影响MSCs的多向分化。目前已有报道称,DM,IS,ID和IBMX或4 种试剂联合使用时可促进MSCs向脂肪细胞的分化[39]。DM、TGF、AA等因子对于MSCs的成骨分化以及成软骨分化存在一定的影响[40]。TGF-β1是目前调控MSCs分化的首选生长因子之一。不同浓度的TGF-β1对MSCs分化的诱导效率不同,适宜浓度时可有效促进MSCs向成骨细胞的分化;而TGF-β2和TGF-β3则在促进MSCs的软骨分化上强于TGF-β1,主要表现在促进葡糖胺聚糖和Ⅱ型胶原聚集方面[41]。作为TGF-β超家族成员之一的骨形成蛋白对于MSCs的诱导效应具有特异性[42-44]和剂量依赖性[45-46]。此外,普遍存在于多种器官组织中的成纤维细胞生长因子持续释放时可增强软骨分化。研究显示,用含成纤维细胞生长因子(10 ng/mL)的培养基MSCs时可提高细胞增殖速率[47]。因此,为了促进羚牛MSCs的增殖和多向分化,可以考虑将适宜浓度的生长因子作为细胞培养的常规组成部分,以充分发挥MSCs的分化再造潜能。
体细胞核移植技术目前已成为多个物种繁殖和保护的重要途径,在多种驯化物种和非繁殖或死亡的动物中成功实施[48]。利用体细胞核移植技术融合产生新个体的相关研究表明,该项技术可能成为保护濒危野生物种的一种有效工具[5]。成纤维细胞在生物体中的数量较多,它们的分离和培养也比其他细胞类型更容易。基于上述原因,成纤维细胞在生物医学研究中具有巨大潜力,也成为体细胞核移植技术的常见供体细胞[49]。然而,多项研究证实MSCs也可成为合适的核供体[5]。利用牛的羊水MSCs和脂肪MSCs生产克隆牛的研究表明,MSCs对于提高牛的核移植效率具有重要意义[50]。特别是,Su等[51]和Kwong等[52]分别对蒙古绵羊和山羊的BM-MSCs与成纤维细胞作为不同核供体制备的克隆胚胎体外发育能力进行了比较。结果显示,利用BM-MSCs克隆的胚胎具有较高的卵裂率和囊胚率。这表明BM-MSCs可作为大型动物自体研究的良好细胞类型,并将成为体细胞克隆和未来转基因研究的宝贵材料。此外,有研究将羚牛耳成纤维细胞与去核牛卵母细胞融合,产生羚牛胚胎,但发育率较低[53]。近年来,对于羚牛的分类学研究表明该物种与山羊、绵羊等羊亚科动物的亲缘关系最近,存在高度保守性[14]。因此,在未来的研究中,羚牛MSCs将有望在种内与种间体细胞核移植技术上发挥巨大潜力。
4 结 论
综上所述,本研究成功分离鉴定羚牛骨髓间充质干细胞,为羚牛生物多样性保护研究提供依据。未来应从羚牛不同组织MSCs的分离培养以及体外胚胎克隆方面继续开展深入研究,为濒危野生动物资源保存奠定良好基础。
