IL-8/miR-182正反馈调控轴在非小细胞肺癌中的作用机制研究
2022-06-07赵明娜张宸梓洪秋双娄加陶
赵明娜,张宸梓,洪秋双,娄加陶
(1.上海交通大学医学院附属第一人民医院检验医学中心,上海 200080;2.中南大学湘雅医院血液科,湖南 长沙 410008;3.上海中医药大学附属岳阳中西医结合医院检验实验医学中心,上海 200437)
肺癌是我国发病率和病死率均较高的恶性肿瘤之一,也是国际上癌症相关死亡的首要原因,患者5年生存率较低[1]。因此,探索肺癌发生、发展的分子机制,对提高肺癌的早期诊断率,精确分型分期,以及预测复发和预后具有重要意义[2]。微小RNA(microRNA,miRNA)是一类大小约为22 nt的非编码小分子RNA,通常与靶基因mRNA 3'非翻译区(untranslated region,UTR)结合,通过降解mRNA或抑制其翻译,在转录后水平负调控靶基因表达[3]。许多癌基因、抑癌基因和一系列与细胞周期、细胞凋亡、细胞迁移、血管生成相关的基因都受到miRNA的调控[4]。另外,炎症因子在肿瘤的发生、发展中也发挥着重要作用。炎症因子刺激可以调节特定的致癌miRNA或抑癌miRNA的表达,影响miRNA靶基因的翻译,导致靶基因表达发生变化,而这些靶基因表达的变化可以促进或抑制肿瘤的发生、发展[5]。白细胞介素-8(interleukin-8,IL-8)是一种促炎性CXC趋化因子,主要受NF-κB信号通路调控。有研究结果显示,IL-8的过度表达与多种肿瘤有关,其参与了血管生成和内皮细胞迁移,进而导致肿瘤进展[6]。miR-182-5p是miR-183/96/182簇中的一员,是一种新型的肿瘤相关miRNA,参与了多种肿瘤的发生、发展,与非小细胞肺癌(nonsmall cell lung cancer,NSCLC)的发生密切相关[7]。但IL-8和miR-182在NSCLC中是否相互作用,并影响NSCLC的发展,仍有待进一步研究。为此,本研究拟探讨IL-8和miR-182在NSCLC发展中可能的作用机制。
1 材料和方法
1.1 研究对象
选取2011年7月—2016年6月上海市胸科医院确诊为NSCLC的40例患者(NSCLC组),其中男28例、女12例,年龄43~71岁。所有患者均为初诊,术前均未接受治疗。收集所有患者术前血清样本和术中切除的癌组织及癌旁组织(距癌灶组织>5 cm、外观正常)样本。另选取上海市胸科医院体检健康者40名(正常对照组),其中男21名、女19名,年龄40~56岁,收集其血清样本。本研究经上海市胸科医院伦理委员会批准,所有对象均签署知情同意书。
1.2 细胞来源和培养
人NSCLC细胞株A549购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),采用含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的RPMI 1640培养基(美国Gibco公司),置于37 ℃、5% CO2培养箱中培养。
1.3 细胞转染与刺激
1.3.1 细胞转染 根据转染质粒进行分组,包括STAT3-siRNA质粒(STAT3-siRNA组)、阴性对照siRNA质粒(NC-siRNA组)、miR-182模拟物质粒(miR-182 mimic组,过表达miR-182)、miR-182抑制剂质粒(miR-182 inhibitor组,抑制miR-182表达)、阴性对照质粒(mimic NC组、inhibitor NC组),所有质粒均购自广州锐博生物科技有限公司。待细胞融合度为70%~80%时,参照Lipofectamine 2000(美国Invitrogen公司)试剂说明书分别将miR-182 mimic、mimic NC、miR-182 inhibitor、inhibitor NC、STAT3-siRNA或NC-siRNA分别转染至A549细胞,然后置于37 ℃、5% CO2培养箱中培养,分别于24、48 h后提取RNA和蛋白,采用实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RT-qPCR)检测miR-182的相对表达量,采用免疫印迹法检测STAT3蛋白的表达量,确定转染效率。
1.3.2 IL-8刺激 将A549细胞铺板融合至50%左右或转染miR-182 inhibitor 6 h后,换成无血清的RPMI 1640培养基,置于37 ℃、5% CO2培养箱中培养24 h,加入10 ng/mL IL-8(苏州近岸蛋白质科技股份有限公司)或磷酸盐缓冲液(phosphate-buffered saline,PBS)(对照组),于培养箱中培养24 h后收集细胞,提取RNA和蛋白,用于后续实验。
1.3.3 IL-8受体抑制剂Repertaxin和NF-κB信号通路抑制剂BAY11-7082刺激 Repertaxin和BAY11-7082均购自美国MedChemExpress公司。A549细胞转染或用IL-8刺激后,在收取细胞前12 h,加入20 μmol/L Repertaxin或50 μmol/L BAY11-7082,12 h后收集细胞,提取RNA和蛋白,用于后续实验。
1.4 RT-qPCR检测miR-182和IL-8的相对表达量
采用TRIzol试剂(美国Invitrogen公司)提取细胞总RNA,测定RNA浓度。使用RNA逆转录试剂盒[宝生物工程(大连)有限公司]逆转录成互补DNA(complementary DNA,cDNA)。以1 μL cDNA为模板,进行RT-qPCR,试剂盒购自宝生物工程(大连)有限公司。引物由英潍捷基(上海)贸易有限公司合成。miR-182逆转录引物为5'-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGTGTGAG-3',前向引物为5'-ACACTCCAGCTGGGTTTGGCAATGGTAGAACT-3'。通用反向引物为5'-CTCAACTGGTGTCGTGGAGTCGG-3'。U6上游引物为5'-CTCGCTTCGGCAGCACA-3',下游引物为5'-AACGCTTCACGAATTTGCGT-3'。IL-8上游引物为5'-CTGGCCGTGGCTCTCTTG-3',下游引物为5'-CCTTGGCAAAACTGCACCTT-3'。β-actin上游引物为5'-ATCAAGATCATTGCTCCTCCTGAG-3',下游引物为5'-CTGCTTGCTGATCCACATCTG-3'。反应条件:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 34 s,40个循环。所有反应均设置3个复孔,采用2-△△Ct法进行相对定量。检测仪器为ABI 7900实时荧光定量PCR仪(美国ABI公司)。
1.5 免疫印迹法检测蛋白相对表达量
收集A549细胞和转染miR-182 mimic、miR-182 inhibitor、mimic NC、inhibitor NC、STAT3-siRNA或NC-siRNA的A549细胞,使用裂解液提取细胞总蛋白,加入2×loading蛋白上样缓冲液,95 ℃ 加热5 min,用10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,采用湿转法转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,2%牛血清白蛋白封闭2 h,加入一抗[信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)蛋白兔单克隆抗体、Phospho-NF-κB p65蛋白兔单克隆抗体(简称P-p65抗体)、NF-κB p65蛋白兔单克隆抗体(简称p65抗体),美国CST公司]和内参抗体β-连环蛋白1(beta-catenin 1,CTNNB1)兔单克隆抗体(美国CST公司)4 ℃孵育过夜,加入辣根过氧化物酶标记的二抗(美国Sigma公司)室温孵育1 h,采用化学发光法检测蛋白表达。
1.6 细胞增殖实验
采用溴化噻唑蓝四氮唑(thiazolyl blue tetrazolium bromide,MTT)法检测细胞增殖能力。分别将转染miR-182mimic、miR-182 inhibitor、mimic NC、inhibitor NC质粒的A549细胞和PBS刺激(对照组)、10 ng/mL IL-8刺激(IL-8组)、转染miR-182 inhibitor质粒并加入10 ng/mL IL-8刺激(IL-8+miR-182 inhibitor组)的A549细胞,按5 000个/孔铺在12孔板中,贴壁后,在培养液中加入5 mg/mL MTT[生工生物工程(上海)股份有限公司],培养2 h,移去培养液,加入200 μL二甲基亚砜(dimethyl sulfoxide,DMSO),37 ℃ 孵育30 min,检测570 nm处的吸光度(A)值,以第1天为0点,每隔24 h检测1次,共计4 d。绘制生长曲线。
1.7 细胞迁移试验
分别收集转染miR-182mimic、miR-182 inhibitor、mimic NC、inhibitor NC质粒的A549细胞和PBS刺激(对照组)、10 ng/mL IL-8刺激(IL-8组)、转染miR-182 inhibitor质料并加入10 ng/mL IL-8刺激(IL-8+miR-182 inhibitor组)的A549细胞,用不含血清的RPMI 1640培养液制成单细胞悬液,接种于Transwell 小室的上室(2×104个/小室),在下室中加入500 μL含10%胎牛血清的RPMI 1640培养液。常规培养24 h后,用棉签轻轻擦去小室内未迁移的细胞,迁移到小室下表面的细胞用4%多聚甲醛4 ℃固定5 min,PBS洗涤后,用0.1%结晶紫溶液室温染色5 min,PBS充分洗涤后,采用BX53型正置荧光显微镜(日本奥林巴斯公司)观察、拍照并计数。
1.8 免疫荧光试验
收集转染miR-182 mimic、miR-182 inhibitor、mimic NC质粒的A549细胞和转染miR-182 mimic质粒并加入50 μmol/L BAY11-7082处理的A549细胞,采用4%多聚甲醛固定30 min,2%牛血清白蛋白室温封闭2 h,加入一抗(P-p65抗体、p65抗体,1∶1 000稀释),4 ℃孵育过夜,加入二抗[山羊抗兔IgG H&L(Alexa Fluor 488),1∶1 000稀释],室温避光孵育1 h,用4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)染色5 min,采用BX53型正置荧光显微镜观察蛋白的表达和定位,拍照并计数。
1.9 统计学方法
采用SPSS 19.0软件进行统计分析。所有实验均独立重复3次。呈正态分布的计量资料以±s表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 NSCLC组与正常对照组血清IL-8水平比较
NSCLC组血清IL-8水平[34.50(24.50~45.75)pg/mL]显著高于正常对照组[11.00(8.00~15.75)pg/mL](P<0.01)。
2.2 NSCLC患者癌组织与癌旁组织miR-182相对表达量比较
NSCLC患者癌组织miR-182相对表达量为2.85(1.08~4.83),显著高于癌旁组织[0.40(0.24~0.61)](P<0.01)。见图1。

图1 癌组织与癌旁组织miR-182相对表达量比较
2.3 不同血清IL-8水平NSCLC患者之间癌组织miR-182相对表达量比较
将血清IL-8≤35 pg/mL定义为低IL-8,>35 pg/mL定义为高IL-8。高IL-8组NSCLC患者(24例)癌组织miR-182相对表达量高于低IL-8组NSCLC患者(16例)(P<0.05)。见图2。

图2 不同血清IL-8水平NSCLC患者癌组织miR-182相对表达量比较
2.4 NSCLC患者血清IL-8水平与癌组织miR-182相对表达量的相关性
NSCLC患者血清IL-8水平与癌组织miR-182相对表达量呈正相关(r =0.810 8,P<0.000 1)。见图3。
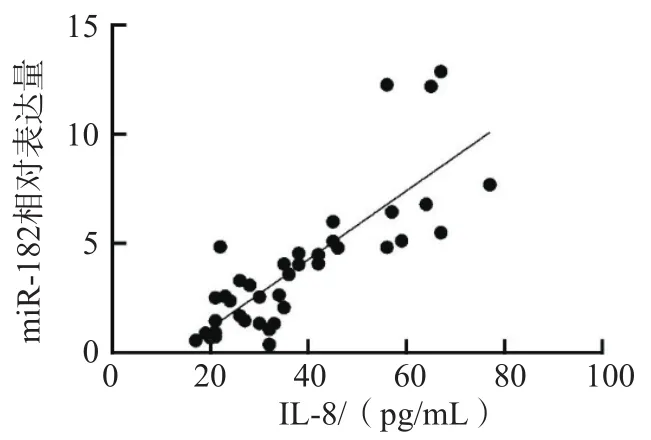
图3 NSCLC患者血清IL-8水平与癌组织miR-182相对表达量的相关性
2.5 A549细胞中miR-182的转染效率
将miR-182 mimic、mimic NC、miR-182 inhibitor、inhibitor NC质粒分别转染至A549细胞中。miR-182 mimic组miR-182相对表达量明显高于mimic NC组(P<0.01),miR-182 inhibitor组miR-182相对表达量显著低于inhibitor NC组(P<0.01)。见图4。
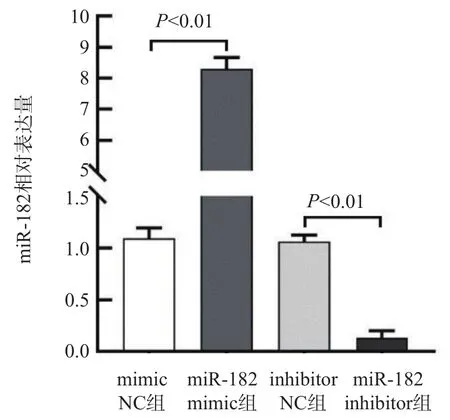
图4 各组miR-182相对表达量比较
2.6 miR-182在A549细胞增殖和迁移中的作用
细胞增殖实验结果显示,培养72 h和96 h,miR-182 mimic组的细胞增殖能力均高于mimic NC组(P<0.01);miR-182 inhibitor组的细胞增殖能力均低于inhibitor NC组(P<0.01)。见图5(a)。
细胞迁移实验结果显示,miR-182 mimic组的细胞迁移数目高于mimic NC组(P<0.01);miR-182 inhibitor组的细胞迁移数目低于inhibitor NC组(P<0.01)。见图5(b)、图5(c)。

图5 miR-182在A549细胞增殖和迁移中的作用
2.7 IL-8在A549细胞增殖和迁移中的作用
细胞增殖实验结果显示,IL-8组的细胞增殖能力明显高于对照组(P<0.01),IL-8+miR-182 inhibitor组的细胞增殖能力明显低于IL-8组(P<0.01),见图6(a)。
细胞迁移实验结果显示,IL-8组细胞迁移数明显高于mimic NC组(P<0.01);而IL-8+miR-182 inhibitor组细胞迁移数低于IL-8组(P<0.01)。见图6(b)、图6(c)。
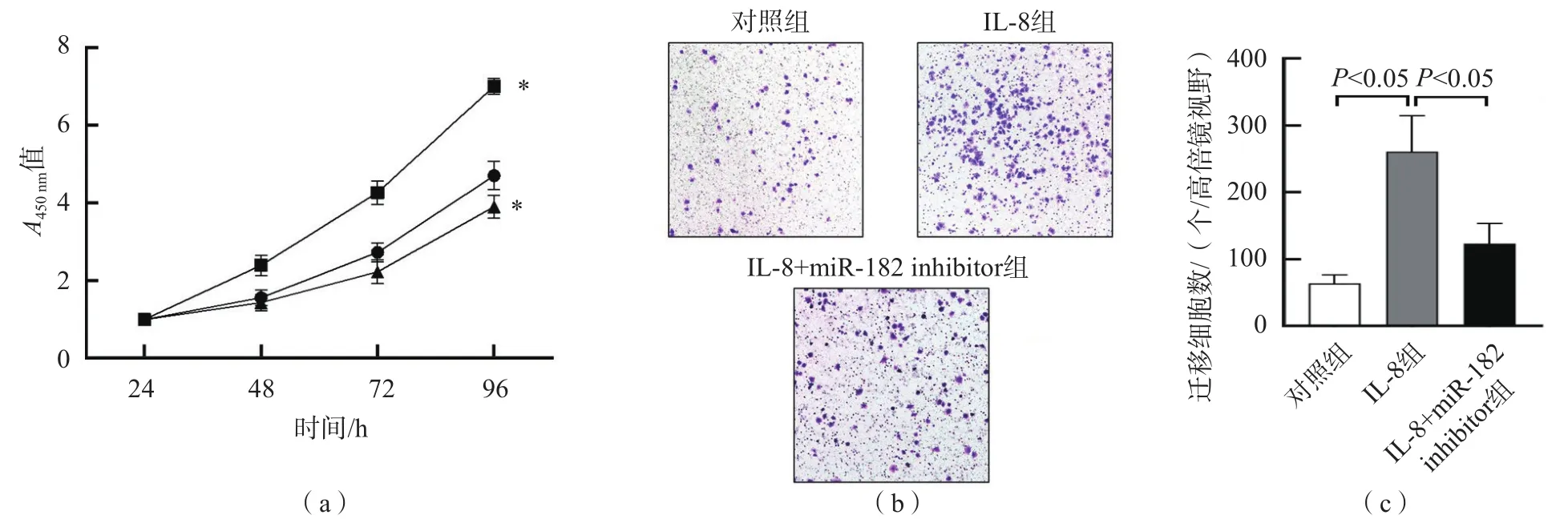
图6 IL-8在A549细胞增殖和迁移中的作用
2.8 IL-8对miR-182表达水平的影响
培养24 h后,IL-8组miR-182相对表达量明显高于对照组(P<0.05),IL-8+Repertaxin组m i R-1 8 2相对表达量明显低于I L-8组(P<0.01),见图7(a)。STAT3-siRNA组STAT3蛋白表达量明显低于NC-siRNA组(P<0.01),见图7(b),提示质粒转染成功。STAT3-siRNA组miR-182相对表达量明显低于NC-siRNA组(P<0.05),见图7(c)。
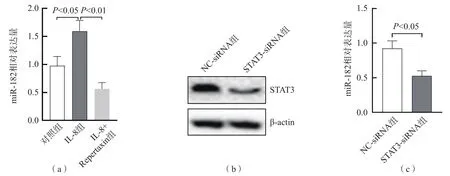
图7 IL-8对miR-182表达水平的影响
2.9 miR-182对IL-8表达的影响
转染不同质粒48 h后,miR-182 mimic组P-p65蛋白表达量高于mimic NC组(P<0.05),见图8(a)。miR-182 mimic组p65蛋白入核数量多于mimic NC组,miR-182 inhibitor组p65蛋白入核数量少于inhibitor NC组,见图8(b)、图8(c)。miR-182 mimic组IL-8基因和蛋白的表达量均高于mimic NC组(P<0.05),miR-182 inhibitor组IL-8基因和蛋白的表达量均低于inhibitor NC组(P<0.05),见图8(d)、图8(e)。

图8 miR-182和NF-κB信号通路对IL-8表达的影响
3 讨论
目前,恶性肿瘤居全球死亡原因的第1位,而肺癌是肿瘤相关死亡的首要原因[1]。提高肺癌的早期诊断率,并根据肺癌发生、发展的分子机制选择特异性的治疗方法,提高肺癌患者的生存率和生活质量,是当前肺癌相关研究的重点和热点。
趋化因子和细胞因子在肿瘤的发生、发展和转移中起着至关重要的作用。在肿瘤中,趋化因子主要调节血管生成,激活肿瘤特异性免疫反应,并通过自分泌或旁分泌机制直接刺激肿瘤[8]。
IL-8是一种相对分子质量为6 000~8 000的小分子蛋白质,属于CXC趋化因子家族成员[9],也被称为C-X-C基序配体8。多种肿瘤细胞可通过自分泌IL-8的形式促进肿瘤发展和转移,通过旁分泌的形式影响肿瘤微环境并诱导血管生成。IL-8也会从肿瘤微环境被释放到体循环中,多种肿瘤,如胰腺癌、结肠癌、肾癌、前列腺癌、肝癌、食管癌和肺癌患者血清IL-8水平均会升高,并与患者的低生存率显著相关[10-11]。2003年,miR-182首次被发现在感觉器官和组织中大量表达,调节视网膜和内耳的发育,并在成骨细胞和T细胞分化中发挥重要作用[7]。近年来的研究发现,miR-182参与了肿瘤的发生、发展和远处转移,在黑色素瘤中,miR-182会出现异常表达,并靶向叉头转录蛋白O3(forkhead box O3,FOXO3),促进肿瘤转移[12];在乳腺癌中,miR-182通过靶向转移抑制因子1(MTSS I-BAR domain containing 1,MTSS1),解除Ras同源基因家族成员A(ras homolog family member A,RHOA)的活性抑制,促进应力纤维的形成来促进肿瘤转移[13]。
本研究结果显示,NSCLC患者癌组织miR-182呈高表达,且高IL-8组癌组织miR-182相对表达量高于低IL-8组(P<0.05)。本研究细胞实验结果显示,IL-8可促进A549细胞的增殖和侵袭;单独过表达miR-182可促进A549细胞的增殖和侵袭,敲低miR-182可抑制A549细胞的增殖和侵袭,且敲低miR-182后,还能恢复IL-8促A549细胞增殖和侵袭的作用;IL-8可通过调节转录因子STAT3来促进miR-182的表达,而miR-182通过上调NF-κB信号通路,促进IL-8的表达和分泌。
综上所述,IL-8/miR-182调控轴在NSCLC细胞的增殖过程中发挥了重要作用,这为探索NSCLC的基因治疗、寻找新的分子治疗靶点提供了实验室依据,为肺癌的治疗提供了一种新的可能。后续研究将通过动物实验进一步阐明并验证NSCLC细胞中IL-8/STAT3/miR-182/NF-κB/IL-8正反馈调控轴的机制,探索靶向抑制该调控轴干预NSCLC的可行性,并在临床患者样本中进行验证,为NSCLC的预防和临床诊治提供新的策略和分子靶点。
