钠与水反应实验的新设计
2022-06-07林秀丽
林秀丽


摘要: 针对苏教版化学必修第一册“钠与水反应实验”存在的不足,通过查阅文献资料对比分析和实践摸索,新设计一套由透明玻璃瓶、截短的直形安全漏斗、T形管等组成的实验装置。该装置可供学生分组探究实验,具有操作简便、现象丰富、安全性高等特点。
关键词: 钠与水反应; 实验装置改进; 探究实验
文章编号: 1005-6629(2022)05-0075-03
中图分类号: G633.8
文献标识码: B
钠是高中阶段学生学到的第一种典型的金属元素,也是高中化学课程标准中要求掌握的重要元素知识之一。通过对钠的主要化学性质的实验探究,可初步掌握研究物质性质的实验方法,对后续学习其他金属元素有指导性作用,因此尽可能地让学生去动手进行实验探究。钠与水的反应是钠的主要化学性质之一,若按教材中把擦去煤油的绿豆大小的钠粒直接投入到有水的敞口烧杯中,只能知道生成了碱性物质,无法根据实验现象得出全部产物,同时还存在钠与火星飞溅出来的安全隐患。
1 研究现状概述
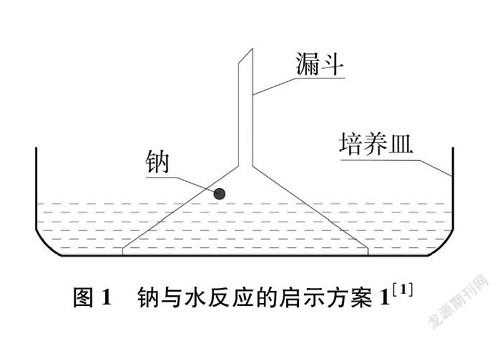
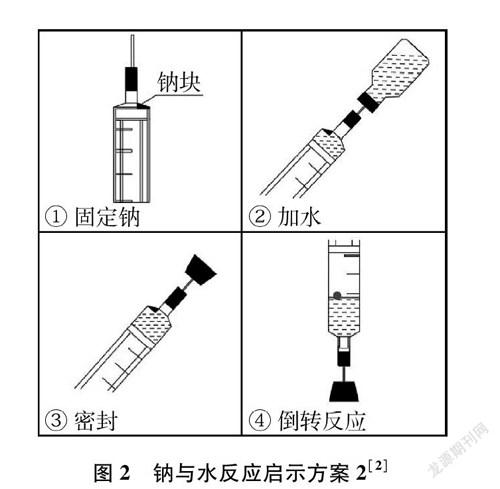
为完善教材中的实验,许多一线教师对实验进行了改进,大多是为了提高该实验的安全性和成功率,以及增加实验的趣味性。通过查阅文献资料进行对比分析,归纳为如下五种启示方案(图1~图5)。
以下五种方案都是用酚酞指示剂来检验碱性物质的生成,用点燃法或爆鸣法检验气体产物。通过对比,列出以下各启示方案的可行性分析表(如表1所示)。
分析上表可知,每种方案都要控制好钠的用量,控制好钠的用量是实验成功和安全的基本条件。但是钠的用量没有一个参照的辅助实物,学生很难控制好用量。启示方案1,装置虽简单,但漏斗的重量、水位的高低以及钠的大小必须协调好。这种半封闭的装置能使气体和热量快速地释放出来,提高了实验的安全性;启示方案2,用针头吸入6毫升水并控制钠和水不接触,这个操作对学生来说难度太大,而点燃气体的方法来验证氢气的产生还是可借鉴的;启示方案3,用坩堝钳快速将钠送至塑料瓶口与水反应,且立即塞上瓶塞并关闭弹簧夹的操作,
对高一学生来说难度很大。但其选择较大空间的反应容器,利用排水法收集气体并用点燃法和爆鸣法验证气体的思路值得采纳;启示方案4,钠块的大小不好衡量。钠块太大,试管空间太小,摇晃时存在安全隐患。钠块太小,产生的肥皂泡太少又容易消失。但利用肥皂泡来检验氢气的方法能给实验带来趣味性,值得采纳;启示方案5,空间太小,钠粒太大,存在安全隐患。若钠粒太小,生成气体太少容易验证失败。钠粒在煤油层中上下舞动,虽然能产生趣味现象,但是万一操作不当很容易着火。钠与煤油的密度比较通过钠的储存方式即能判断,因此,没必要加煤油进行实验。
2 新设计的方案
通过对比探究上述改进实验,经过多番尝试、整改、摸索,设计出一套可供学生分组实验的简单装置,介绍如下。
2.1 实验原理
钠与水反应: 2Na+2H2O2NaOH+H2↑
2.2 装置组装
组装材料: 直形安全漏斗(玻璃管内径4mm,下文简称漏斗)、内径5mm的T形玻璃管1支、内径5mm的短直角玻璃管、13号橡胶塞(直径55~68mm)、口径与橡胶塞配套的透明玻璃瓶(口径60~65mm)、2段适当长度白色硅胶管、金刚石玻璃刀(或小砂轮片)
组装步骤:
(1) 用金刚石玻璃刀将漏斗的玻璃管截断,留下约5厘米长即可。另取1支T形管,将其横的一端截短,使T形管等长的3端变成等长的2端与2~3厘米长的1端。将硅胶滴瓶帽子剪短,使其刚好可以套在T形管2~3厘米端的管口,作为管口盖帽(以下统称管帽)。
(2) 给13号橡胶塞开孔使套上带硅胶管的玻璃管和T形玻璃管(可以刚好穿过去)。
(3) 将漏斗玻璃管插入橡胶塞,用硅胶管连上,与T形管另一端连接好。将漏斗倒扣到透明玻璃瓶中,调整橡胶塞使漏斗平口与玻璃瓶底部间隔一段距离。
(4) 将直角玻璃管与T形管竖的端口连接好。组装好的实验装置如图6所示。
2.3 实验过程
仪器: 组装好的新装置一套(含管帽)、升降台1台、培养皿1个、小刀1把、打火机1个、小木条1根、吸水性好的抹布1条、滤纸若干、内径5mm的T形玻璃管1支、镊子1把、细玻璃棒1根、15×150mm试管1支、塑料滴管1根、塑料水槽1个
药品: 金属钠、酚酞溶液、蒸馏水、肥皂水
实验步骤与现象:
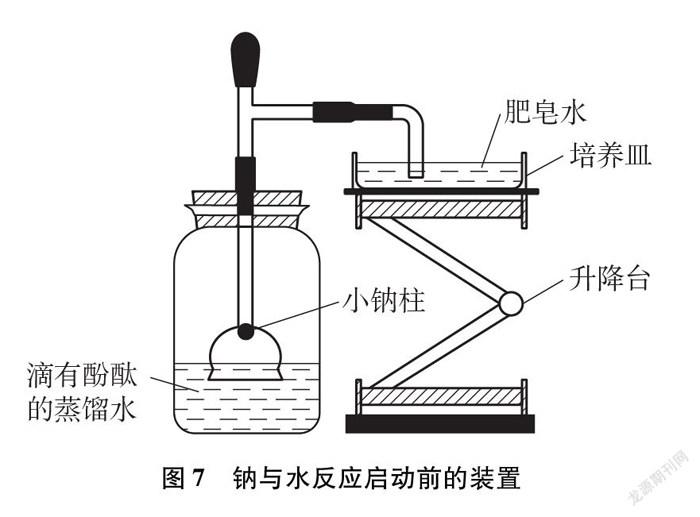
(1) 准备。截短的漏斗以及与漏斗相连的T形管内外须干燥,备用。往玻璃瓶中加适量蒸馏水(使水位在漏斗球形部位高度的1/2至2/3之间)并滴加3滴酚酞,往培养皿中倒入培养皿2/3高度的肥皂水,放在升降台上备用(见图7)。
(2) 取钠。用镊子从试剂瓶中取出一块钠块放在滤纸上,擦干其表面煤油。手握T形管竖的一端,用T形管横的一端钻取一块与管内径一样的小钠柱,把剩余的钠放回试剂瓶。用细玻璃棒从T形管横的另一端口伸进去把钠柱轻轻推出,并用小刀截取高度为5mm的小钠柱(玻璃棒上有5mm长度的标记),多余的钠放回瓶子。用过的滤纸放到有无水乙醇的烧杯中。(整个取钠过程在干净干燥的塑料板或石棉网上进行。钠柱可提前由教师切好,放在装有煤油的透明小塑料瓶里。
(3) 固定钠并调好水位。将小钠柱放入漏斗底部,并用试管压紧小钠柱使其固定在漏斗与玻璃管的接口位置,然后将漏斗倒扣在玻璃瓶液面下,并盖紧橡胶塞,调整好升降台,使直角玻璃管口浸没在肥皂水中(如图7所示)。
(4) 启动反应及现象。取下管帽滴加3滴水,再将管帽盖在管口(有时需要捏一捏管帽),可以看到水沿着玻璃管壁流下与小钠柱接触,钠开始熔化随后掉到漏斗溶液中,漏斗中的液面逐渐下降低于瓶中液面,溶液逐渐变红,培养皿中肥皂液不断冒泡。当大部分钠柱反应后脱下管帽,点燃气体,可观察到安静的燃烧现象,漏斗的液面恢复与玻璃瓶的液面一样高,闪亮的钠小球在水面上游动并发出嘶嘶的响声。当钠球只剩三分之一左右时盖好管帽,观察到漏斗中的液面又开始逐渐低于玻璃瓶中的液面,培养皿中肥皂水继续冒气泡。反应结束时,用燃着的木条点燃肥皂泡,可以听到尖锐的爆鸣声。熄灭木条。
(5) 取下管帽,用塑料滴管往T形管口滴加水,确保漏斗底部玻璃壁上的钠全部反应掉。最后把玻璃瓶中的废液和培养皿中的肥皂液倒入相应的废液缸中回收处理。
2.4 实验结论
钠熔化说明该反应放热。滴有酚酞的蒸馏水变红,说明生成了碱性物质。点燃T形管口气体,安静地燃烧,证明气体具有可燃性。结合点燃肥皂泡中不纯的气体,听到爆鸣声的现象,得出实验过程产生的气体是氢气。
2.5 实验注意事项
(1)装置的气密性由教师提前确认好。(2)管帽下的一段玻璃管应切割掉只留2~3厘米,以免点火时发生爆鸣。(3)实验前一定要确保截短的漏斗以及与漏斗相连的T形管内外干燥,以免固定小钠柱时就发生反应。(4)实验前要削去钠表面的固态氧化物杂质并擦干煤油。(5)钻取钠柱的过程要在干燥的地方进行,用过的滤纸要放在无水乙醇的烧杯里,避免残留的钠带来安全隐患。(6)反复实验表明,实验前漏斗中的水位宜在漏斗球形部位高度的1/2至2/3之间,使钠与水的反应空间足够大,观察钠粒游动的现象最明显。
3 新实验方案的优点:
(1)對于钠的用量有一个明确的实体衡量辅助物,方便学生操作。(2)小钠柱的直径刚好比漏斗底部孔径大1mm,配合试管压紧可以将钠固定住。(3)在新装置中进行反应钠的颗粒不会飞溅出来,生成的气体和热量可以快速排到肥皂水中,安全性很高。(4)产生氢气的量足够大,实验现象丰富,用点燃法和爆鸣法共同验证气体,实验过程操作简单,成功率几乎100%。
参考文献:
[1]高霞. 钠与水反应实验改进[J]. 中学化学教学参考, 2020, (7): 74.
[2]刘玉荣, 王阳. 钠与水反应的改进实验综述及新设计[J]. 化学教学, 2018, (12): 75~80.
[3]伍强, 方娟, 蔡益. 钠与水反应实验的创新设计[J]. 化学教学, 2017, (8): 73~75.
[4]毕晓昀, 张会清. 钠与水反应实验装置的改进[J]. 化学教学, 2020, (6): 68~71.
[5]巩永锐, 李忠恒, 周丽梅. 钠与水反应装置的趣味化改进[J]. 化学教学, 2021, (5): 69~72.
