混合物毒性评价模型的选择优化
2022-06-06孙茹茹王娜马晓妍张欢乐张靖坤
孙茹茹,王娜,*,马晓妍,张欢乐,张靖坤
1. 西安科技大学建筑与土木工程学院,西安 710054 2. 西安建筑科技大学环境与市政工程学院,西安 710055
随着大量的工业废水和生活污水排放到江河等地表水体之中,水中化学物质的数目越来越多,进而导致地表水受到严重的污染。受污染的地表水体与人类的生活紧密相关,给人类和生态健康带来极大的危害。大量研究表明,混合物对水体中各级生物体的联合毒性往往大于单一物质的毒性之和[1-2]。由于模型评价的差异性,同一组混合物可能得到截然不同的联合作用结论[3-5]。因此要正确评价及预测混合物的联合毒性,选择合适的模型非常重要。目前,化学混合物毒性研究中最流行的加和参考模型是浓度加和模型(concentration addition model, CA)[6]和独立作用模型(independent action model, IA)[7-8]。对于同一物质中2个浓度组合成的虚拟混合物,CA模型虽然能合理解释,但以物质浓度与毒性之间具有线性关系为依据[9-10]。已有大量的研究表明,物质的浓度和其毒性效应具有非线性关系[11-12],因此对CA模型的使用要谨慎。IA模型虽然不是依据物质浓度与毒性之间的线性关系,但仅仅依据概率与统计学原理,缺乏物理、化学和生物学的意义[9-10]。因此,迫切需要一种更简单、更科学的模型作为混合物联合毒性评价的补充。Gao等[13]建立的理论非线性联合毒性评价模型(the theoretical non-linear combined toxicity assessment model, TNL)在评价重金属二元混合物的联合作用上有很好的可靠性。课题组前期采用毒性效应来衡量毒性的大小,该方法在原理上与TNL模型一致,通过评价不同类型的二元混合物发现,在剂量效应曲线范围内,该模型能满足各种类型物质的联合作用评价,并可将应用范围扩展到多元混合物[14]。
重金属具有持久性、毒性和生物累积性,对水体生态系统和人类健康具有重大的威胁[15],本研究选择常见的重金属镉。表面活性剂在水体中会起泡,隔绝空气与水,抑制水体复氧,高浓度的表面活性剂亦会对生物降解功能产生抑制[16]。本研究选择最常见的直链烷基苯磺酸表面活性剂十二烷基硫酸钠(sodium lauryl sulfate, SDS)。农药是现代农业必不可少的一部分。生长型除草剂百草敌(dicamba, DIC)是世界上应用最广泛的农药之一[17],它具有潜在的基因毒性已被多种体内、体外生物毒性评价证明[18-19]。广谱抗生素盐酸四环素(tetracycline hydrochloride, TC)是一种便宜的兽用抗生素和饲料添加剂,其在水和食物中常被检测到,对水生有机物具有抑制生长、发育的毒性[20],影响人类的肠道菌群及增强耐药性基因[21]。具有耐药基因的生物体引起的感染越来越多,多肽类抗生素多粘菌素B(polymyxin B sulfate, PLB)作为人类应对感染的最后一招,常在临床医学中用到[22]。盐酸苯海拉明(diphenhydramine hydrochloride, DPH)临床上常被用来治疗各种过敏症状、荨麻疹、失眠,天然水体、污水厂二级出水、土壤、鱼类体内均检测到它的存在,对人类的健康和水体生物带来负面影响[23]。随着离子液体应用的普及,文献中关于它们的生物毒性和环境危害性的报道越来越多[24-25],离子液体1-十二烷基-3-甲基咪唑氯盐(1-dodecyl-3-methylimidazolium chloride, IL)被选择用于本研究。
综上,本研究选择5类环境中常见的7种有毒物质,采用等毒性溶液法[26]设计二元混合物。利用应用微板毒性分析法(microplate toxicity analysis, MTA)[27]测定了上述物质对费氏弧菌(Vibriofischeri)的一元及二元急性生物毒性。通过分析3种模型的评价结果,进一步优化混合物联合毒性评价中模型的选择。
1 材料与方法(Materials and methods)
1.1 仪器、试剂与样品
Centrol IApc LB962微孔板式发光检测仪(德国Berthold Technologies公司),TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限责任公司,中国),国华BS-1EA型恒温震荡培养箱(中国),12通道移液枪(德国Eppendorf公司);费氏弧菌(V.fischeri)购自中国工业微生物菌种保藏管理中心;CdCl2·2.5H2O(分析纯)、盐酸苯海拉明(DPH, >98%)购自Sigma-Aldrich(中国上海);盐酸四环素(TC, >98.0%)、十二烷基硫酸钠(SDS, >97.0%)购自TCI(日本);敌百草(DIC,标准品)购自DR(德国);1-十二烷基-3-甲基咪唑氯盐(IL, 99%)购自安耐吉(中国);多粘菌素B硫酸盐(PLB, 95%)购自TRC(加拿大)。用超纯水配制标准物质母液并储存于4 ℃冰箱备用,表面活性剂药品提前配制并使用超声波仪器混合均匀,避免起泡影响实验结果。物质基本信息如表1所示。
1.2 二元毒性实验设计
等毒性溶液法(equal toxic solution method, ETS)是一种混合物设计方法,将不同物质按照毒性比1∶1混合,根据预实验结果选择合适的稀释因子,使二元混合物抑制率在EC5至EC90之间均匀分布。该方法具有简单、快速、可视化的优点,常用于研究二元混合物的联合毒性作用[26]。
1.3 生物毒性测定方法
V.fischeri和毒性试验方法按照课题组前期发表的文献所述进行[28-29]。为保证V.fischeri测试菌悬液状态相同,V.fischeri生长至菌密度(OD575)为1.2左右取出备用,重复实验3次,保证3次测试结果误差不超过10%。测试样品对V.fischeri的急性毒性用相对发光抑制率表示,如式(1)所示。
(1)
式中:I为测试样品的发光抑制率(%);R0、R分别为空白样品的发光强度平均值与测试样品的发光强度平均值。
1.4 数据处理和分析方法
1.4.1 数据处理
通过Origin Pro 8.5(OriginLab, North-ampton, MA, USA)软件,采用非线性最小二乘法(non- linear least square, NLLS)法对实验数据进行数学拟合,以获得每个单一化学品和二元混合物的剂量效应曲线(concentration response curves, CRCs)。由于所有的数据集都与Hill函数很好地吻合,Hill方程作为CRCs的数学表达式,如式(2)所示。
I=a×Cm/(bm+Cm)
(2)
式中:I为物质对发光细菌的相对抑制率(%);C为物质浓度(mg·L-1);a为极限浓度对应的效应(%);b为a/2效应对应的浓度(mg·L-1);m为表示斜率的参数(量纲为1)。
1.4.2 混合物分析模型
(1)CA模型
CA模型常常被用来预测具有相同或相似作用机制的毒性物质的混合物[30]。其数学表达式如式(3)所示。
(3)
式中:n为多元混合物的组分数;ECx,i为第i个组分单一存在时,引起x%效应的浓度;ci为混合物中第i个组分的浓度。
(2)IA模型
IA模型是基于化合物组分具有相异的作用原理对其毒性进行预测和评估[31]。数学上IA表达式如式(4)所示。
(4)
式中:n为多元混合物的组分数;ci为混合物中第i个组分的浓度;cmix为混合物的总浓度;E(cmix)为混合物的总效应;E(ci)为表示第i个组分独立存在且其浓度为ci时产生的效应。
(3)TNL模型[13]
TNL模型以理论抑制率与实测抑制率差异确定混合物的联合作用强度。具体原理如图1所示。
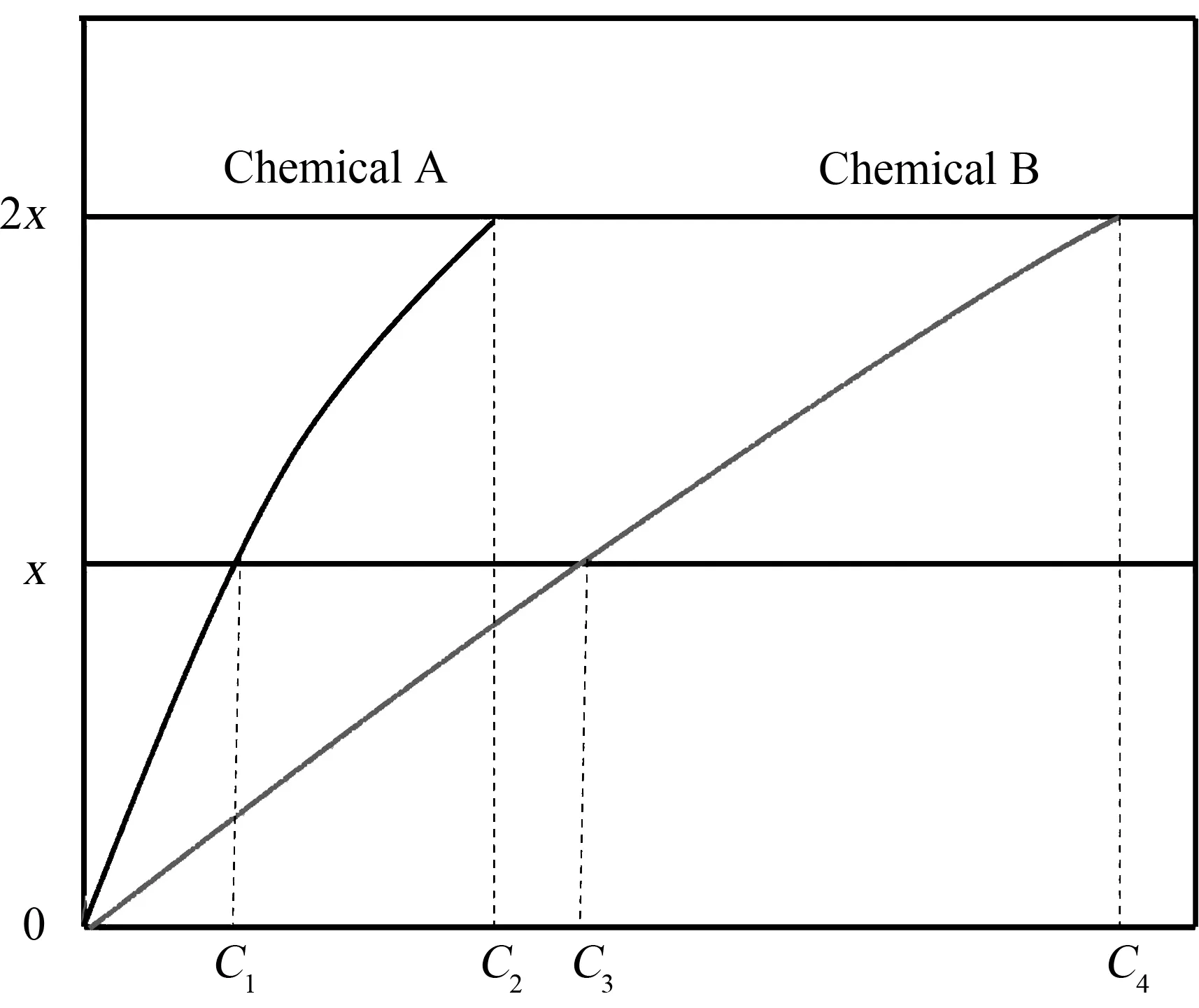
图1 理论非线性联合毒性评价方法图解Fig. 1 Diagram of theoretical non-linear combined toxicity assessment method
TNL模型可实现对各种类型的混合物联合作用的评价,同时也可实现对成分和浓度未知的天然污水构成混合物联合作用的评价[14],原理上TNL可以解释为:物质A与物质B分别在C1、C3浓度时可以达到抑制率x(x%≤50%),在C2、C4浓度时可以达到抑制率2x(x%≤100%)。当二者混合,利用物质A的C1浓度代替物质B的C3浓度,使混合物浓度变为(C4-C3+C1),如果抑制率依旧为2x,则说明二者作用是加和的。如果小于2x,则说明物质A与物质B发生拮抗作用;若大于2x,则说明物质A与物质B发生协同作用。
2 结果(Results)
2.1 7种化学物质对V. fischeri的毒性
测定了7种化学物质对V.fischeri的单一毒性,其CRCs如图2所示。
由图2可知,单一物质对V.fischeri的CRCs呈现单调非线性趋势,随着物质浓度的增加,抑制率也随之增大。根据拟合结果来看,所有CRCs的修正的相关系数平方(Adj.R2)高于0.98,简化卡方检验(Red.Chi-S)低于15,表示所有CRCs均能很好地被Hill函数拟合。以EC50来评价物质毒性的大小,7种化学物质的毒性顺序为:IL>Cd2+>PLB>SDS>DIC≈TC>DPH。毒性最强的化学物质是IL,毒性最小的化学物质是DPH。在2种抗生素中,PLB生物毒性比TC高出27.3倍,该结果和PLB作为应对细菌最后一招的杀菌剂相一致。参数m值一定程度上反映了曲线的走势,从拟合方程参数来看,7种物质的CRCs差异较大,7种化学物质的m值顺序为:Cd2+>TC>IL>DIC>PLB>DPH>SDS。m越大,曲线中间段越陡峭,例如:Cd2+、DIC、IL、TC,m值在3.6~6.7之间变化。m值越接近1,曲线中间段越平缓,例如:SDS、DPH和PLB。

图2 7种化学物质对V. fischeri毒性的剂量效应曲线注:IL表示1-十二烷基-3-甲基咪唑氯盐;PLB表示多粘菌素B硫酸盐;DIC表示敌百草;TC表示盐酸四环素;SDS表示十二烷基硫酸钠;DPH盐酸苯海拉明。Fig. 2 The concentration-response curves of seven chemicals on V. fischeriNote: IL stands for 1-dodecyl-3-methylimidazolium chloride; PLB stands for polymyxin B sulfate; DIC stands for dicamba; TC stands for tetracycline hydrochloride; SDS stands for sodium lauryl sulfate; DPH stands for diphenhydramine hydrochloride.
2.2 二元混合物对V. fischeri的毒性
根据1.2节方法将7种化学物质混合,用微孔板法测定了21组等毒性混合物对V.fischeri的急性毒性。二元混合物的CRCs均可用Hill方程较好地拟合。二元混合物的急性毒性拟合信息如表2所示,包括混合物浓度比、拟合参数、Adj.R2和Red.Chi-S。
由表2可知,所有的Adj.R2值都>0.98,Red.Chi-S值<9,说明Hill函数也能很好地拟合二元混合物。根据实验结果来看,21种二元混合体系对V.fischeri表现出了不同的抑制作用,其中毒性最强的混合物是IL+PLB,毒性最小的混合物是Cd2++DPH。

表2 二元混合物拟合函数的统计参数Table 2 The statistic parameters of the binary mixtures fitting function
2.3 联合毒性作用类型分析
利用CA、IA和TNL模型对21种二元混合物进行联合毒性分析,通过比较二元混合物的实测的CRCs与IA模型预测的剂量效应曲线(IA-CRCs)、CA模型预测的剂量效应曲线(CA-CRCs)和TNL模型预测的剂量效应曲线(TNL-CRCs)的偏差,确定二元混合物的毒性联合作用,二元混合物整个浓度区间的联合作用分析如图3所示。
由图3可知,21组二元混合物的毒性评价,有14组实测CRCs与IA-CRCs、CA-CRCs、TNL-CRCs发生较大偏离,说明这些混合物产生了较强的相互作用(拮抗或协同),占总数的67%。这一结果进一步验证了课题组前期的研究结果,CRCs形状差异较大的2种物质组成的混合物易产生相互作用[32]。CA、IA和TNL这3种模型对二元混合物联合作用评价结果不尽相同。按照IA-CRCs、CA-CRCs和TNL-CRCs在整个浓度区间的偏离程度,11组混合物,IA和TNL模型的评价结果更接近,例如Cd2++DPH、DIC+TC和SDS+PLB等,图中以A类型标注;6组混合物,CA和TNL模型的评价结果更接近,例如Cd2++SDS、DPH+DIC和TC+IL等,图中以B类型标注;3组混合物,CA和IA模型的评价结果更接近,例如,DPH+SDS、DIC+IL和TC+PLB,图中以C类型标注,在高浓度区域,CA和IA模型对组合DIC+IL的评价差异增大。该现象在宋晓青等[33]和王滔等[34]的研究中也被发现。有1组混合物(DPH+TC),CA和、IA、TNL这3个模型的评价结果均接近,图中以D类型标注。通过比较A、B和C类型混合物各组分拟合曲线的参数m发现:A、B类型混合物,m值差异大,例如混合物Cd2++SDS的m值差异百分比为83.6%;混合物TC+SDS的m值差异百分比为76.6%;C类型混合物,m值差异小,例如混合物DPH+SDS的m值差异百分比为15.4%;混合物DIC+IL的m值差异百分比为5.3%。
3 讨论(Discussion)
CA模型存在某些预测盲区,应用CA模型预测某个效应的混合物总浓度,就必须保证混合物中的各个组分单独存在时有此效应浓度[6]。例如,由于组分PLB最高抑制率只能在65%左右,在高浓度区域没有相应抑制率,Cd2++PLB、DIC+PLB和TC+PLB 3组混合物中CA模型并不能准确评价其高浓度混合物毒性。IA模型虽然不存在预测盲区,但是,IA模型是一个纯粹的理论构想:混合物中的所有组分通过不同的毒性作用模式和机制相互独立地作用于靶点。实际上,在有机体内任何复杂的、相互依赖的生理途径中,这种情况是否会发生是有疑问的。此外,由于IA假设两者的作用机制是完全不同的,那么在混合物中,任何涉及的成分有多个或非特定的机制就不能完全遵循IA模型[35],而IA模型对混合物毒性评价结果也在高浓度区域的差别逐渐增大[36]。对于TNL模型无法解释的由同一种物质组成的“虚拟组合”,IA模型同样不适用,例如物质十二烷基硫酸钠(SDBS),其EC10对应浓度为34.9 mg·L-1,EC30对应浓度为44.6 mg·L-1,根据IA模型预测混合物效应为37%,但实测效应为98%,相差61%。在环境毒理学中,协同作用被认为是2种或2种以上环境化学品同时作用于机体所产生的生物学作用的强度远远超过各化学品单独作用强度的总和,而拮抗作用指2种环境化学品同时作用于机体时,其中一种化学品可干扰另一种化学品的生物学作用,或2种化学品相互干扰,使混合物的毒作用强度低于各自单独作用的强度之和[37-39]。TNL模型以二元混合物各组分的浓度和为自变量,以混合物的理论抑制率(各组分单独存在时对应抑制率之和)为因变量,用理论抑制率与实测抑制率差异确定混合物的联合作用强度,符合毒理学关于联合作用的定义。Gao等[13]也从铜绿微囊藻体内氧化酶的活性,活性氧、丙二醛浓度等角度证明了TNL对混合物联合毒性评价结果的正确性。在实验结果中,52%的组合TNL模型评价的结果与IA模型评价的结果更接近,24%的组合TNL模型评价的结果与CA模型评价的结果更接近。
CA、IA各自存在一定的不足之处,TNL模型可以作为补充模型,将CA、IA模型共同应用于混合物联合作用评价。TNL模型的应用对象是不同物质组成的混合物,不适用于“虚拟组合”。因此,当曲线形状差异小时,CA模型评价结果与IA模型相近。由于CA模型相对保守[6, 35],更适合混合物的毒性预测和生态环境的风险评估[40],因此选用CA模型进行评价。若CA模型出现预测盲点时,直接选用IA模型;当曲线形状差异大时,根据毒理学对联合作用的定义,直接使用TNL模型来评价混合物的作用方式。
通讯作者简介:王娜(1981—),女,博士,讲师,主要研究方向为生态毒理学。
