生脉饮中五味子醇乙在正常和心肌缺血模型大鼠中的药物代谢动力学研究
2022-06-06杨苛周玮玲刘心煜张迎樊瑜歆胡慧玲游宇
杨苛,周玮玲,刘心煜,张迎,樊瑜歆,胡慧玲,游宇
心肌缺血(Myocardial Ischemia)是由于心脏的血液灌流不足从而造成了心肌缺血缺氧,导致其不能维持心肌细胞进行正常工作状态的一种病理现象,根据个人身体情况的不同会表现为心前区或胸骨后的疼痛、心律失常或呼吸困难等症状[1]。心肌缺血属于心血管疾病中的一种类型,最近公布的《中国心血管健康与疾病报告2020》发现,由于现代经济水平的提高,人们的生活方式和生活标准也随之发生变化,中国心血管疾病的患病人数逐年增长,并愈加倾向于年轻化和低龄化转变[2]。
生脉饮为“益心复脉”的经典名方,全方由人参、麦冬和五味子三药组成,一补一润一敛,有滋阴补气、润肺清心、收敛固涩之效,在临床上被广泛用于治疗各种心系疾病[3,4]。现代药理研究表明,生脉饮具有保护心肌细胞的作用,从而能够改善心脏功能[3]。生脉饮能改善气阴两虚型心肌缺血病症结合大鼠模型心肌的缺血状况,从而保护心肌细胞[5]。对五味子抗心血管疾病的研究发现,抗氧化、抑制细胞凋亡、抗炎等是其主要机制[6]。而五味子醇乙作为五味子中的主要药效成分,也具有很强的抗氧化[7]、抗细胞凋亡[8]、抗炎[9]等作用,但对其抗心肌缺血的研究较少。因此本实验通过对大鼠尾静脉注射垂体后叶素建立心肌缺血模型,灌胃生脉饮后,比较正常和心肌缺血大鼠五味子醇乙的药物代谢动力学参数。
1 实验材料
1.1 仪器与试药
UltiMate 3000超快速液相色谱仪(美国赛默飞世尔科技公司);BL-420N生物信号分析系统(成都泰盟软件有限公司);电子天平;RE-52AA型旋转蒸发仪(上海亚荣生化仪器厂);RG-160AT型台式高速离心机(上海卢湘仪离心机仪器有限公司);DZKW-4型电子恒温水浴锅(北京中兴伟业仪器有限公司);干式氮吹仪(杭州瑞诚仪器有限公司)。
红参、麦冬、五味子饮片均购自四川新荷花中药饮片股份有限公司,生产批号依次为2003105、2006071、2001087。五味子醇乙对照品(CHB190121)、地高辛对照品(CHB200514)均购自成都克洛玛生物科技有限公司,纯度均>98%;垂体后叶素注射液(6 U﹒mL-1, 安徽宏业药业有限公司,批号:191135)。
1.2 实验动物
雄性健康SPF级SD大鼠(体重220±20 g),购自成都达硕实验动物有限公司,生产许可证号:SCXK(川) 2015-30。
大鼠于温度24~26 ℃、相对湿度55~75 %、12 h/12 h昼夜交替的适宜环境中适应性喂养一周,给予标准饲料与自由饮水。
2 实验方法
2.1 生脉饮灌胃液的制备
按照生脉饮处方剂量称取红参25 g,麦冬50 g,五味子25 g,加水煎煮2次。第一次加8倍量水武火煎煮至微沸,再转文火慢煎30 min,药液滤过备用;第二次加6倍量水以同样步骤煎煮30 min,过滤后与第一次滤液合并,浓缩至含原药材1 g﹒mL-1的灌胃液。
2.2 内标溶液的制备
精密称取一定量的地高辛对照品,用甲醇溶解,配制成1 mg﹒mL-1的内标母液,于4 ℃保存,临用前稀释成20 μg﹒mL-1的内标溶液。
2.3 标准溶液的配制
五味子醇乙对照品母液的配制:精密称取一定量五味子醇乙对照品,用甲醇溶解,并定容于25mL容量瓶中,得到各对照品储备液(1 mg﹒mL-1),‐4℃保存。
五味子醇乙的标准曲线样品的配制:取一定量五味子醇乙对照品母液,用大鼠空白血浆将其稀释,得到不同浓度的标准品溶液(25.0、12.50、6.25、3.12、1.56、0.78、0.39 μg﹒L-1)。同时,用大鼠空白血浆稀释制备得到高、中、低浓度为20.00、5.00、0.625 μg﹒L-1的质控工作液,‐80 ℃保存待用。
2.4 急性心肌缺血模型制备
2.4.1 正常心功能大鼠筛选 SD大鼠腹腔注射10%
水合氯醛溶液(0.38ml﹒kg-1),麻醉后连接BL-420N生物机能实验系统,平衡后以大鼠心电图ST段未见异常(<0.1 mV),J点(QRS波群与ST段交界处后20 ms左右)明显,心律整齐为特征,剔除心电图异常者。
2.4.2 动物分组与急性心肌缺血大鼠模型制备 将筛选出的12只正常心功能大鼠随机分成实验组和对照组,每组6只,实验组尾静脉匀速注射垂体后叶素2.00 U﹒kg-1(3 U﹒mL-1),对照组尾静脉匀速注射生理盐水0.66 mL﹒kg-1,记录注射后1、3、5、10、15、30分钟时的心电图,以ST水平下降或抬高幅度值大于0.10 mV且T波下降值大于50 %双向、倒置、拉直线为造模成功的判断指标。
2.5 给药方案及血液样品收集
实验组和对照组大鼠在灌胃前,禁食不禁水12 h,在造模给药结束后30 min,实验组和对照组大鼠口服灌胃给予1 g﹒mL-1生脉饮灌胃液(10 g﹒kg-1),给药前0 h和给药后0.083,0.25,0.5,0.75,1.0,1.5,2.0,4.0,8.0,12.0,24.0 h进行尾静脉采血0.3 ml,置1.5 mL肝素化离心管中,离心(4 ℃,12000 rpm,10 min),取上清液,‐80 ℃保存。
2.6 血浆样品处理
精密吸取2.2.5项下血浆100 μL,加入20 .0 μL地高辛内标液(20 μg﹒L-1),先加入100.0 μL甲醇沉淀蛋白质,再加入1.0 mL乙酸乙酯,2000 r﹒min-1涡旋萃取3 min,12000 r﹒min-1离心10 min,吸取上清液37 ℃氮气吹干,残留物以50.0 µL甲醇复溶,取上清液进样分析。
2.7 色谱条件
流动相为0.1 %甲酸水溶液(A)-乙腈(B);梯度洗脱(0~2 min,23 %B;2~4 min,23 %~35%B;4~8 min,35 %~60 %B;8~15 min,80%~90 %B);流速0.8 mL﹒min-1;进样量为8.0 μL;柱温35 ℃;检测波长为203 nm。

表1 洗脱程序
3 实验结果
3.1 方法学验证
3.1.1 专属性 在选定的条件下,分别取空白大鼠血浆、空白大鼠血浆+五味子醇乙、灌胃后1 h血浆样品,通过对比分析得出血浆中的内源性成分和待测成分不会相互影响,专属性良好。
3.1.2 标准曲线和定量下限 取不同浓度的五味子醇乙标准品溶液,以五味子醇乙的理论浓度为横坐标,五味子峰面积与内标峰面积的比值为纵坐标,进行线性回归拟合,得到五味子醇乙的标准曲线线性回归方程。拟合出的五味子醇乙标准曲线:Y=0.1676+0.1224(R2=0.994),在线性范围0.39~25 μg﹒L-1内线性关系良好,该方法下的定量下限LLQQ为0.39 μg﹒L-1。
3.1.3 精密度和准确度 取高、中、低浓度(20.00、5.00、0.625 g﹒mL-1)五味子醇乙QC样品,每个浓度平行制备5份,每个样品在一天内重复测定三次,计算日内(Intra-day)的精密度和准确度;再同一时间连续三天重复测定,相同方法计算日间(Inter-day)的精密度和准确度。五味子醇乙的日内和日间的精密度RSD范围为10.85~15.08%,五味子醇乙的日内和日间的准确度RE均小于7.79 %,表明该方法测定精密度和准确度良好。
3.1.4 稳定性 血浆样品中五味子醇乙的稳定性采用以下方法来验证:高、中、低浓度(20.00、5.00、0.625 μg﹒L-1)五味子醇乙QC样品分别在室温下放置12 h、‐80 ℃下冻存5天以及‐20 ℃反复冻融5次,通过以上三种不同的储藏条件,验证该方法血浆样品中五味子醇乙的稳定性。
高、中、低浓度(20.00、5.00、0.625 μg﹒mL-1)五味子醇乙QC样品分别在室温下放置12 h、‐80 ℃下冻存5天以及‐20 ℃反复冻融5次的准确度范围为91.64~108.88 %,表明该方法的稳定性良好。
3.1.5 回收率 取高、中、低浓度(20.00、5.00、0.625 g﹒mL-1)五味子醇乙QC样品,每个浓度平行制备5份,根据内标法计算出实际浓度,实际浓度与理论浓度的比值即为回收率。五味子醇乙在高、中、低三个QC样品浓度下(20.00、5.00、0.625 μg﹒mL-1)回收率分别为101.36±12.20 %、102.91±12.19 %和113.71±7.69 %,其回收率均大于80%且小于120%,表明此方法回收率良好。
3.1.6 基质效应 取高、中、低浓度(20、5、0.625 g﹒mL-1)五味子醇乙QC样品,每个浓度平行制备5份,得到含有大鼠空白血浆基质的峰面积A;同时利用蒸馏水代替大鼠空白血浆,按照相同方法,制备不含有大鼠空白血浆的高、中、低浓度(20.00、5.00、0.625 g﹒mL-1)五味子醇乙样品,每个浓度平行制备5份,进样分析,得到不含大鼠空白血浆基质的峰面积B。
根据上述方法得到的色谱峰面积,计算基质效应因子(matrix infactor, MF):基质效应因子=峰面积A/峰面积B;内标归一的MF=五味子醇乙的MF/内标的MF
结果表明,在本试验条件下,内标归一化的MF的变异系数均小于15 %,说明该方法符合生物样品定量分析方法验证指导原则,基质对于实验样品中化学成分的测定没有影响。
3.1.7 血浆中残留评价 取标准曲线最高浓度样品(25 μg﹒L-1),与50 %A流动相和50 %B流动相制备的空白样品交叉连续进样6次,记录峰面积,评估五味子醇乙在色谱柱中残留行为。结果显示,五味子醇乙和内标血浆样品在该方法中残留低,不影响样品色谱峰,实验方法符合生物样品定量分析方法验证指导原则。
3.2 药代动力学结果
3.2.1 五味子醇乙药代动力学研究结果 五味子醇乙在心肌缺血模型和正常大鼠血浆中的血药-浓度曲线图如图2所示,从图可以看出,在灌胃给予生脉饮后,模型组与对照组相比血浆中五味子醇乙的最大浓度更高,吸收较快,药时曲线面积更大。
通过PKSolver 2.0统计软件进行药代动力学拟合计算,五味子醇乙在大鼠体内的代谢过程符合非房室模型,相关药动学参数如表2所示。结果显示心肌缺血大鼠与正常大鼠相比较Cmax、AUC (0-inf)、MRT (0-inf)、Vz/F增大,而Cl/F减小。
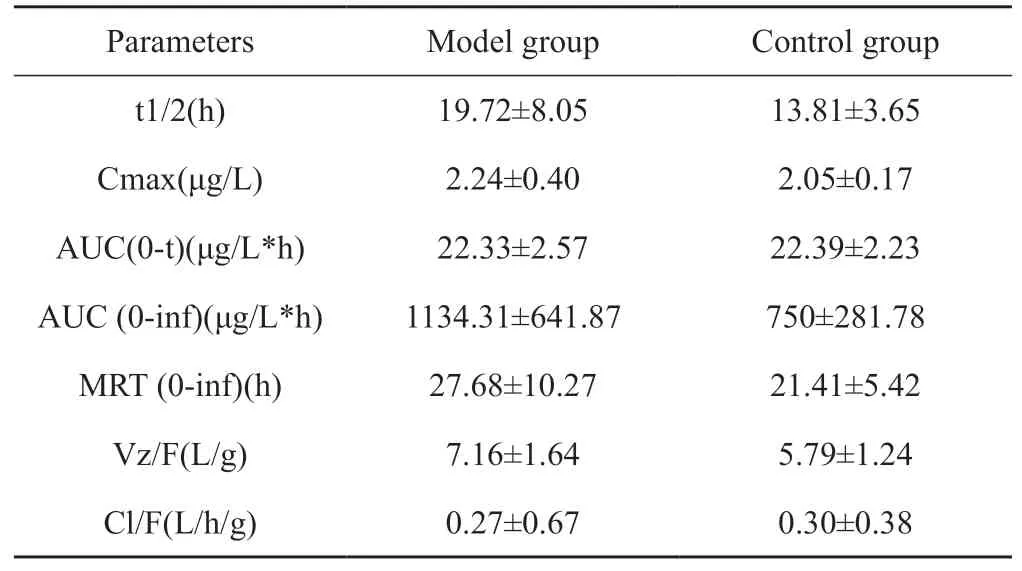
表2 模型组和对照组五味子醇乙的药代动力学参数(x±S, n=6)
4 讨论
随着对心肌缺血病因、发病机制等研究的深入,心肌缺血模型建立方法以及评价指标逐步完善,心肌缺血模型可分为:急性心肌缺血模型、慢性心肌缺血模型、可控性心肌缺血模型和离体心肌缺血模型[1]。急性心肌缺血模型是基于临床心肌缺血特点而建立的一种短期的实验模型,一般通过手术或者药物进行造模。但手术造模存在操作要求高,且易造成动物死亡的问题。因此本实验采用尾静脉注射垂体后叶素进行药物造模,垂体后叶素可引起冠状动脉痉挛,血管外周阻力增大,心肌细胞的负荷增加,从而出现心机供血不足造成心肌缺血,该方法的操作简便有效且比较接近人心绞痛的病理状态[10]。垂体后叶素制备心肌缺血模型时的剂量通常为0.6-1.5 U﹒kg-1[11、12],但预实验采用1.0 U﹒kg-1剂量制备时,发现大鼠维持心肌缺血的心电图表现时间较短,不能达到实验要求,因此正式实验采用2.0 U﹒kg-1[13]垂体后叶素制备心肌缺血大鼠模型,心电图的各段指标符合心肌缺血大鼠模型的要求,认为建模成功。
运用PKSolver 2.0处理五味子醇乙的血药浓度,拟合得到五味子醇乙在大鼠体内的过程符合非房室模型,通过比较正常组和模型组大鼠,五味子醇乙在心肌缺血模型大鼠的Cmax、AUC (0-inf)、MRT(0-inf)、Vz/F增大,而Cl/F减小,说明五味子醇乙在心肌缺血大鼠中吸收度好、体内滞留时间长,清除率小,更说明了生脉饮在治疗心肌缺血方面的合理性,符合临床上使用生脉饮用于治疗心系疾病。
