3种血清学指标与糖尿病周围血管病变的相关性研究
2022-06-06蔡金平陈珊珊
蔡金平,陈珊珊
(海南省儋州市人民医院 药学部,海南 儋州,571700)
目前,糖尿病已经成为中国重要的非传染性疾病,周围血管病变是该病致死、致残的重要原因之一,动脉粥样硬化(AS)是糖尿病周围血管病变的病理基础[1-2]。脂蛋白相关磷脂酶(Lp-PLA2)属于一种与动脉粥样硬化具有一定相关性的炎症标志物,可能参与了动脉粥样硬化的发展过程[3]。研究[4]发现,冠心病患者的Lp-PLA2水平会显著上升,Lp-PLA2属于冠心病的独立影响因素,受到冠状动脉狭窄程度的影响。同型半胱氨酸(Hcy)属于血管损伤性氨基酸,血清Hcy处于高水平,与动脉粥样硬化密切相关,也属于动脉粥样硬化的独立影响因素。研究[5]表明,2型糖尿病(T2DM)患者的Hcy水平高于健康人群,同时与患者周围血管病变程度呈显著正相关。糖化血红蛋白(HbA1c)是血糖和血红蛋白反应之后得到的产物,稳定性强且存在不可逆性,可以有效判断患者血液抽取前1~2个月的血糖平均水平,也可以体现患者2~3个月的血糖控制情况[6]。目前,关于HbA1c、Lp-PLA2、Hcy联合检测对糖尿病患者周围血管病变的相关性研究非常少。本研究探讨HbA1c、Lp-PLA2、Hcy水平与糖尿病患者周围血管病变的相关性,为T2DM的临床早期防治提供一定的理论依据。
1 资料与方法
1.1 一般资料
选择2018年6月—2019年9月206例诊断为T2DM的患者为研究对象,均符合世界卫生组织(WHO)制定的诊断及分型标准[7]。对全部患者进行冠状动脉造影和颈动脉彩超检查测定,同时对颈动脉内膜中层厚度(IMT)进行记录,根据检查结果的不同,将患者分为颈动脉正常患者(正常组,116例)和糖尿病伴有颈动脉粥样斑块患者(粥样斑块组,90例)。排除标准:① 伴有高渗性昏迷、感染等并发症者;② 伴有甲状腺、肾上腺、性腺等内分泌系统疾病者;③ 伴有恶性肿瘤及血液系统疾病者;④ 伴有风湿性疾病者;⑤ 生活不能自理者;⑥ 心、肝、肾功能异常者。全部受试者均签署了知情同意书,且本次研究通过了医院伦理委员会的审核。
1.2 方法
测量全部T2DM患者的身高及体质量,并对体质量指数(BMI)进行计算,重复3次操作并取平均值。全部患者均在空腹、早餐后2 h采血,并在同一时间段应用生化分析仪测定血糖、甘油三酯、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、HbA1c,再经化学发光仪测定超敏C反应蛋白(hs-CRP)、C肽。采用彩色多普勒超声(PHILIPS HDI-5000)检查患者颈内、颈外动脉,主要包括回声强度、多普勒血流动力学、IMT、管径。选择宽频线阵探头(5~12 MHz),全部患者均在早晨空腹取6 mL静脉血,并采取离心方式处理得到血浆,应用酶联免疫吸附(ELISA)法检测Lp-PLA2水平。
采用常规冠状动脉造影(6 F造影管)得到全部患者的造影图像,并通过分析系统对造影图像进行分析[8],测定患者冠状动脉血流储备(CFR)、冠状动脉血流储备分数(FFR)、冠状动脉微循环阻力指数(IMR)。先将压力导丝浸润在室温生理盐水中,再经冠状动脉指引导管将压力导丝感应器引入左主干开口处,校正测得的主动脉温度和压力。成功校正后,在血管狭窄病变远端2/3处导入压力导丝,在冠状动脉血管中泵入三磷酸腺苷(ATP),速度保持在140 μg/(kg·min),直至达到最大充血状态,读取分析仪上的冠状动脉血流储备分数,当病变分数高于0.8时,再对冠状动脉血流储备、IMR进行测量,在冠状动脉内通过引导管注射约4 mL室温生理盐水,压力导丝杆轴温度感受器会根据温度变化、生理的高度分别记录2条温度曲线,重复3次操作后记录平均传输时间。通过前臂静脉向冠状动脉血管中泵入ATP,速度保持在140 μg/(kg·min),直至达到最大充血状态,在冠状动脉内通过引导管注射约4 mL室温生理盐水,冲洗干净导管内的残留造影剂及温暖液体,重复3次操作后得到冠状动脉最大充血状态下平均传输时间及平均压,IMR=平均压×平均传输时间。
1.3 观察指标
测量所有患者BMI、HbA1c、Lp-PLA2、Hcy、餐后2 h血糖、空腹血糖、餐后2 h C肽、空腹C肽、总胆固醇、甘油三酯、HDL-C、LDL-C等指标。治疗后,随访6~12个月,比较患者Hcy、Lp-PLA2、HbA1c指标。随访后详细记录患者死亡、心肌梗死、支架内血栓、病变血管再次狭窄等不良反应发生情况。
1.4 统计学分析
2 结 果
2.1 2组患者一般资料比较
粥样斑块组与正常组hs-CRP和尿酸水平比较,差异有统计学意义(P<0.05);2组年龄、性别等一般资料比较,差异无统计学意义(P>0.05),见表1。
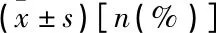
表1 2组患者一般资料比较
2.2 血清学指标及不良事件发生情况比较
治疗后6、12个月,对T2DM患者进行随访。随访第6、12个月时,粥样斑块组HbA1c、Lp-PLA2、Hcy与治疗前比较,差异无统计学意义(t=1.759、1.436、1.647,P>0.05);正常组HbA1c、Lp-PLA2、Hcy与治疗前比较,差异无统计学意义(t=1.644、1.549、1.931,P>0.05)。随访第6个月时,2组HbA1c、Lp-PLA2、Hcy比较,差异有统计学意义(t=20.533、20.864、24.036,P<0.001);随访第12个月时,2组HbA1c、Lp-PLA2、Hcy指标比较,差异有统计学意义(t=28.695、22.502、36.394,P<0.001),见图1。
粥样斑块组随访第6个月时的不良事件发生率为21.54%,高于正常组的7.77%,差异有统计学意义(P=0.006);粥样斑块组随访第12个月时的不良事件发生率为50.00%,高于正常组的15.54%,差异有统计学意义(P<0.001),见图2。


2.3 T2DM患者各指标与IMT的相关性
Pearson相关分析显示,T2DM患者血浆Lp-PLA2与总动脉、外动脉及双侧颈内动脉IMT呈显著正相关(P<0.05);尿酸与右颈总动脉、外动脉、内动脉IMT呈显著正相关(P<0.05);餐后2 h C肽水平与左颈外动脉、内动脉、右颈外动脉IMT呈显著正相关(P<0.05);其他指标均与IMT无显著相关性(P>0.05),见表2。

表2 T2DM患者各指标与IMT的相关性分析(r值)
2.4 Lp-PLA2与T2DM患者血管并发症影响因素的Logistic回归分析
将因变量设定为“患者是否伴有颈动脉粥样斑块”,协变量设定为“患者的年龄、性别、BMI”等,应用前进法对影响因素进行筛选。Logistic分析结果显示,Lp-PLA2、hs-CRP是糖尿病血管并发症的主要影响因素,见表3。

表3 T2DM患者各指标与IMT的相关性

A:IMR与Hcy的相关性;B:IMR与Lp-PLA2的相关性;C:IMR与CFR的相关性。图3 IMR与Lp-PLA2、Hcy、CFR的相关性
2.5 IMR与Lp-PLA2、Hcy的相关性
Hcy与IMR呈显著正相关(P<0.001),Lp-PLA2与IMR无显著相关性(P=0.146),CFR与IMR呈显著负相关(P<0.001),见图3。
2.6 IMR升高的多因素回归分析
多因素Logistic回归结果显示,IMR升高的危险因素为Hcy和年龄,IMR升高的保护因素为HDL-C、CFR,见表4、表5。
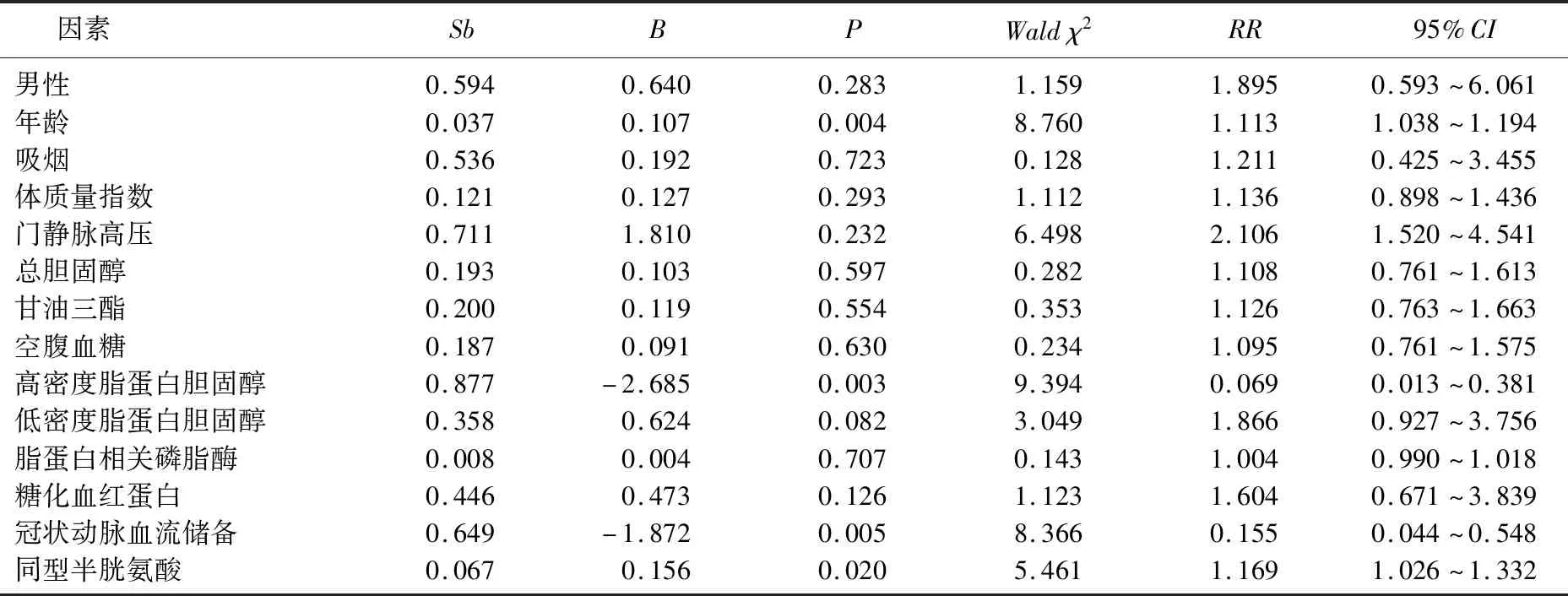
表4 单因素 Logistic 回归分析

表5 多因素 Logistic 回归分析
3 讨 论
糖尿病周围血管病变是糖尿病致死、致残的重要原因,糖尿病也是冠心病的主要危险因素之一,要更加注意糖尿病患者各项指标的监控,并积极有效地进行治疗,最大限度降低发生不良事件的概率[9]。HbA1c是血糖和血红蛋白的产物,并且HbA1c转化成功后具有不可逆性,能够有效体现人体内2~3个月的血糖控制状况[10]。本研究结果表明,HbA1c、Lp-PLA2、Hcy水平偏高的T2DM患者具有较高的不良事件发生率。黄晓怡等[11]指出,当HbA1c为9%以上时,患者血糖控制最差,慢性并发症发生概率最高;HbA1c为8%~9%时,患者血糖控制较差;血糖控制的理想范围为HbA1c在7%以下。Lp-PLA2属于脂肪水解酶,能够和炎症产生反应而引起冠状动脉的粥样硬化,同时还与胰岛素抵抗具有较强相关性[12]。Hcy属于一种代谢中的伴生的氨基酸,可促进患者体内自由基的形成,造成内皮细胞功能损伤[13]。
糖尿病患者周围血管病变是在多种致病因素的共同作用下导致,如冠状前小动脉及其功能、结构的异常等都是患者临床综合征的客观证据[14]。本研究表明,所有患者CFR与IMR呈显著负相关(P<0.01),FFR>0.8时,CFR能够看作是评价微循环的方法,且可以体现冠状动脉的血流储备情况。研究[15]指出,动脉僵硬度增加和冠状动脉血流储备减少主要是由于Lp-plA2内皮功能障碍和水平升高所致。但本研究结果显示,Lp-PLA2与IMR并不存在明显相关性,可能是由于本研究患者例数较少所致。
研究[16-17]表明,Lp-PLA2是与动脉粥样硬化相关性较高的炎症因子。本研究表明,粥样斑块组的Lp-PLA2水平显著高于正常组,说明粥样斑块组患者存在亚临床轻微慢性炎症。Lp-PLA2升高的原因主要是T2DM患者的胰岛素抵抗,同时炎症及氧化应激发挥了一定作用,Lp-PLA2产生的氧化游离脂肪酸促进了胰岛素抵抗的持续性,从而造成慢性炎症长期存在[18]。本研究结果还显示,Lp-PLA2是糖尿病患者周围血管病变主要影响因素,可能原因是Lp-PLA2促进生成炎性产物并将其转化为可活化内膜粒细胞,以致生成了大量Lp-PLA2,最后造成促炎物质的持续正调节,加快了粥样斑块的进展,导致血栓及不良事件[19]。
本研究结果显示,T2DM患者的Hcy水平与IMR具有显著相关性,原因是Hcy能够自身氧化为H2O2与超氧化物,造成内皮功能的损伤,使得硫酸乙酰肝素蛋白多糖发生降解,造成内皮细胞对氧化损伤的拮抗能力下降[20]。Hcy在代谢时,内皮细胞中会进入活性硫醇化合物,从而破坏DNA的双链结构,抑制DNA合成。Hcy也能够促进血管平滑肌细胞的DNA生成,平滑肌细胞过度有丝分裂后会加厚血管壁,损伤血管的舒张功能;同时,Hcy自身氧化能力会造成低密度脂蛋白的氧化,使得NO的生成减少,从而抑制前列腺醇的合成,减弱血管舒缩功能。Hcy能够抑制血栓调节蛋白表达和蛋白C活性,提升血栓素的生成能力,提升血小板聚集性和黏附性[21]。Hcy能够激活单核细胞来促进细胞黏附分子、白细胞介素8、单核细胞引诱蛋白1等促炎细胞因子的分泌,进一步促进炎症的发生。HDL-C水平升高是微循环功能不全的保护因素,随着年龄的增长,冠状动脉微循环自我调节功能有所下降。HDL-C对微循环的保护作用机制可能是HDL介导的胆固醇逆向转运、抗氧化、促纤溶、抗血栓等作用。本研究发现,IMR升高提示微循环障碍时HDL-C水平会降低。因此,微循环障碍发生过程中,低水平HDL-C可能参与其中。
综上所述,HbA1c、Lp-PLA2、Hcy是糖尿病患者周围血管病变的独立危险因素,对预测 T2DM周围血管病变具有一定意义。由于本临床研究的样本量较小,因此在测量数据方面会存在较小误差,今后将增大样本量和延长研究时间来进一步证实。
