动脉粥样硬化相关的炎性信号通路的研究进展
2022-06-06张风,郑刚,,齐婧,高源
张 风,郑 刚,,齐 婧,高 源
(1.陕西中医药大学,陕西 咸阳,712046;2.陕西中医药大学第二附属医院 科研部,陕西 咸阳,712000)
动脉粥样硬化(AS)是一种慢性血管炎性疾病,以脂质代谢紊乱、炎性细胞浸润、出血及血栓形成和纤维组织增生等为主要病理改变,是导致冠心病、高血压病、脑卒中等心脑血管疾病的病理基础,对人类健康造成极大威胁[1]。关于AS的发病机制尚未完全明了,目前有脂质浸润学说、平滑肌克隆学说、血栓形成学说、炎症反应学说等[2],其中炎症反应学说对AS发病过程的解释较为全面,在学术界受到了广泛认可。本文对炎症反应参与AS的病理生理机制及相关信号通路进行深入探索,有助于发现新的药物作用靶点,为防治AS提供研究思路。
1 炎症反应与AS的发生机制
AS曾被认为是一种脂质物质在血管壁缓慢聚集的过程。20世纪末,国外专家ROSS R[3]提出AS的“损伤反应”学说,表明AS是一种多因素诱导的慢性炎症型疾病,随后相关研究结果印证了这一观点,AS涉及复杂的循环血细胞(如血小板、单核细胞)和血浆成分(如脂蛋白),在高脂、高糖等外界因素刺激下与血管壁细胞(如内皮细胞)相互作用,介导AS。
AS的早期机制是动脉内膜的内皮细胞渗透性屏障功能破坏,使循环血液中的脂蛋白等物质沉积并最终依附在动脉管壁上,进而被氧化修饰为低密度脂蛋白胆固醇,在局部引发炎症反应。与此同时,血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)分泌增多,白细胞在多种趋化因素介导下向内皮损伤处迁移、黏附,从而在内皮下集聚,其与内皮细胞分泌的炎性介质触发血管局部慢性炎症反应,介导AS斑块的形成[4]。
动脉管壁上一旦有白细胞附着,单核细胞趋化蛋白-1(MCP-1)促使单核细胞分化成巨噬细胞,氧化型低密度脂蛋白(OX-LDL)可被巨噬细胞清道夫受体(SR)快速识别并吞噬,趋化巨噬细胞转化为泡沫细胞,泡沫细胞胞质内充满脂质小滴,相互聚集在血管壁上形成“脂质条纹”[5]。同时,吞噬脂蛋白的巨噬细胞和受损的内皮细胞合成并分泌白细胞介素(IL)-6、肿瘤坏死因子-α(TNF-α)、基质金属蛋白酶(MMPs)、血小板源生长因子(PDGF)、成纤维细胞生长因子(FGF)等促炎因子和生长因子,促使免疫细胞浸润在局部形成脂质池,促进炎症反应和斑块的生长。
动脉中膜平滑肌细胞(SMC)在PDGF和FGF的共同趋化下,迁移至动脉内膜下并增殖。SMC衍生胶原等细胞外基质蛋白,形成具有保护作用的纤维帽覆盖在斑块上,使斑块更加稳定,而活化的巨噬细胞可分泌多种MMPs,胞外基质蛋白和间质胶原蛋白可被其降解,导致纤维帽变薄、斑块易于破裂;同时,活化的白细胞可抑制间质胶原蛋白的更新,增加斑块的脆性,进一步增大斑块破裂的可能性[4]。
AS斑块一旦破裂,循环中血小板活化、激活凝血级联反应、多细胞启动,参与血栓形成,阻塞血管,引发恶性缺血事件。研究[6-7]表明,血小板不仅介导AS血栓形成,也参与炎症免疫反应。当血流剪切应力发生改变,循环血液中的血小板通过表面受体响应血流变化,结合黏附蛋白和细胞外基质,使血小板黏附与活化,通过表达整联蛋白、P-选择素(P-selectin)和Toll样受体进行免疫。血小板P-selectin 和白细胞表达的配体1(PSGL-1)相互作用,介导血小板-白细胞聚集体的形成,促进AS的发生。同时,激活的血小板启动颗粒释放,致密颗粒分泌神经递质(5-HT)、磷酸腺苷(ATP/ADP)等介质;α颗粒释放黏附蛋白、趋化因子、细胞因子等。这些分泌物通过正/反向调控内皮细胞、平滑肌细胞和白细胞,参与AS发展。
总结来说,AS包含复杂的基质介导,多种细胞因子贯穿其发生、发展的全过程。
2 与AS有关的炎症反应信号通路
炎症反应贯穿AS的全过程,而介导炎症反应的信号通路繁多且复杂,主要有以下6条信号通路。
2.1 酪氨酸激酶/信号传导子和转录激活子(JAK/STAT)信号通路
JAK/STAT是一种由细胞因子介导的信号传递通路,可被多种细胞因子激活,同时也调控多种细胞因子的表达,是细胞进行信号传递的主要途径。JAK/STAT主要由酪氨酸激酶JAK及STAT蛋白构成,JAK/STAT家族有4个Janus激酶(JAK1-3、TYK2)和7个STATs(STAT1、2、3、4、5a、5b、6)。通路激活过程如下:首先,细胞因子与细胞膜上的相应受体相结合,驱使受体分子二聚化并招募受体偶联的JAK激酶,通过交互的酪氨酸发生磷酸化并被激活,JAK激酶被活化后可催化受体上的酪氨酸残基发生磷酸化,受体招募STAT,JAK激酶磷酸化STAT使其激活,活化的STAT脱离受体在胞浆中形成二聚体,进入细胞核内和靶基因结合,调节基因转录和蛋白表达。活化的JAK/STAT蛋白可增加多种炎性因子表达,如VCAM-1和MCP-1等,可加快细胞的增殖和迁移,趋化炎性细胞向动脉内皮细胞的黏附与浸润等[8]。JAK/STAT信号通路见图1。

JAK/STAT信号通路从血管内皮细胞(VECs)功能紊乱、血管平滑肌(VSMC)增殖和迁移、炎症细胞浸润等多方面介导AS形成。内皮细胞的激活、增殖和迁移是生成新血管的基础,新生血管的不成熟可造成AS斑块不稳定、甚至破裂。内皮细胞的增殖和迁移是在血管内皮因子(VEGF)的诱导下完成,而JAK/STAT信号通路是VEGF在细胞内进行信号传导的主要途径。陈健芳等[9]发现,通过抑制JAK/STAT信号通路,可减轻高糖诱导的人脐静脉血管内皮损伤。血管中膜的SMC在正常情况下为静止状态,当AS发生时,组织合成表达多种炎性介质,刺激VSMC由静止转变为增殖迁移状态。研究[10]显示,可通过抑制JAK/STAT信号通路抑制VSMC增殖和迁移。炎性浸润是AS病变的重要因素,研究表明,炎症细胞的增殖、分化等过程的调节与JAK/STAT信号通路密切相关。黄志敏等[11]发现通过阻断JAK/STAT信号通路可降低阿霉素肾纤维化大鼠炎症因子水平。
2.2 丝裂原活化蛋白激酶(MAPK)依赖性信号通路
MAPK主要由蛋白激酶及蛋白激酶磷酸化作用构成,是介导细胞内外信息交流的重要通路,在哺乳动物细胞中存在14条通路,细胞外信号调节激酶(ERK)、c-Jun氨基末端激酶(JNK)、p38 MAPK是其中3条经典的信号通路[12]。MAPK传导通路激活过程如下:MAPK激酶激酶(MAPKKK)受有丝分裂原刺激磷酸化而激活,在此基础上MAPKKK转而磷酸化激活MAPK激酶(MAPKK),最后由MAPKK磷酸化MAPK,使其活化,激活的MAPK分子活化核转录因子-κB (NF-κB),从而调节炎性细胞因子的表达,使细胞的通透性增加,加速细胞凋亡[13]。
研究[14]表明,AS与MAPK信号通路的激活密切相关。炎性细胞因子和各种细胞应激信号主要由JNK、p38MAPK通路转导,而细胞的生长、分裂等信号主要由ERK通路转导,各通路间存在相互协同或抑制作用。靳昭辉等[15]发现,可通过干预p38MAPK信号转导通路,改善糖尿病AS兔的炎症反应。通过p38 MAPK、ERK1/2抑制剂分别抑制p38 MAPK、ERK信号通路,可对抗球囊损伤后大鼠颈动脉内膜的新生[2]。
2.3 活性氧(ROS)依赖性信号通路
ROS主要由还原型辅酶Ⅱ(NADPH)氧化酶产生,是细胞内传递信号的使者。血管NADPH氧化酶在生理状态下活性较低,脂多糖(LPS)等因素的刺激可使其表达增加,导致血管内皮功能障碍,诱发炎症反应,从而使血管平衡状态遭到破坏[16]。致炎物质激活ROS受体,使细胞内生成大量的ROS,活化NF-κB蛋白,从而调节炎性因子的表达。
研究[17-18]发现,ET-1通过ETA-ROS信号通路,诱导血管平滑肌细胞(VSMC)C反应蛋白(CRP)的表达,同型半胱氨酸可以通过NMDAR/ROS/NF-κB信号通路诱导VSMC CRP表达。
2.4 TLR依赖性信号通路
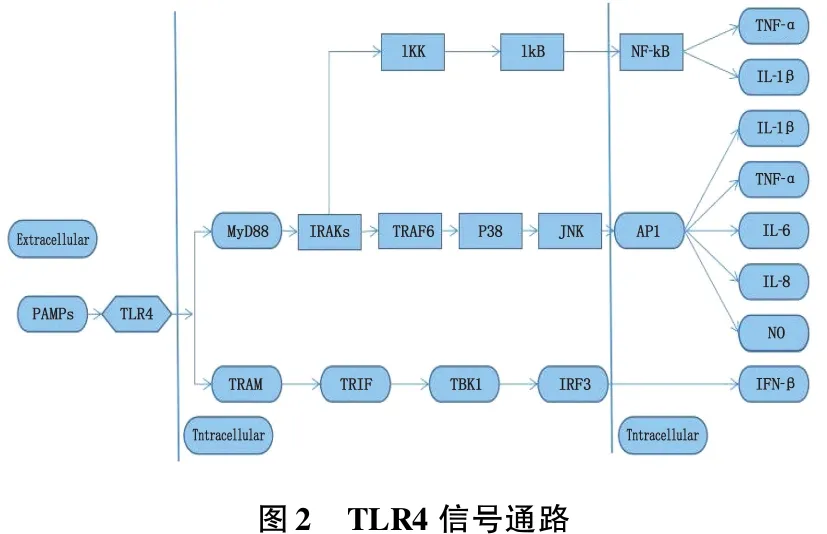
TLR是一种新的炎性信号转导蛋白,是沟通脂质代谢紊乱、免疫反应和炎症反应之间的桥梁,TLR4信号通路激活可引起慢性炎症反应,促进AS形成。TLR4在内皮细胞、平滑肌细胞等细胞表面均有表达,其能够识别LPS、OX-LDL等多种危险的信号分子。TLR4可以激活MyD88依赖型和MyD88 TLR4非依赖型2条通路,由MyD88和TRIF 2种衔接蛋白分别与相应受体结合,激活下游信号分子,产生促炎细胞因子和干扰素,激活T、B淋巴细胞介导的免疫应答[19]。
ATP结合盒转运体G(ABCG1)是介导脂质积聚和炎症反应的关键基因,TLR4可下调其表达,诱导脂质积聚和炎症细胞浸润血管平滑肌[20],从而介导AS的形成。研究[21]发现,抑制ApoE-/-小鼠TLR4、MyD88基因的表达,可抑制主动脉粥样硬化内皮细胞对白细胞的黏附以及巨噬细胞的浸润,使循环促炎细胞因子(IL-12、MCP-1)、斑块脂质含量显著减少。研究[22]发现,OX-LDL通过TLR4/NF-κB依赖途径,上调基质金属蛋白酶-9(MMP-9),促使巨噬细胞表达TNF-α、IL-8、IL-1β等炎性因子,加速斑块的破裂。TLR4信号通路见图2。
2.5 NF-κB信号通路
NF-κB信号通路广泛分布于哺乳动物细胞内,具有多向性转录调节作用,可由多种细胞因子和炎性因子诱导激活,该通路通过潜伏、诱导、应答、消退4个阶段介导炎症反应,在AS发病机制中占据核心地位[23]。
NF-κB信号通路可调节内皮细胞的活化和促炎因子的表达,AS斑块的形成与该通路调控相关细胞因子的表达密切相关。既往研究[24]发现,TNF-α和IL-6基因的启动子和增强子中均存在κB序列,活化的NF-κB与其特异性位点相结合,激活TNF-α、IL-6基因,使其表达和释放增多。TNF-α生物学活性广泛,可调节脂质代谢,介导炎症免疫反应,刺激自身及IL-1、IL-6、ICAM-1等炎性因子的生成与释放,发挥促炎作用,而TNF-α、IL-1又对NF-κB有反馈调节作用,细胞因子在前炎性因子TNF-α、IL-1等细胞因子正负反馈作用下不断上调,使炎症反应持续存在,介导AS的发生与发展[25]。NF-κB信号通路见图3。

2.6 CD40/CD40L信号通路
CD40是肿瘤坏死因子受体的家庭成员,CD40L是其配体,CD40/CD40L作为一对互补的跨膜糖蛋白,在免疫细胞、VECs、VSMC等多种细胞中均有表达,参与免疫、炎症等生物学过程[26]。VSMC、VECs和巨噬细胞在CD40/CD40L信号通路介导下,可表达TNF-α、ILs、黏附分子等炎性介质。当发生AS时,CD40与CD40L结合并激活进入细胞,通过激活NF-κB等下游信号通路,上调促炎因子和促血栓形成基因的转录与表达,参与AS的进程[27]。
研究[28]发现,诱导VECs表达MMPs的主要信号通路是CD40/CD40L。CD40/CD40L信号通路激活,使血管ROS、脂肪因子含量增多、加速白细胞向内皮损伤处的募集,促进AS斑块的生成[29]。
3 总结与展望
随着现代分子生物学的发展,关于AS发病机制的研究已逐步深入到细胞、分子等微观领域。AS的形成是包含多种机制的复杂过程,学术界普遍认为AS病变是由VECs受损、内皮功能障碍而导致的慢性炎症反应过程。与VECs炎性反应相关的信号通路纷繁复杂,远不上述几条,这些通路之间相互关联、相互影响,共同参与AS的形成与发展。理论上,阻断相关炎性信号通路可阻断AS的进程,事实上,这一猜想也已在许多临床研究和动物实验中被证实;Canakinumab抗炎药血栓形成结果研究(CANTOS)[30]将AS中的炎症作为靶点从推测转变为临床现实,该研究以经过大量研究并证实在AS形成中发挥重要作用的特异性促炎细胞因子IL-1β为靶点,成功突破了炎症小体作为进一步治疗干预的途径;Nod样受体家族含pyrin结构域蛋白3 (NLRP3)炎症体以及下游细胞因子IL-1β、IL-18、IL-6是有潜力的干预候选目标。研究[31-32]表明,服用抗IL-1β抗体可减少心肌梗死后心血管稳定患者心肌梗死的复发,以及根据指南(包括他汀类药物)治疗患者的主要心血管不良事件的发生。随着CANTOS的成功,已经有抑制炎症体激活等干扰IL-1β及其产生过程的策略,某些趋化因子的选择性中和作用在这方面也值得考虑。此外,目前有几种有潜力的途径尚未进入临床试验阶段,但正处于积极探索阶段。
AS是由多种因素共同介导的复杂性病变,实践中若仅针对某单一靶点进行抗炎治疗,难以达到理想的效果。因此,探索炎症反应与AS的关系以及各信号通路之间的联系,有助于阐明AS的发病机制、寻找新型药物的作用靶点,以及设计出更合理的防治AS的方案。
