伊文思兰改造多肽用于诊疗一体化的临床转化研究进展
2022-06-06刘清杏陈小元朱朝晖
刘清杏,陈小元,朱朝晖
1中国医学科学院北京协和医院核医学科 核医学分子靶向诊疗北京市重点实验室 核医学精准诊疗技术创新北京市国际科技合作基地 2疑难重症及罕见病国家重点实验室,北京 100730 3新加坡国立大学杨潞龄医学院/工程学院,新加坡 119077
近年来,肽受体放射性核素治疗(peptide rece-ptor radionuclide therapy,PRRT)的临床地位不断提高,从肿瘤的末线治疗逐渐提升至一二线,并已成为重要的肿瘤治疗手段之一。但目前常用的放射性核素标记的多肽由于分子量较小,在血液中的清除速度快,使得肿瘤对放射性药物的吸收不充分,不能最大程度地发挥放射性药物的疗效。放射性核素标记的多肽价格昂贵,若能提高其利用率,将对降低医疗成本、减轻疾病负担具有重要意义。
白蛋白是血浆中含量最丰富的循环蛋白,约占血清蛋白的55%~60%[1],其是由585个氨基酸和17个二硫键组成的三级多肽,大小约为66.5 kDa。白蛋白在体内的生物半衰期约为19 d,是多种物质(脂质、激素、金属离子和亲脂性药物)的载体[1]。作为药物载体,白蛋白长循环半衰期的特性可增加肿瘤内药物的聚集,提高PRRT疗效。目前,一般通过添加与白蛋白可逆性结合的分子以延长PRRT药物在体内的半衰期,提高肿瘤内放射性药物的摄取。较为经典的白蛋白可逆性结合分子包括伊文思兰(Evans blue)衍生物和4-(对碘苯基)丁酸。生长抑素受体(somatostatin receptor, SSTR)和前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)是较有代表性的多肽受体。本文就伊文思兰改造的SSTR和PSMA两类多肽用于诊疗一体化的临床转化研究进行概述。
1 伊文思兰
伊文思兰是一种偶氮染料,分子式见图1,与血浆白蛋白具有较高的亲和力(Kd=2.5 μmol/L)[2- 3]。动力学和平衡实验研究表明,白蛋白上约有14个可供伊文思兰结合的位点[4]。伊文思兰与白蛋白结合后,其复合物在血液滞留的时间将大幅延长。
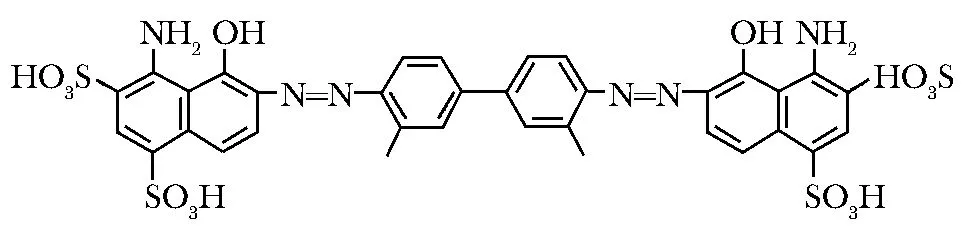
图 1 伊文思兰分子式
血浆白蛋白在炎症、创伤等疾病状态下会发生蛋白渗漏,根据这一病理生理学改变,陈小元教授团队研发了一种新的分子结构NOTA-伊文思兰(NOTA-Evans blue,NEB),用于标记内源性白蛋白。NEB可与正电子发射放射性核素68Ga/18F/64Cu进行标记(68Ga-NEB/18F-AlF-NEB/64Cu-NEB),从而进行正电子发射断层显像(positron emission tomography,PET)[5- 6]。目前该应用主要集中于淋巴疾病、血管通透性相关疾病以及乳腺癌前哨淋巴结转移等[6- 13]。
2 伊文思兰改造的多肽研究
2.1 伊文思兰改造的SSTR
SSTR是细胞膜上调节生长激素分泌的一种G蛋白偶联受体,包含5个亚型。80%~90%的神经内分泌肿瘤(neuroendocrine neoplasm, NEN)细胞表面可高度表达SSTR2、SSTR3和SSTR5等亚型[14]。SSTR为NEN的分子影像诊断及核素治疗提供了重要靶点。天然的生长抑素肽激素与SSTR具有高亲和力,但其生物半衰期短(约为2 min),因此并不适合用于显像或治疗。人工合成的生长抑素类似物既保持了对SSTR的高亲和力,同时在天然的生长抑素结构中加入了D型氨基酸延长其生物半衰期,使得放射性核素标记的生长抑素类似物用于NEN的诊断或治疗成为可能。
SSTR介导的PET显像在NEN的诊断、分期、再分期、复发监测、指导治疗以及预后判断等方面具有重要价值[15]。177Lu-DOTATATE是最常用于治疗SSTR阳性NEN的放射性药物,已先后于2017年和2018年在欧洲和美国被批准用于治疗SSTR阳性的胃肠胰NEN。2017年公布的NETTER- 1 Ⅲ期试验数据显示,177Lu-DOTATATE治疗晚期、进展性SSTR阳性的中肠NEN患者的无进展生存率(65.2%比10.8%)和疾病应答率[完全缓解率(complete remission rate,CRR)+部分缓解率(partial remission rate,PRR): 18%比3%]均显著优于长效奥曲肽[16]。虽然177Lu-DOTATATE已取得令人鼓舞的临床效果,但疗效仍有改进提升的空间。
陈小元教授团队将伊文思兰加入DOTATATE中,合成了DOTA-EB-TATE[17]。放射性核素标记DOTA-EB-TATE后可与血浆白蛋白可逆性结合,减缓药物被肾脏清除的速度,延长在体内的滞留时间。一项临床前研究表明[18],SSTR阳性的A427- 7人非小细胞肺癌异种移植荷瘤鼠对177Lu-DOTA-EB-TATE的肿瘤摄取显著高于177Lu-DOTATATE,治疗效果也更优。肿瘤在给药后24 h对177Lu-DOTA-EB-TATE的摄取达到最高值[(78.8±4.1)% ID/g],随后轻微下降,直至 48 h摄取值仍高达(64.5±7.39)% ID/g;但肿瘤对177Lu-DOTATATE的摄取则在4 h即达峰值,且峰值仅为(9.25±0.81)% ID/g,给药后24 h已降至(3.02±0.20)% ID/g;177Lu-DOTA-EB-TATE(18.5 MBq,单次给药)组5只小鼠中有4只获得了肿瘤完全缓解,而在同等剂量的177Lu-DOTATATE组,肿瘤仍继续生长,体积逐渐增大。在一项用90Y标记的临床前实验中[17],90Y-DOTA-EB-TATE(3.7 MBq 或7.4 MBq,单次给药)可显著抑制肿瘤生长,与90Y-DOTATATE相比,荷瘤鼠的存活率提高1倍以上。
临床前研究的结果增强了177Lu-DOTA-EB-TATE向临床转化的信心。Zhang等[19]随后在北京协和医院开展了177Lu-DOTA-EB-TATE治疗晚期NEN患者的安全性和剂量学研究。5例患者接受单次剂量为0.35~0.70 GBq(9.5~18.9 mCi)的177Lu-DOTA-EB-TATE,3例患者接受单次剂量为0.28~ 0.41 GBq(7.5~11.1 mCi)的177Lu-DOTATATE作为对照组,结果显示,177Lu-DOTA-EB-TATE在血液中的滞留时间(T1/2α约为9.47 h,T1/2β约为236 h)显著高于177Lu-DOTATATE。肿瘤内摄取177Lu-DOTATATE在给药后3 h达到峰值,平均标准摄取值(standardized uptake value,SUV)约为8.37±5.63,随后随时间的推移快速降低。而肿瘤内摄取177Lu-DOTA-EB-TATE在给药后持续增高,直至给药后120 h才到达顶峰(平均SUV约为22.46±12.95),直至168 h仍保持较高水平(平均SUV为21.94±11.63)。因此,177Lu-DOTA-EB-TATE的肿瘤内照射辐射吸收剂量明显高于177Lu-DOTATATE,约为其7.9倍。177Lu-DOTA-EB-TATE在血液中的滞留时间延长,同时也不可避免地导致正常组织的内照射辐射吸收剂量提高。177Lu-DOTA-EB-TATE的骨髓内照射辐射吸收剂量和肾脏内照射辐射吸收剂量分别为177Lu-DOTATATE的18.2倍和3.2倍。
在剂量学研究的基础上,Wang等[20]在北京协和医院初步开展了177Lu-DOTA-EB-TATE与177Lu-DOTA TATE治疗NEN的安全性及疗效的对比研究。4例NEN患者接受了单次、低剂量177Lu-DOTA-EB-TATE治疗(治疗组),平均剂量约为(0.66±0.06)GBq[(17.8±1.7)mCi];3例NEN患者则接受了单次、更高剂量177Lu-DOTATATE治疗(对照组),平均剂量约为(3.98±0.17) GBq[(107.6±4.6)mCi]。治疗期间及治疗后3个月均未观察到明显的血液毒性及肝肾毒性。治疗后3个月参考EORTC(European Organization for Research on Treatment of Cancer)标准进行疗效评估,研究组3例患者病情达到部分缓解,1例病情稳定,对照组2例达到部分缓解,1例病情稳定。因此,单次低剂量(约为177Lu-DOTATATE的1/6给药剂量)177Lu-DOTA-EB-TATE与177Lu-DOTA TATE相比,疗效并无显著差异。
基于此鼓舞人心的结果,笔者团队进一步对177Lu-DOTA-EB-TATE进行了多剂量递增的临床试验研究[21- 22]。其中一项研究共纳入了32例晚期、病情进展的NEN患者[22],并随机分为剂量递增的3个组,接受3个疗程的177Lu-DOTA-EB-TATE治疗:A组(n=12),(1.17±0.09)GBq[(31.6±2.4)mCi]/疗程;B组(n=6),(1.89±0.53)GBq[(51.1 ±14.3)mCi]/疗程;C组(n=14), (3.97±0.84) GBq[(107.3±22.7)mCi]/疗程。研究结果表明,177Lu-DOTA-EB-TATE治疗具有较好的安全性,治疗期间及治疗结束后3个月内均未出现危及生命的、不可逆的4级不良反应或3级以上肾毒性。A组未出现3级血液毒性;B组仅1例(16.6%)出现3级血液毒性,C组也仅3例(21.4%)出现3级血液毒性。骨髓是PRRT治疗的剂量限制器官之一,剂量阈值约为2 Gy。根据这一剂量阈值和前期的剂量学数据[骨髓的辐射吸收剂量为(0.0582±0.0137)mSv/MBq],177Lu-DOTA-EB-TATE可接受的最高剂量约为34.3 GBq(927 mCi)。Bergsma等[23]发现,接受标准治疗剂量(7.4 GBq/疗程)的患者,4个周期后骨髓已达到剂量阈值。但目前仍有接受4个疗程标准剂量治疗的患者在病情进展后继续接受一个或多个疗程的标准剂量治疗,且未见明显增加的血液毒性。因此,我们认为骨髓对177Lu治疗的剂量阈值可能更高,超过2 Gy。177Lu-DOTATATE治疗后出现3~4级血液毒性的概率一般为3.1%~12.5%[16,23- 30]。但Brieau等[31]发现,既往接受过多疗程烷基化治疗和磺胺替尼/依维莫司治疗的患者,PRRT治疗后发生3~4级血液毒性的概率明显增高,约为30%。鉴于国内开展PRRT的机构少,此研究纳入的患者多为接受过化疗、酪氨酸激酶抑制剂、哺乳动物雷帕霉素靶蛋白抑制剂后病情仍进展的晚期NEN患者。在疗效评估方面,参考EORTC标准,3组的疾病应答率较为相似,依次为50.0%、50.0%和42.9%。但疾病控制率由高至低依次为B组(83.3%)、C组(71.5%)、A组(66.7%)。因此,177Lu-DOTA-EB-TATE的给药剂量即使高达3.97 GBq/疗程时仍具有较高的安全性,1.89 GBq/疗程的177Lu-DOTA-EB-TATE似乎具有最佳的肿瘤反应和最低的不良反应。未来希望通过更严格的患者选择和安全监测,可使更高剂量的177Lu-DOTA-EB-TATE获得更好的治疗反应和安全性。
2.2 伊文思兰改造的PSMA
PSMA是一种Ⅱ型跨膜糖蛋白,以单体或二聚体形式特异性表达于前列腺癌腺上皮和其他非前列腺恶性实体肿瘤的新生毛细血管内皮细胞[32]。正常的前列腺上皮细胞仅微量表达PSMA,但几乎所有的前列腺癌细胞可见PSMA特异性高表达。目前,随着社会老龄化的进一步加重,前列腺癌的发病率日益增高。而随着病情的进展,激素依赖性前列腺癌大多会转变为激素非依赖性或去势抵抗性前列腺癌(castrate-resistant prostate cancer,CRPC)。CRPC患者的治疗手段有限、预后差、死亡率高。PSMA的表达程度与前列腺癌的Gleason分级及侵袭性呈正相关,且前列腺癌患者进展为CRPC的过程中仍高度表达PSMA[33- 35]。前列腺癌的上述分子特点,使得PSMA成为前列腺癌精准诊疗的理想靶点。
近年来,靶向PSMA的核素标记分子主要包括单克隆抗体、适配体和小分子抑制剂3类。单克隆抗体的潜在免疫原性、大分子抗体使肿瘤组织渗透性差从而导致肿瘤靶本比低等原因限制了核素标记的单克隆抗体的临床应用。适配体作为寡核苷酸或寡肽类物质,对温度、pH 较为敏感,使得核素标记较为困难。小分子抑制剂是含有锌离子结合位点的谷氨酸化合物,可与具有谷氨酸酶活性的PSMA胞外段的锌离子催化位点特异性结合,克服了单克隆抗体及适配体的局限性,其具有稳定的化学性质和较强的组织渗透性,能快速获得较高的肿瘤靶本比。目前常用的PSMA小分子抑制剂,如PSMA- 11、PSMA- 617、PSMA-I&T,是脲基类分子抑制剂。
PSMA- 617和PSMA-I&T以DOTA作为螯合剂,既可鳌合68Ga进行PET显像,又可螯合177Lu、90Y 等治疗核素用于核素靶向治疗[36- 37]。177Lu-PSMA- 617是目前前列腺癌最常用的核素治疗药物,美国食品药品监督管理局基于其Ⅲ期VISION研究的阳性结果,已授予177Lu-PSMA- 617突破性药物资格,用于治疗转移性CRPC。VISION研究表明,与最佳标准治疗(standards of care,SOC)相比,177Lu-PSMA- 617联合SOC显著延长了中位总生存期(15.3个月比11.3个月)和放射学中位无进展生存期(8.7个月比3.4个月)[38]。尽管转移性CRPC患者对177Lu-PSMA- 617的治疗反应好,但仍有部分前列腺癌患者治疗效果不佳。
陈小元教授团队在PSMA小分子抑制剂DOTA-MCG中加入了伊文思兰结构,以偶联产生DOTA-EB-MCG[39]。临床前研究利用PSMA+PC3-PIP荷瘤鼠模型对DOTA-EB-MCG开展了生物分布及疗效研究。该模型在注射86Y-DOTA-EB-MCG后24 h的肿瘤摄取到达顶峰[(40.4±4.79)% ID/g],注射后48 h肿瘤摄取值仍高达(35.7±4.27) % ID/g;而不含EB结构的86Y-DOTA-MCG在注射后1 h即已达峰值,峰值仅为(17.1±3.66) % ID/g。90Y-DOTA-EB-MCG和90Y-DOTA-MCG的疗效对比研究提示,无论是同等剂量还是较低剂量的90Y-DOTA-EB-MCG(3.7 MBq/7.4 MBq,单次给药)均比90Y-DOTA-MCG(7.4 MBq,单次给药)更有效地抑制肿瘤生长,且荷瘤鼠存活率更高。与90Y-DOTA-MCG相比,90Y-DOTA-EB-MCG对肿瘤和肾脏的内照射辐射吸收剂量分别高4.4倍和11倍。
陈小元教授团队随后将EB加入至DOTA-PSMA- 617结构中,形成DOTA-EB-PSMA- 617结构,并可用86Y/90Y/177Lu等核素进行标记[40]。PSMA + PC3-PIP荷瘤鼠模型的PET图像提示,86Y-EB-PSMA- 617从血液中的清除速度比86Y-PSMA- 617慢。86Y-EB-PSMA- 617在注射后48 h的肿瘤摄取值[(77.3±6.2)% ID/g]是86Y-PSMA- 617的4倍。在放射性核素治疗方面,90Y/177Lu-EB-PSMA- 617的疗效也显著优于90Y/177Lu-PSMA- 617。单次注射3.7 MBq的177Lu-EB-PSMA- 617或1.85 Mbq的90Y-EB-PSMA- 617即可消除PSMA+PC3-PIP荷瘤鼠的肿瘤,且效果持久。
在临床前研究的基础上,Zang等[41]在北京协和医院9例转移性CRPC患者中开展了177Lu-EB-PSMA- 617与177Lu-PSMA- 617的剂量学对比研究。4例接受了单剂量0.80~1.1 GBq(21.5~30 mCi)177Lu-EB-PSMA- 617治疗,5例接受了单剂量1.30~1.42 GBq(35~38.4 mCi)177Lu-PSMA- 617治疗,结果表明,177Lu-EB-PSMA- 617在转移性CRPC病灶的靶向聚集和滞留时间均增加,其在肿瘤组织中的有效吸收剂量是177Lu-PSMA- 617的3.02倍,同时在肾脏及骨髓的有效吸收剂量也比177Lu-PSMA- 617高6倍[肾脏:(2.39±0.69)mSv/MBq比(0.39±0.06)mSv/MBq,P<0.01;骨髓:(0.0547±0.0062)mSv/MBq比(0.0084±0.0057) mSv/MBq,P<0.01],但仍在可耐受范围内。接受177Lu-EB-PSMA- 617治疗的4例患者给药后均被评定为部分缓解(参考PERCIST 1.0),而接受177Lu-PSMA- 617治疗的5例患者疗效不佳(4例病情稳定,1例疾病进展)。
Zang等[42]随后又开展了递增剂量的177Lu-EB-PSMA- 617在转移性CRPC患者中的有效性及安全性研究,以寻找最合适的治疗剂量。28例转移性CRPC患者随机分为3组,接受3个疗程的177Lu-EB-PSMA- 617:A组(n=10),(1.18±0.09) GBq[(31.79±2.44) mCi]/疗程;B组(n=10),(2.12±0.19) GBq[(57.39±5.29)mCi]/疗程;C组(n=8),(3.52±0.58)GBq[(95.12±15.56) mCi]/疗程。由于疾病进展或骨髓抑制,3组中分别仅有4、5、5例完成了3个疗程的177Lu-EB-PSMA- 617治疗。结果发现,治疗前后肝肾功能并无明显改变,但血液系统毒性较明显,其中血小板值下降最明显,随着剂量的增加,B组和C组血小板降低程度显著高于A组,C组出现3级及以上血小板减少的比例明显高于其他两组(A~C组依次为0、10.0%和37.5%),但随访期间患者的血小板可逐渐恢复正常。血液毒性是前列腺癌PRRT治疗最常见的不良反应,特别是对全身弥漫骨转移或治疗前骨髓储备功能较差的患者。一项Ⅱ期临床试验研究显示,23%的患者出现3级贫血,27%的患者出现3~4级血小板减少[43]。疗效方面,B组和C组的最终疾病控制率明显高于A组(A~C组依次为10%、70%和75%,P=0.007)。综合考虑治疗的毒副作用及疗效,60 mCi的177Lu-EB-PSMA- 617较30 mCi和100 mCi具有更好的治疗效果,但仍应密切监测不良反应,对于全身弥漫性骨转移的患者,其PRRT治疗更应慎重。
3 小结与展望
近年来,伊文思兰改造的多肽用于核素治疗的研究取得了显著进展。伊文思兰与白蛋白的可逆性结合,使得PRRT药物在血液中的滞留时间延长,增加了肿瘤对放射性药物的摄取,较小剂量即可达到同等治疗效果,临床应用后有利于降低医疗成本,满足更多患者的治疗需求。
伊文思兰改造的SSTR/PSMA已从临床前研究转化至临床研究阶段,且在NEN及前列腺癌中取得了肯定的治疗效果。关于伊文思兰改造的其他多肽用于核素治疗的研究也在逐步开展,如伊文思兰改造的叶酸受体、整合素受体、成纤维细胞活化蛋白抑制剂、胰高血糖素肽- 1受体激动剂等。伊文思兰改造的多肽除用177Lu标记外,还可用其他治疗核素标记,如225Ac。225Ac发射α粒子,对肿瘤细胞的杀伤能力强于177Lu发射的β射线,即使对177Lu治疗无效/抵抗的患者也有望获得较好的治疗效果。随着225Ac的生产量增加,以及具有225Ac使用资质的医疗机构增加,225Ac标记的放射性核素治疗药物的研究及应用将给更多肿瘤患者带来获益和新的治疗希望。
作者贡献:刘清杏负责文献查阅及初稿撰写;陈小元、朱朝晖负责选题设计,指导论文修订。
利益冲突:所有作者均声明不存在利益冲突