百合病毒的高通量测序鉴定和RT-PCR检测
2022-06-06袁志豪李振锋陆月霞蔡丽
袁志豪,李振锋,陆月霞,蔡丽
华中农业大学植物科学技术学院,武汉 430070
百合(Liliumspp.)为百合科(Liliaceae)百合属(Lilium)的多年生草本植物,具有观赏价值、药用价值和食用价值[1]。近年来我国百合种植业飞速发展,国内观赏百合种植面积迅速增加,主要分布于云南、四川、西藏、贵州、吉林、湖北、陕西、辽宁、河北、黑龙江、内蒙古、甘肃、江西、浙江等省(区)[2]。然而,栽培过程中,百合常受到各种病害的侵染,常见病害有叶枯病、病毒病、鳞茎基腐病等[3],其中,百合病毒病已经严重影响了百合的产量和品质。百合受病毒侵染常见的症状类型有轻花叶型、重花叶型、矮化型、丛簇矮化型、黄化矮化型、扁茎簇叶型、花变叶型等[4]。另一方面,随着从国外引进种球的数量和批次数目的增长,一些危害性大的检疫性病毒传入我国的风险也逐渐增大[5]。
目前国内外报道侵染百合的病毒有20 多种(包括1种植原体),其中危害较严重、发生最普遍的有百合斑驳病毒(lily mottle virus,LMoV)、百合无症病毒(lily symptomless virus,LSV)和黄瓜花叶病毒(cucumber mosaic virus,CMV),常表现为复合侵染[6-7]。我国已报道的侵染百合的病毒有11种:包括车前草花叶病毒(plantago asiatica mosaic virus,PlAMV)[8]、剪秋萝斑驳病毒(lychnis mottle virus,LycMoV)、百合黄脉病毒(lily yellow vein virus,LYVV)、百合内生病毒(lily endomavirus,LEV)[9]、百合卷叶病毒(lily polerovirus virus,LPV)[9]、百合黄化花叶病毒(lily yellow mosaic virus,LYMV)[10]、李属坏死环斑病毒(prunus necrotic ringspot virus,PNRSV)[11]、CMV[12]、LMoV[13]、LSV[14]、南荠菜花叶病毒(arabis mosaic virus,ArMV)[15],在这些病毒中,CMV、LSV、LMoV和PlAMV 是侵染百合植株的主要病毒[16]。
百合属于无性繁殖,病毒可通过种球传给后代,在田间也可以通过蚜虫或汁液接触传播扩散。病毒主要侵染百合的鳞茎、叶片、花等部位,病情严重时会对百合生产造成巨大的经济损失[17]。所以,加强百合病毒的检测和监控是十分必要的,对病毒的防控、无毒苗生产和海关检疫等方面是必需的。
本研究从我国云南、浙江、江西、广东、湖南和上海6个地区采集疑似感染病毒的百合叶片,从中提取总RNA,通过高通量测序、生物信息学分析和RTPCR 等技术,检测侵染百合的病毒,分析不同病毒的发生率、地区分布和复合侵染情况等,旨在为百合无病毒种球和种苗的生产以及病毒病的综合防控提供参考。
1 材料与方法
1.1 病样采集
2020年9月至2021年12月,从云南、浙江、江西、上海、广东、湖南6个地区,共采集表现疑似病毒症状的百合叶片样品48份(表1),置于超低温冰箱保存备用。
1.2 主要试剂
植物总RNA 提取试剂盒、第一链cDNA 合成试剂盒、2×AccurateTaqMaster Mix(dye plus)、GL DNA Marker 100 Ladder、DNA 胶回收试剂盒购自湖南艾科瑞生物工程有限公司,感受态大肠杆菌DH5α购自北京擎科生物科技有限公司,TA 快速克隆试剂盒购自北京庄盟国际生物基因科技有限公司。
1.3 总RNA的提取
百合发病叶片总RNA 的提取参照试剂盒使用说明书进行,提取的总RNA 经琼脂糖凝胶电泳检测并使用紫外分光光度计检测RNA浓度及纯度。
反转录参照第一链cDNA 合成试剂盒说明操作。病毒RT-PCR 特异性检测引物(表2)由上海生工生物工程有限公司合成。
1.4 高通量测序与数据分析
百合样品按云南省和浙江省2个地区,不同症状进行混合,送贝瑞基因公司进行高通量测序。
1)文库构建。植物总RNA 检测合格后,通过去核糖体 RNA 试剂盒(Ribo-off®rRNA depletion kit,Vazyme Biotech Co.,Ltd)去除rRNA。随后加入缓冲液将mRNA 打断成短片段,以mRNA 为模板,用六碱基随机引物合成一链cDNA,然后加入缓冲液、dNTPs 和 DNA polymerase I 和 RNase H 合 成 二 链cDNA,再用AMPure XP beads 纯化双链cDNA。纯化的双链cDNA 先进行末端修复、加A 尾并连接测序接头,再用AMPure XP beads 进行片段大小选择。最后进行PCR 扩增,并用AMPure XP beads 纯化PCR产物,得到最终的文库。
2)文库定量。文库构建完成后,先使用Qubit 2.0 进行初步定量,稀释文库至2 ng/μL,随后使用Agilent 2100 对文库的插入大小进行检测,插入大小符合预期后,使用Q-PCR 方法对文库的有效浓度进行准确定量(文库有效浓度>2 nmol/L),以保证文库质量。
3)上机测序。文库质量经检测合格后,用Illumina Novaseq平台进行测序。
4)数据质控与分析。将高通量测序返回的reads进行统计分析,去除低质量、含有接头的reads,然后针对每个样品经预处理得到的Clean reads,采用IDBA_UD[18]对 clean reads 进行拼接(K=19、29、39、49、59、69、79、89、99、109、119),得到contig,通过与Nr(NCBI non-redundant protein sequences)库进行Blast 比对(e值≤10-3)。由于每条序列可能会有多个比对结果,得到多个不同的分类级别,为了保证其生物学意义,采取LCA算法,将出现第一个分支前的分类级别,作为该序列的物种注释信息。对注释到的 Nr 数据库的 contig 与 NCBI Taxonomic 数据库进行注释,获取分类地位,最后提取注释到病毒的contig,将 contig 在 NCBI 中进行 Blastn 和 BlastX 搜索比对,将比对到病毒的序列及病毒种类整理汇总。
1.5 RT-PCR验证及数据统计
根据注释到的病毒contig,利用Primer Premier 5软件设计特异性引物检测样品中的病毒。提取百合样品的总DNA和总RNA。提取的RNA在反转录酶作用下利用随机引物合成第一条cDNA链。用DNA聚合酶和特异性引物进行PCR 反应。50 μL 反应体系包含 2×Accurate Taq Master Mix(dye plus)25 μL,ddH2O 20 μL,cDNA 2 μL,引物F 1.5 μL,引物R 1.5 μL;PCR 扩增程序为94 ℃预变性30 s,98 ℃变性10 s,退火 30 s,72 ℃延伸 60 s,35 个循环;72 ℃最后延伸2 min。PCR 产物通过琼脂糖凝胶电泳分离,割胶回收目标片段,经DNA 纯化试剂盒纯化后连入One step ZTOPO-Blunt/TA 载体,转入大肠杆菌DH5α,阳性克隆送上海生工生物工程有限公司测序鉴定。RT-PCR 检测后统计分析侵染百合病毒的种类、病毒侵染率、各地区病毒分布情况和病毒复合侵染情况等。
2 结果与分析
2.1 百合病毒病主要症状
2020年 9 月至 2021年 12 月,从 6 个地区共采集表现疑似病毒症状的百合叶片样品48份,感病植株主要表现为花叶、黄化、皱缩、畸形、矮化等症状(图1)。

图1 百合病毒病田间症状类型Fig.1 Symptom types of lily virus disease in the field
2.2 高通量测序及分析
将最早采于云南和浙江两省表现不同症状的百合叶片RNA 混合,进行转录组测序。对测序数据进行分析,共获得109 041 624 对clean reads。其中云南样品(BH-YN)得到55 080 214 对 clean reads,占reads 总数的 98.40%,拼接后得到 142 767 条 contigs,注释到病毒相关的有1 719 条contigs,302 912 个碱基;浙 江样品(BH-ZJ)得 到 53 961 410 对 clean reads,占reads总数的98.35%,拼接后得到165 202条contigs,注释到病毒相关的有1 278条contigs,224 321个碱基。
比对到病毒序列的contigs 包括:8 条注释为CMV,456 条 注 释 为 PlAMV,1 534 条 注 释 为LMoV,11 条注释为 DMV,39 条注释为RYVV,6 条注释为FMV,2 条注释为DCMV,1 条注释为Cs-VMV,2 条contig 未比对到已知病毒,可能是新病毒(表3)。
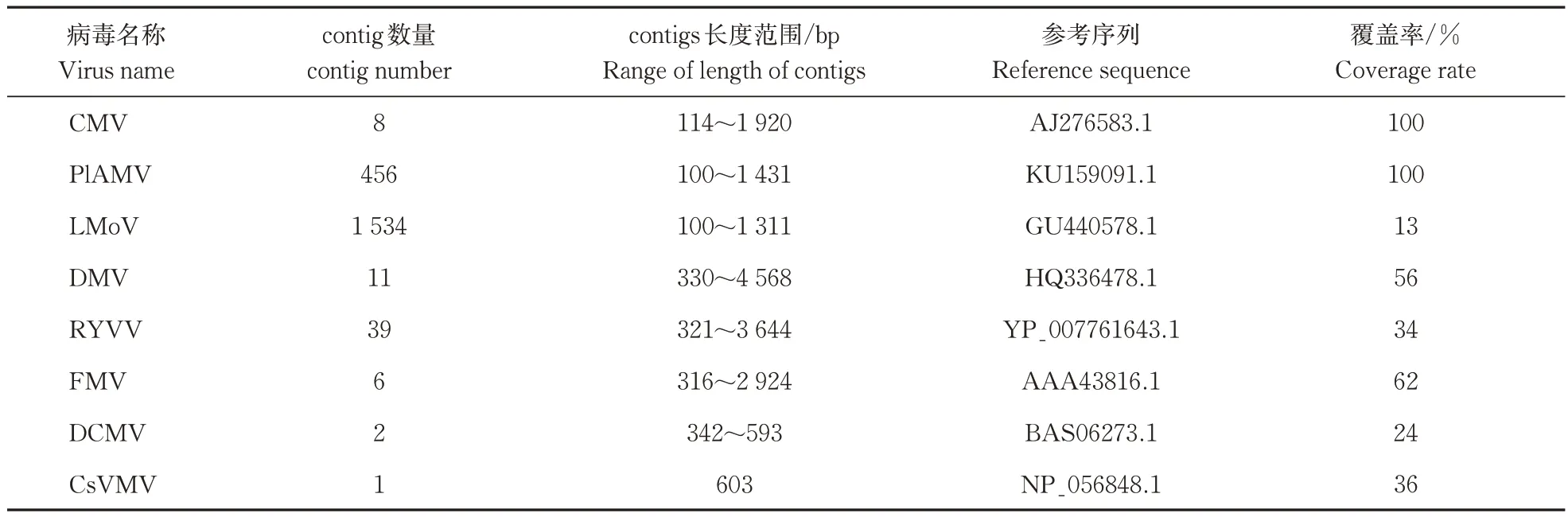
表3 百合测序结果中比对到的8种已知病毒Table 3 Parameters of contigs of eight known viruses from lily sequencing results
2.3 RT-PCR验证
根据测序分析获得的8种病毒的序列,以及设计合成的每种病毒的特异性引物,利用RT-PCR 对测序结果中的已知病毒进行验证。结果显示,在百合样品中扩增到了与 CMV、PlAMV、LMoV、DMV、FMV、RYVV 6种病毒预期相符的条带,而未扩增到DCMV 和CsVMV 相应的条带(图2)。对进一步验证中得到的百合样品中的6 种病毒扩增条带进行克隆和测序分析,结果显示测序正确,符合预期大小。

图2 百合6种病毒RT-PCR扩增结果Fig.2 Results of RT-PCR amplification of 6 viruses from lily
对采集的48份样品进行了上述6 种病毒的RTPCR 检测,结果显示:6 种病毒的检出率从14.58%~100%不等。其中,DMV和RYVV的检出率最高,均为100%,其次是PlAMV 和LMoV,检出率均为95.83%,然后是FMV,检出率为85.42%,检出率最低的是CMV,为14.58%。
2.4 百合病毒的分布及复合侵染情况
对6 个地区的病毒分布进行统计,结果显示:云南地区6 种病毒都有,上海市有3 种,其他地区存在4~5 种病毒,不同地区侵染百合的病毒种类差别不大。其中,CMV 只在云南地区检测出,LMoV、DMV和RYVV 在6个地区都存在,表明这3种病毒分布范围最广(表4),发生最普遍。

表4 我国6个地区检出的百合病毒Table 4 Lily viruses detected in 6 regions of China
对6 种病毒的复合侵染情况进行统计,结果显示:百合单个样品可检测出3~6 种病毒,其中仅有1个样品检测到3种病毒复合侵染,LMoV、DMV、RYVV 3 种病毒复合侵染率最低,为2.08%;LMoV、PlAMV、DMV、RYVV 和FMV 5 种病毒复合侵染率最高,为62.50%;6种病毒复合侵染的样品有7个,复合侵染率为14.58%,表明田间自然发病存在普遍的复合侵染现象。从病样采集地来看,云南地区的百合病毒复合侵染现象最复杂,存在6 种复合侵染类型,详情见表5。

表5 48份百合样品中6种病毒复合侵染情况Table 5 Mixed infection of 6 viruses in 48 lily samples
3 讨 论
本研究通过对疑似百合病毒病样品进行转录组测序,分析得到LMoV、CMV、PlAMV、DMV、FMV、RYVV、DCMV、CsVMV 8种已知病毒和2种未知病毒的序列信息。利用RT-PCR 在百合样品中检测到除DCMV 和CsVMV 以外的6 种病毒。在已知病毒中,DMV 和RYVV 在所有样品中均有检出,检出率最低的是CMV,且仅在云南昆明市的样品中检出。LMoV、DMV和RYVV分布范围最广,在6个地区都有分布。
我们的检测结果与前人的报道既有相同之处,又有所不同。CMV、LMoV 和LSV 被认为是百合上的三大病毒,很多研究直接利用ELISA 法或者RTPCR 技术检测这3 种病毒。王连春等[19]对侵染云南食用百合的病毒进行检测,发现CMV、LSV 和LMoV 的检出率分别为60%、50%和30%,且CMV和LSV 的复合侵染率为20%,本研究在云南样品中检测出CMV 和LMoV,未检测出LSV。江西万载县的百合叶片中检测出PlAMV、LMoV、DMV 和RYVV 4 种病毒,未检测出CMV 和LSV;叶晓梦等[12]采用多重RT-PCR 技术对江西省莲花县的百合叶片所携带的上述3 种病毒检测,结果显示含有CMV 和LMoV;谢晚彬等[13]采用RT-PCR 技术在江西万载县的龙牙百合鳞茎中对CMV、LMoV 和LSV的检测结果表明,3 种病毒中仅有LMoV 呈阳性;本研究中浙江海宁市和杭州市百合叶片中检测出了PlAMV、LMoV、DMV、RYVV 和FMV 5 种病毒,未检测出CMV;而沈嘉乐等[20]采用间接 ELISA 法对浙江杭州市从荷兰引进的百合和杭州本地栽种的百合样品进行检测,结果表明,LMoV 和LSV 均有发现,且LSV 侵染样品均为与LMoV 复合侵染。刘文洪[11]在进口百合和我国浙江丽水栽培百合样品中检测到PNRSV 的发生,侵染率为20.8%,这是PNRSV侵染百合的首次报道,证明百合是PNRSV 的一个新寄主。综上所述,即便是相同地区百合病毒的检测结果也有差异,可能是由于采样的病毒样品类型、样品数量或者检测时取样部位等不同造成的,也可能是检测方法的灵敏度或者病毒株系变异引起的。
由本研究检测结果还可以看出,百合病毒在田间存在严重的复合侵染现象,单个样品中能同时检出3~6 种病毒,且以LMoV、PlAMV、DMV、RYVV和FMV 5 种病毒复合侵染率最高,48份样品中有30份为上述5 种病毒复合侵染,复合侵染率高达62.50%。被誉为“春城”的云南省昆明市,由于其独特的气候环境,四季如春,一年四季可不间断种植各种蔬菜和花卉,特别有利于病毒侵染及传播。因此,云南地区的百合病毒复合侵染现象最复杂,单个样品被5~6种病毒复合侵染,其中6种病毒复合侵染率为14.58%。多种病毒复合侵染百合,还有些病毒侵染后并不表现症状,很难单从症状上进行正确诊断。病毒复合侵染已成为百合脱毒生产中的重大障碍,而且脱毒苗的检测大多仅针对已知病毒,对未知的新病毒则无法检测。我们对百合样品进行分析时发现2种未知病毒,新病毒的全长序列和分类地位有待进一步确认。因此,在全国范围内广泛采样,研究侵染百合的病毒种类及特性,尤其是对新病毒的鉴定和检测,将对百合脱毒生产及病毒病防控有重大意义。
致谢:感谢江西省农业科学院蔬菜花卉研究所的黄冬华研究员、罗云博士和李艳婷博士在百合病毒样品采集中提供的帮助。
