萝卜花叶性状的遗传分析及基因定位
2022-06-06李雪微郭超程宋瑶高长斌张小康熊秋芳刘克德
李雪微,郭超程,宋瑶,高长斌,张小康,熊秋芳,刘克德
1.华中农业大学作物遗传改良国家重点实验室,武汉 430070;2.武汉市农业科学院蔬菜研究所,武汉 430345;3.武汉莱菔农业科技有限公司,武汉 430345
萝卜(Raphanus sativusL.)是十字花科萝卜属1年生或2年生草本植物,是我国秋、冬季的主要蔬菜之一。叶片是植物进行光合作用及蒸腾作用的主要场所。萝卜叶形各异,根据叶缘形状及裂刻深浅可大致分为花叶(羽状深裂或全裂)和板叶(全缘或叶缘浅裂)2 种类型[1-2]。研究表明,花叶透光性好,空气流通性强,可减轻病虫危害,提高作物的品质与产量,是植物适应环境的重要表现[3-4]。因此,叶形是萝卜重要的产量性状。此外,萝卜花叶对板叶为显性,在生产上常作为指示性状用于杂种纯度鉴定,是萝卜育种的重要性状之一[5]。然而,目前关于萝卜花叶性状的遗传机制尚不明确。
近年来,随着萝卜参考基因组的公布及高通量测序技术的发展,萝卜重要性状的遗传及基因定位研究有了较大的进展,但多集中在根部性状如根部形态、色泽等,未见花叶基因的相关报道[6]。十字花科植物叶缘裂刻基因(花叶基因)的定位主要集中芸薹属植物白菜(Brassica rapa)[7]、甘蓝型油菜(B.napus)[8-9]和甘蓝(B. oleracea)[10]。前人研究表明,萝卜(2n=18,RR)与芸薹属植物亲缘关系近,萝卜基因组与拟南芥基因组(2n=10)及芸薹属物种基因组如白菜基因组(2n=20,AA)之间存在较好的共线性关系,这些共线性区块可为萝卜重要性状QTLs的候选基因鉴定提供帮助[11-13]。本研究以胞质雄性不育材料WA(板叶)为母本、恢复系材料J4(花叶)为父本构建F2叶形分离群体,利用BSA 结合GBS 的极端混池测序法(bulked segregant analysis sequencing,BSA-seq)对萝卜花叶基因进行初定位,通过将萝卜全基因组与甘蓝型油菜全基因组进行共线性比对,并结合基因功能注释确定萝卜花叶性状的候选基因,旨在为萝卜花叶基因克隆、叶形改良及辅助选育萝卜花叶品种奠定基础。
1 材料与方法
1.1 材 料
以胞质雄性不育材料WA(板叶)为母本,恢复系材料J4(花叶)为父本,构建F2群体,用于花叶性状的遗传分析和基因定位研究。11个萝卜栽培品种(7个花叶品种与4 个板叶品种)用于候选基因的序列分析。供试材料均由武汉市农业科学院蔬菜研究所萝卜育种室提供。
1.2 叶形性状调查及遗传分析
萝卜植株长至5~6 片真叶时进行叶形调查。F2单株表型鉴定时要先对单株编号并挂牌,每个单株的表型分别调查3次,确保表型无误后计算F2群体的叶形分离比,并进行卡方检验。
1.3 基因组DNA的提取及Bulk池建立
按照挂牌顺序进行取样,每个单株约取0.25 g幼嫩叶片,放入96 孔深孔板内。采用改良的CTAB 法提取DNA,并用琼脂糖凝胶电泳检测所提DNA的质量。根据F2群体表型,随机选取20个花叶单株DNA和20 个板叶单株DNA,经Qubit 测定浓度后,将20个花叶单株的DNA 和20个板叶单株的DNA 分别等质量混合构成花叶DNA 混池(Bulk 1,BK1)和板叶DNA 混池(Bulk 2,BK2),并将终质量浓度调整至25 ng/μL。
1.4 简化基因组测序文库构建
用Chen 等[14]的方法构建简化基因组测序文库。即用SacⅠ和MseⅠ对亲本和2 个混池的基因组DNA 分别进行双酶切,然后分别连接上含有不同标签序列的接头。将带有不同标签的连接产物混合成1个测序文库,经PCR 产物回收试剂盒(Qiagen)纯化浓缩后在2%的琼脂糖凝胶上电泳分离,并用胶回收试剂盒(Qiagen)将220~500 bp的片段进行回收。利用PCR 反应给每个混合测序文库引入与Illumina flow cell上固定的寡核苷酸互补配对的序列,PCR 产物经琼脂糖凝胶电泳分离后用胶回收试剂盒回收目标片段。构建好的测序文库在HiSeq 4000 平台上进行测序。
1.5 测序数据分析
用 FastQC(https://www.bioinformatics.babraham.ac.uk/projects/fastqc/)检测测序原始序列的质量,并用Trimmomatic[15]软件进行质量控制。质控后的数据经BWA 比对到萝卜参考基因组(http://radish-genome.org/)上,再用 GATK[16]提取全基因组变异信息,用ANNOVAR[17]对变异信息进行注释。BWA 和Samtools 分析均使用默认参数,GATK使用的过滤参数为“QUAL <30.0 || QD <4.0 ||FS > 60.0||MQ < 40.0 ”。
1.6 候选基因的初定位
以萝卜参考基因组作为参考,利用QTLseqr 软件[18]计算每个多态性位点在2 个混池中的SNP-index 及Δ(SNP-index)。使用滑窗分析方法计算500 kb 区段内SNP-index 及Δ(SNP-index)的均值,并对其在染色体上的分布作图,步长2 Mb。两池中差异较大的区段即为萝卜花叶基因的候选区段。
1.7 萝卜基因组与油菜基因组的共线性分析
利用MCScanX[19]分析萝卜基因组与甘蓝型油菜基因组的共线性关系。并对萝卜花叶基因定位区间内的共线性区段进行基因功能注释,预测萝卜花叶候选基因。
1.8 候选基因的序列分析
基于萝卜参考基因组,在Rs390250全长、上游1 kb 和下游 200 bp 处共设计 3 对引物(Rs-1F/Rs-1R、Rs-2F/Rs-2R、Rs-3F/Rs-3R)分别对亲本进行PCR 扩增。PCR 产物直接进行测序,并利用Sequencher(GeneCodes,USA)软件进行测序序列的比对与变异位点检测。针对亲本序列间存在的664 bp插入变异(Indel664)开发成分子标记(Rs-3F/Rs-2R),扩增F2群体中表型为板叶(隐性)的单株,检测该候选基因是否与花叶性状共分离。引物序列见表1。

表1 Rs390250扩增引物Table 1 Primers for Rs390250 amplification
1.9 表达量分析
当植株长到5~6 片真叶时,采用Trizol Reagent方法分别提取花叶与板叶亲本真叶的RNA,2%琼脂糖凝胶电泳检测RNA 的质量并用Nanodrop(Thermo Scientific,USA)检测RNA 纯度。利用RevertAid First strand cDNA synthesis kit(Thermo Scientific,USA)合成cDNA 的第一链作为模板,进行亲本的RT-PCR 反应,检测候选基因Rs390250的表达水平。Rs390250基因特异性引物Rsa 来自https://biodb.swu.edu.cn/qprimerdb/[20],Actin[6]作为对照基因(引物序列见表1)。
1.10 LMI1-like基因的序列比对与进化树构建
利用MEGA7 软件对已报道的多个控制叶缘裂刻的LMI1-like基因进行氨基酸序列比对,并对来自芸薹属植物和萝卜的基因序列进行系统发育分析。统计方法选用最大似然法,系统发育测验釆用“Bootstrap”重复1 000 次。Rs390250的氨基酸序列在http://radish-genome.org/下载。来自拟南芥、白菜、甘蓝及甘蓝型油菜的基因序列在http://brassicadb.org/brad/下载,其余基因的序列在 NCBI(https://www.ncbi.nlm.nih.gov/genbank/)通过 Genbank 号[ChLMI1(KF939590) ,RCO(LMI1-like2,KF939591) ,LMI1-like3(KF939592) ,CaLMI1(PHT71668) ,CgRCO(KM214233) ,CrRCO(KM214232)]检索并下载。
2 结果与分析
2.1 花叶性状的遗传分析
亲本J4 叶缘锯齿锐尖,部分裂刻直达中脉,表现为花叶;亲本WA 叶缘有小齿近全缘,表现为板叶(图1)。F1植株全为花叶,裂刻深度介于双亲中间。F2群体共287 个单株,其中花叶有219 株,板叶有68株,花叶与板叶的分离比为3.22∶1,符合预期的孟德尔分离比(χ2=0.227<3.84),表明花叶性状受1 对基因控制,花叶对板叶呈不完全显性。
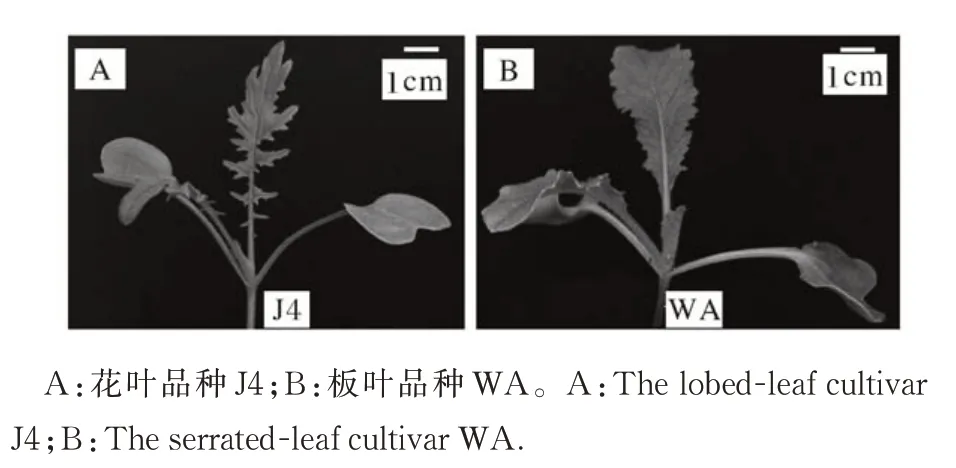
图1 萝卜叶形Fig.1 The leaf shape of Raphanus sativus L.
2.2 混池测序与叶形基因初步定位
利用BSA-seq[21]分别对花叶和板叶亲本及BK1和BK2进行简化基因组测序。花叶亲本J4和板叶亲本WA分别获得2 500 383和3 453 168条双端序列,花叶混池BK1 和板叶混池BK2 分别得到2 851 995和4 844 581 条序列。将亲本及2 个混池的序列分别比对到萝卜参考基因组,经质量控制及亲本的基因型筛选后,共得到4 543 个高质量多态性位点,包括3 851 个 SNP(single nucleotide polymorphism)位点和692个Inde(lInsertion/Deletion)位点。利用QTLseqr软件分别计算 BK1 和 BK2 的 SNP-index 及 Δ(SNP-index)(移动窗口为2 Mb)(图2),结果显示在 R7 染色体 66 425~7 968 993 bp 区间内Δ(SNP-index)超过阈值0.5(P=0.000 1),表明萝卜花叶基因可能位于该区间内。

图2 BSA-seq定位萝卜花叶基因Fig.2 Genetic mapping of leaf shape gene by BSA-seq
2.3 共线性分析及萝卜花叶候选基因分析
通过将萝卜全基因组与甘蓝型油菜全基因组进行共线性分析,发现位于萝卜R7 染色体花叶候选区间0.87~1.32 Mb 与油菜A10 染色体的16.35~16.80 Mb 存在很好的共线性(图3)。甘蓝型油菜中存在类似的花叶变异,油菜花叶基因BnLL1.LMI1(BnaA10g26320D)和BnA10.LMI1(BnaA10g26330D)都位于该共线性染色体区段[7-9]。根据萝卜参考基因组对该区段内的70 个基因进行注释分析发现,Rs390250(899 863~901 651 bp)与油菜花叶基因BnaA10g26320D、BnaA10g26330D及拟南芥AT5G037 90(LMI1,Late Meristem Identity1)是直向同源基因,都属于HD-ZipⅠ家族,编码 HD-ZipⅠ(the classⅠhomeodomain leucine-zipper)转录因子。在拟南芥叶发育调控网络中,LMI1位于分生组织调节因子LFY(Leafy)下游,诱导CAL(Cauliflower)基因表达,影响拟南芥锯齿叶的形成[22]。因而,我们推测Rs390250为控制萝卜花叶的候选基因。

图3 萝卜花叶基因候选区间的共线性分析Fig.3 The collinearity analysis in the candidate interval of the lobed-leaf gene
2.4 候选基因的序列比较分析
Rs390250基因全长1 789 bp,由3 个外显子和2个内含子组成,编码220个氨基酸。根据萝卜参考基因组,分别扩增了亲本Rs390250翻译起始点(translation start site,TSS)上游1 kb 及编码区序列,并进行PCR 产物测序。序列比对发现,在基因的开放阅读框(open reading frame)内存在 3 个 SNP(G84C、A177T 和T425C)。其中,A177T 为同义突变(synonymous mutation),而 G84C 和 T425C 是非同义突变(non-synonymous mutation)(图4A、B)。在启动子区,位于 TTS 上游-418 bp 处,J4 存在 149 bp 的插入序列,其中130 bp 与插入位点后的130 bp 序列重复。另外,在J4 的第一内含子内还存在664 bp 的插入序列(图4A)。该插入序列两侧存在9 bp 目标信号复制(target sigte duplicate)序列GTTTTTAAA,插入序列两端存在4 bp 的末端反向重复序列(GAGTTATTCTTGGGTTCACCCCCTAGGGT -GAACCTTTAGGTTCACC)。检索转座子数据库(http://pmite.hzau.edu.cn)[23],发现该 664 bp 的插入序列属于Mutator类转座子。
为了检测该转座子是否与花叶基因共分离,在664 bp 插入序列两侧设计引物(Rs-3F/Rs-2R),扩增F2群体内的68 个隐性单株(板叶表型),琼脂糖胶检测发现这68 个单株的基因型同母本(WA)相同,且比J4 扩增片段小了约700 bp,即都不含有这664 bp的插入(图4C),这表明该基因在群体内同花叶性状共分离。RT-PCR分析发现,Rs390250的转录水平在WA 和J4 的真叶内无明显差异(图4D),表明叶形变异可能与启动子及内含子中的插入序列无关。
Rs390250编码 HD-ZipⅠ(the class I homeodomain leucine-zipper)转录因子。HD-ZipⅠ蛋白由同源异型域(homeodomain,HD)与紧随其后的亮氨酸拉链(leucine zipper,LZ)结构域组成。LZ 结构域具有多个亮氨酸,能形成二聚体结构帮助HD-Zip 蛋白识别目标DNA,对HD-ZipⅠ转录因子的功能发挥具有重要作用[24]。本研究中,位于Rs390250第 3 外显子的非同义突变位点T425C 将导致该位点编码的丝氨酸(serine,S)变为亮氨酸(leucine,L),且该位点恰位于LZ 结构域内(图4B)。这表明,该位点的突变可能破坏了LZ 结构域的形成,进而对HD-ZipⅠ转录因子的功能造成影响。为验证以上猜想,本研究对多个已报道的控制叶缘裂刻的LMI1-like基因在LZ 结构域上的氨基酸序列进行比对,并将Rs390250与拟南芥LMI1-like基因及芸薹属物种报道的花叶基因进行系统发育分析。结果显示,所有花叶基因同Rs390250-J4 在该位点上都翻译为S,仅WA 翻译为L,表明该位点的S 为保守氨基酸(图5A),且该基因同BnaA10g26320D属于RCO(reduced complexity,LMI1-like2)类型(图5B)。进一步对来自11 个萝卜栽培品种的Rs390250序列进行扩增并进行Sanger测序,结果显示,所有板叶品种在该位点上基因型为T/T,花叶材料在该位点上表现为C/C 或C/T(表2)。综上,T425C 可能是导致萝卜叶形变异的关键位点。

表2 11个萝卜栽培品种的表型与基因型Table 2 The genotype of the 425th nucleotide in the coding sequence of Rs390250 from 11 radish varieties
3 讨 论
花叶是十字花科植物广泛存在的一种类型。LMI1是调控拟南芥叶缘发育的重要基因。近年来,十字花科芸薹属植物中定位到的控制叶缘裂刻的基因(花叶基因)有Bra009510(B. rapa)、BnaA10g26320D和BnaA10g26330D(B. nupus)、Bol010029和Bol010030(B. oleraceavar .acephala DC.),以上基因都是At5g03790(LMI1)的同源基因,这表明LMI1-like基因在十字花科植物里主要控制叶缘裂刻的发生,功能相对保守。
本研究通过将同属十字花科植物的萝卜参考基因组与甘蓝型油菜参考基因组进行共线性分析,在初定位区间内发现 1 个LMI1-like基因(Rs390250),注释分析和序列分析结果表明其可能是控制萝卜花叶的候选基因。系统发育分析结果表明Rs390250属于RCO类型,前人研究显示RCO控制复叶的小叶形成,将RCO导入拟南芥中,植株叶缘出现明显的裂刻[25-26]。萝卜和油菜的叶片都属于简单叶,BnaA10g26320D已被证实是控制甘蓝型油菜裂叶的关键基因[8],这表明RCO类基因在简单叶中也能控制叶缘的发育。此外,前人研究结果显示BnaA10g26320D在Yuye87(裂叶亲本)和Zheyou 50(浅裂亲本)中表达量差异很大;BnaA10g26330D在以上材料中表达量较低且无明显变化,但在HY(裂)和J9707(浅裂)中差异显著[8-9],这2 个基因控制的叶形变异都被认为是因顺式调控引起的不同等位基因效应造成的。本研究中,Rs390250在板叶和花叶亲本中的表达量无明显差异,而位于第二外显子的非同义突变位点T425C恰好位于LZ 结构域内,且导致保守氨基酸的改变,这对HD-ZIP 蛋白的功能可能造成影响。故本研究认为该位点的变异可能是造成萝卜叶形变异的关键原因。本研究结果可为进一步解析萝卜花叶性状的形成和RCO类基因的作用机制进而为叶形的改良及辅助选育萝卜花叶品种奠定基础。
