脂肪干细胞抑制炎症对缓解兔耳增生性瘢痕形成效果研究
2022-06-06杨玲玲王洪一白泽明韩子阳刘芮嫡
杨玲玲, 黄 悦, 王洪一, 白泽明, 韩子阳, 刘芮嫡, 陶 凯
北部战区总医院 烧伤整形科,辽宁 沈阳 110016
创面愈合的过程需要多种细胞、因子和介质的参与,愈合过程中任何一个阶段发生异常都可能导致瘢痕的形成。愈合过程中的炎症期会有大量炎症因子的释放,炎性细胞通过细胞介质参与炎症反应,诱导成纤维细胞活化,成纤维细胞也会反过来调节细胞因子的表达,进一步参与炎症反应[1]。白细胞介素-1(interleukin-1,IL-1)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)在炎症期均发挥重要的作用,因此,在增生性瘢痕有关的炎症因子表达的相关研究中,这些因子是研究的重点[2-5]。适度的炎症反应对于创面修复是有利的,但是,炎症反应过度可能诱发增生性瘢痕的产生。目前,有学者提出,抑制炎症反应可能会对增生性瘢痕的治疗发挥一定作用[4]。Xie等[6]研究表明,间充质干细胞具有促进伤口愈合并且减少瘢痕增生的作用,脂肪源性干细胞(adipose-derived stem cells,ADSCs)也已经被证明可以参与组织和器官的损伤和修复,具有促进创面愈合的作用。但是,ADSCs对于病理性瘢痕的作用机制目前仍在研究中。本研究通过建立兔耳增生性瘢痕模型,探讨ADSCs是否可以通过抑制增生性瘢痕炎症的发生,发挥抑制增生性瘢痕的作用。现报道如下。
1 材料与方法
1.1 兔脂肪源性干细胞提取 选取20只清洁级新西兰大白兔,体质量为2.5~3.5 kg,购自辽宁长生生物技术有限公司,饲养于北部战区总医院的实验动物中心。购入后调整性饲养1周,环境条件为(25℃±1℃)、湿度为55%~65%,饮食、进水均自由。将购买的大白兔分开饲养1周,让其适应环境,然后开始实验。取2只清洁级新西兰大白兔,麻醉后获取兔左侧腹股沟的皮下脂肪组织,用PBS反复冲洗脂肪组织,至无血色为止。将组织装至50 ml离心管中,1 200 r/min离心5 min。弃去油脂层,将脂肪层重新收集至离心管中。使用0.125%浓度的Ⅰ型胶原酶按1∶1比例加入脂肪组织,放入5% CO2培养箱中消化2 h,期间每15 min取出摇匀1次。脂肪消化成黏糊状,1 200 r/min离心15 min。离心后使用生理盐水重悬脂肪细胞,将细胞接种于培养皿内。置于37℃、5% CO2培养箱内孵育培养,取3~7代细胞进行后续实验。
1.2 流式细胞技术检测 取第3代的ADSCs,用1% PBS冲洗2~3次,加入适量0.25%胰蛋白酶消化细胞3~5 min,然后加培养基终止消化。离心(100 g,1 500 r/min,10 min)。弃去上清,加入生理盐水重悬细胞。将细胞(1.0×106个/ml)转入EP管中,每管100 μl,然后加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的CD45和CD73及PE标记的抗体CD34和CD90,每管5 μl。对照组加入5 μl相对应的同型对照IgG1-FITC、IgG1-PE,4℃避光孵育30 min。4℃离心(100 g,1 000 r/min,5 min)。弃去上清,生理盐水重悬细胞。利用流式细胞仪检测CD34、CD45、CD73、CD90表面标志物。本实验重复3次,结果取均值。
1.3 兔耳增生性瘢痕模型建立及治疗 分别在18只大白兔双耳腹侧设计4个大小为1.5 cm×1.5 cm的方形切口线,切口间距1.0 cm。常规手术消毒兔耳腹侧,然后行肿胀麻醉液的配置,术区局部麻醉满意后,使用尖刀片沿着已经设计好的切口线将兔耳全层皮肤至软骨膜切开,至软骨表面后进行剥离,然后将全部皮肤和软骨膜逐一去除,切除过程中保持耳软骨的完整。
建模成功后,将大白兔分为对照组(n=9)和治疗组(n=9)。对照组:用 2 ml 注射器,从瘢痕四周正常皮肤约0.4 cm处刺入至瘢痕中央,每点注射0.3 ml生理盐水。治疗组:用2 ml 注射器,从瘢痕四周正常皮肤约0.4 cm处刺入至瘢痕中央,每点注射0.3 ml(1×105个)ADSCs。分别在术后即刻,术后1、3、5周注射4次。分别于术后1、3、5周将每组3只动物处死取材,取材时将瘢痕组织、瘢痕周围部分正常皮肤软组织及其下方的软骨一起切除。每个标本由中轴纵切均分为两等份,一份组织放入10%中性甲醛溶液中固定,一份组织保存于液氮中。
1.4 HE染色 4%甲醇固定标本24 h,冲洗干净后分别用70%~100%浓度乙醇逐一脱去标本中的水;浸蜡,包埋;标本切片,切片厚度5 μm。切片在60℃条件下烘干,二甲苯脱蜡;70%~100%不同浓度乙醇干燥切片;苏木精染色5 min;水清洗后使用伊红进行染色2 min;水漂洗后通过中性树胶封片,显微镜下观察,200倍下拍照。
1.5 酶联免疫吸附试验 将组织匀浆,使用双抗体夹心法酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒按照说明书测定标准曲线后,在450 nm波长下用酶标仪测定光密度值,根据标准曲线计算IL-6和TNF-α的含量。
1.6 实时荧光定量PCR实验 将组织裂解,氯仿抽提去除蛋白和DNA,异丙醇沉淀RNA,乙醇清洗沉淀,DEPC水溶解RNA。根据反转录试剂盒,将RNA反转录为cDNA,使用SYBR试剂盒,在95℃ 30 s、变性95℃ 30s、退火55℃ 30 s、延伸72℃ 30 s的条件下进行实时荧光定量 PCR实验。所用引物包括Ⅰ型胶原(collagen Ⅰ,COLⅠ),正向引物:GAGGGCAACAGCAGGTTCACTTA,反向引物:TCAGCACCACCGATGTCCA;α-平滑肌肌动蛋白(alpha--smooth muscle actin,α-SMA),正向引物:GACAATGGCTCTGGGCTCTGTAA,反向引物:TGTGCTTCGTCACCCACGTA;GAPDH,正向引物:GCACCGTCAAGCTGAGAAC,反向引物:TGGTGAAGACGCCAGTGGA。

2 结果
2.1 脂肪源性干细胞鉴定 与相应的同型对照比较,ADSCs表面抗原CD73(99.9%)和CD90(99.9%)呈阳性表达,而CD34(2.09%)和CD45(1.36%)呈阴性表达,证明脂肪源性干细胞提取成功。见图1。
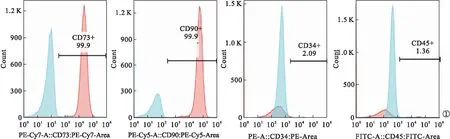
图1 ADSCs表面抗原标志物的表达
2.2 ELISA测定ADSCs对炎症因子的影响 与对照组相应时间点比较,ADSCs作用1、3、5周时,组织中IL-6的表达均显著下调,TNF-α的表达均被抑制,差异有统计学意义(P<0.05)。见图2、3。

图2 ADSCs对IL-6表达的影响(与对照组比较,①P<0.05) 图3 ADSCs对TNF-α表达的影响(与对照组比较,①P<0.05)
2.3 ADSCs对组织中COLⅠ及α-SMA表达的影响 与对照组相应时间点比较,ADSCs作用1、3、5周时,组织中COLⅠ和α-SMA的表达均显著下调,差异有统计学意义(P<0.05)。见图4。

图4 ADSCs对组织中COLⅠ和α-SMA表达的影响(与对照组比较,①P<0.05)
2.4 HE染色观察 ADSCs的添加可显著降低组织中炎性细胞聚集的现象,对照组胶原错乱排列的现象比较严重。见图5。
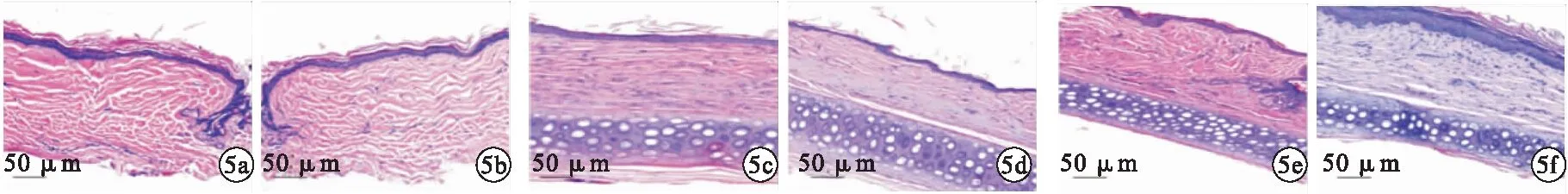
图5 HE染色观察瘢痕组织情况(200倍;a.对照组1周时;b.治疗组1周时;c.对照组3周时;d.治疗组3周时;e.对照组5周时;f.治疗组5周时)
3 讨论
目前,对于病理性瘢痕的形成机制有很多猜想,例如免疫炎症性因素,细胞因子调节异常,细胞基质异常等。有研究报道,抑制细胞的增殖、抑制细胞外基质的沉积、抑制炎症的进展,可能是预防和治疗病理性瘢痕的方法[7]。本研究通过进行兔耳瘢痕实验,探讨ADSCs对兔耳瘢痕中炎症因子的影响,从而探讨ADSCs对增生性瘢痕的可能防治机制。为了鉴定原代培养的ADSCs是否培养成功,本研究采用了流式细胞技术检测细胞表面标志物的表达情况,结果发现,该细胞表面CD73和CD9阳性表达,而CD34和CD45阴性表达,提示ADSCs提取成功。
有研究报道,适当的炎症反应可以促进创面的愈合,但是,如果炎症持续存在或者过度表达,可能会导致细胞外基质大量沉积,进而造成增生性瘢痕的形成[8-9]。Xie等[8]指出,IL-6可吸引中性粒细胞释放炎症介质,TNF-α可促进中性粒细胞黏附于内皮细胞上,刺激局部炎症反应。因此,大量IL-6和TNF-α等炎症因子的存在,使得炎症反应加重,最终诱导增生性瘢痕。本研究结果发现,ADSCs可以显著下调兔耳瘢痕组织中IL-6和TNF-α的表达,由此可见,ADSCs可能通过下调炎症因子的表达发挥抑制增生性瘢痕的作用。
与正常组织相比,增生性瘢痕中COLⅠ表达增多[10-13]。本研究通过实时荧光定量PCR检测发现,ADSCs能够显著下调组织中COLⅠ的表达,进而发挥抑制增生性瘢痕形成的作用。α-SMA可以促进细胞移动和收缩,在创面收缩、瘢痕挛缩等增生性瘢痕病理性形成过程中发挥关键作用。既往研究发现,ADSCs可能通过增加肝细胞生长因子的分泌来介导下调成纤维细胞中α-SMA的表达[11-12]。本研究结果也证明,ADSCs可有效抑制增生性瘢痕中α-SMA的积累。由此可见,ADSCs可以通过下调COLⅠ和α-SMA的表达,改善创面收缩与瘢痕挛缩,从而进一步缓解增生性瘢痕的发生与发展。
综上所述,ADSCs能够通过下调增生性瘢痕中炎症因子的表达,抑制COLⅠ和α-SMA的含量,发挥抑制增生性瘢痕的作用。
