5-羟色胺基因缺陷增强急性应激后高唤醒状态*
2022-06-06周萍肖华李勇辉董昕文
周萍 肖华 李勇辉 董昕文
(1 湖南师范大学教育科学学院心理学系,长沙 410018) (2 中国科学院心理研究所心理健康重点实验室,北京 100101)(3 中国科学院大学心理学系,北京 100049)
1 引言
应激刺激是对机体的生存、繁衍过程有伤害或干扰的刺激,能够诱发机体的应激反应以降低应激刺激造成的伤害。当应激刺激的强度过大,超出应激系统的承受能力,达到创伤应激程度,则会打破应激系统的稳态(McEwen,2017),使机体产生持续的过度反应,出现急性应激障碍、创伤后应激障碍等应激相关精神障碍(American Psychiatric Association,2013)。
唤醒状态持续处于高水平是创伤应激引起的过度应激反应之一,对创伤相关记忆的闯入性回忆、负性心境、情绪麻木等心理症状有预测性(Bryant et al.,2008,2017;Gelkopf et al.,2019)。高唤醒症状的强度和表现受到创伤类型和强度的影响,如暴力伤害比意外事故能引起更严重的高唤醒症状(Agarwal et al.,2020),但是也有研究发现,高唤醒症状相比其他PTSD 症状,在不同创伤类型之间变异性更低(Boal et al.,2017)。应激引起的高唤醒状态受到多个神经化学系统的调节,包括去甲肾上腺素系统、5-羟色胺(5-hydroxytryptamine,5-HT)系统、应激激素系统及其它多个神经肽系统(Stam,2007)。其中5-HT 对慢性高唤醒症状有重要作用(Young,2013)。5-HT 是一种单胺类神经递质,又称血清素,分泌5-HT 的细胞胞体主要位于脑干中缝核,并投射到多个应激相关的前脑区域,包括杏仁核、终纹床核、海马和前额叶(McQuade &Sharp,2002)。5-HT 不仅参与调节睡眠、觉醒状态(Monti,2011),还参与调节应激引起的唤醒上升(Linthorst&Reul,2008;Wankhar et al.,2020)。在中等应激强度下,5-HT 在前额叶的释放可以减少烦躁不安和焦虑(Sherin &Nemeroff,2011),严重的创伤应激则会导致5-HT 系统短时间内过度激活,随后导致5-HT的耗竭(Kaehler et al.,2000),出现烦躁不安、易激惹、注意力不集中等高唤醒表现(Young,2013)。当前对于5-HT 与高唤醒关系的研究很少,作用机制不明确。
基于动物模型对创伤应激反应进行的研究,通常采用两类应激方式,分别是心理应激方式,比如天敌或天敌气味暴露、(无接触的)社交挫败等,和生理与心理应激相结合的应激方式,比如束缚、电击、水下应激等(Stam,2007;Török et al.,2019)。目前没有研究系统对比过动物模型中应激类型对高唤醒状态的强度和持续时间的影响。高唤醒的具体表现包括心率、血压等心血管活动提高,入睡困难或睡眠维持困难,注意力无法集中,易激惹,持续的惊吓反射上升等。其中惊吓反射(startle reflex)是个体对外界突发性强刺激作出的防御反射,表现为面部与躯干肌肉的快速收缩。相比其它高唤醒的生理或行为表现,惊吓反射用于实验研究具有诸多优点,包括在哺乳动物中广泛存在,反应幅度相对稳定,可反复测试而没有明显的习惯化现象,测量方法简单易操作,因此是反映高唤醒程度的稳定客观指标(Lang et al.,1990),适用于前临床研究和临床转化研究。
本研究关注5-HT 在创伤应激造成的持续高唤醒状态中的调节作用,基于实验室先前建立的创伤后应激障碍动物模型(Dong &Li,2014),通过测量惊吓反射幅度反映唤醒水平,采用色氨酸羟化酶(tryptophan hydroxylase,Tph)基因缺失小鼠考察不同5-HT 水平对创伤引起的高唤醒的影响。Tph是将色氨酸转化为 5-羟色氨酸的催化酶,共有Tph1 和Tph2 两种亚型,中枢神经系统内以Tph2为主(Walther et al.,2003)。基因完全敲除(-/-)的小鼠脑内 5-HT 合成减少约 95%(Gutknecht et al.,2012;Liu et al.,2011),极易夭折,健康状态差。杂合型(+/-)小鼠脑内5-HT 合成减少约20%~25% (Liu et al.,2011),没有明显的健康问题。因此,本研究采用杂合型基因缺失小鼠,与野生型小鼠对比,并采用纯心理应激(天敌暴露应激)和生理心理应激相结合(足底电击应激)两种应激方式,考察5-HT 降低对创伤应激引起的高唤醒的产生、发展的作用,同时考察其中的性别差异。
2 实验材料和方法
2.1 实验动物
实验采用野生型小鼠和基因缺失的杂合型(+/-)小鼠共136只,其中雄性野生型小鼠26只,雌性野生型小鼠35 只,雄性+/-小鼠40只,雌性+/-小鼠 35 只。野生型小鼠为C57/BL6J 型小鼠,+/-小鼠遗传背景同为C57/BL6J,从北京大学实验动物中心购入,购入时体重23~26 g,10 周龄。购入后在中国科学院心理研究所动物实验平台进行繁育。小鼠出生后21 天,进行基因鉴定,然后根据基因型分笼饲养,每盒2~5 只。实验均在光照期进行(8:00 至20:00),温度21~24 ℃,湿度40%~60%。实验期间保持动物自由进食和饮水,每周至少更换一次垫料。正式实验开始前,实验人员对小鼠进行抓取、抚摸等操作,每次5 分钟,每天一次,连续进行7 天,使其适应实验人员操作。所有实验操作符合《实验动物管理条例》,并且经中国科学院心理研究所伦理委员会审核通过。
2.2 实验基本流程与分组
所有小鼠在适应实验人员操作一周后进行听觉惊吓反射测试,每天一次,共两次。第一次测试作为动物适应测试环境和测试过程的适应,数据未进行统计。根据第二次惊吓反射测试基线值,对所有小鼠进行伪随机平衡分组,不同组动物在两天后接受不同应激处理,分别为无应激组(控制组)、天敌暴露应激组(天敌组)、足底电击应激组(电击组)。其中,野生型雄鼠控制组8 只,天敌组9 只,电击组9 只;+/-雄鼠控制组13 只,天敌组13 只,电击组14 只;野生型雌鼠控制组12 只,天敌组12只,电击组11 只;+/-雌鼠控制组12 只,天敌组12 只,电击组11 只。由于部分小鼠在接受天敌应激时受到天敌(猫)的直接攻击,实际纳入数据分析的天敌应激组动物数量为:雄性野生型9 只,雄性+/-型10 只,雌性野生型8 只,雌性+/-型6 只。在应激后不同时间点,对所有动物进行多次听觉惊吓反射测试,分别为应激后1 天、2 天、10 天、18 天,考察不同应激诱发的听觉惊吓反射幅度变化过程。
2.3 基因型鉴定方法
从鼠尾末端组织中提取DNA,采用以下序列的引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增:5′-GGGCATCTCAGGACGTAGTAG;5′-GGGCCTGCCGATAGTAA CAC;5′-GCAGCCAGTAGACGTCTCTTAC;之后根据凝胶电泳成像结果判断小鼠基因型。
2.4 应激方法
无应激组(控制组)小鼠,转移至非饲养间的实验室中,在与饲养盒相似大小的盒中独处10 分钟,回到原饲养盒。
天敌暴露应激组(天敌组)小鼠,被放入猫所在的敞口开放空间(2 m × 1 m × 1 m),实验人员在旁边监控,如果二者间距离小于20 cm 则立即将小鼠转移至空间内远离猫的位置,避免直接接触及可能的躯体伤害。部分小鼠受到猫的直接攻击,未纳入后续测试和数据分析(详见2.2)。5 分钟后取出小鼠,回到饲养间。
足底电击应激组(电击组)小鼠,被放入电击箱(30 cm × 30 cm × 27 cm,天鸣宏远科技发展有限公司),3 分钟后接受第一次足底电击,电流强度1.5 mA,持续5 秒,共接受5 次电击,间隔60~120 s,最后一次电击后,在电击箱中停留1 分钟,之后放回到饲养盒。电击箱采用5%酒精清洁。
2.5 听觉惊吓反射测试
听觉惊吓反射通过听觉惊反射系统(San Diego Instruments 公司)进行测量。从饲养盒取出小鼠,放入适配小鼠的固定盒,将固定盒放入隔音箱中,隔音箱内扬声器持续播放65 dB 白噪音直至实验结束。进入隔音箱5 分钟后,给予90 dB、100 dB、110 dB,持续50 ms 的白噪音刺激各10 次,刺激顺序随机,刺激间隔10~50 s 随机。通过小鼠固定盒底部的加速度传感器,记录小鼠在声音刺激开始前200 ms 到声音结束后1000 ms 的重力变化,采样率为每秒1000 次。结束后,取出小鼠,放回到饲养笼,用5%酒精清洁动物固定盒。
2.6 统计分析
使用R 1.70 和RStudio 1.3.959 软件进行数据处理。由于多数小鼠在90 dB 噪音刺激下没有出现明显的惊吓反射反应,没有将90 dB 条件下的惊吓反射反应纳入统计分析,而采用了100 dB 和110 dB诱发的惊吓反射的平均值。对雄性和雌性小鼠的听觉惊吓反射幅度分别进行三因素混合方差分析(基因型×应激类型×测量时间,测量时间为重复测量因素),并进行事后检验和简单效应分析(均采用TukeyHSD 校正),以< 0.05 为差异显著标准,并报告效应量η和95%置信区间。
3 结果
3.1 性别、基因型对小鼠听觉惊吓反射基线水平的影响
应激前对所有动物进行了听觉惊吓反射测量,考察性别、基因型(野生型或+/-)对听觉惊吓反射幅度的影响。组间方差分析结果显示,性别主效应显著((1,119)=18.6,< 0.001,η=0.135,图1),雄性动物的惊吓反射幅值显著大于雌性动物,95% CI=[36.5,99.5],基因型主效应不显著,性别与基因型的交互作用不显著。根据基线测试结果,对不同性别、不同基因型的小鼠进行平衡分组,分别接受不同类型应激刺激。
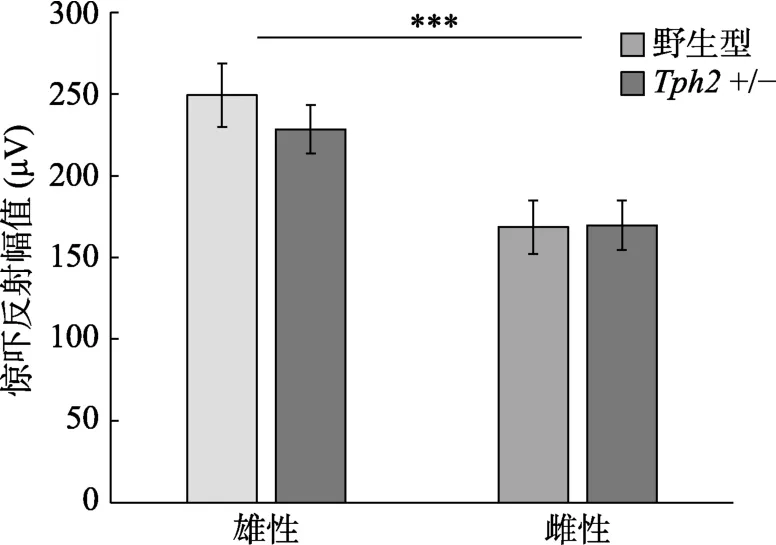
图1 性别、基因型对小鼠听觉惊吓反射幅值的影响
3.2 Tph2 基因对雄性小鼠应激后听觉惊吓反射的影响
基于惊吓反射基线值对不同基因型小鼠进行平衡分组后,分别进行了天敌暴露应激、足底电击应激及无应激操作,并在1 天、2 天、10 天、18 天后进行4 次听觉惊吓反射测试。以测量时间为重复测量变量,应激类型和基因型为组间变量,分别对不同性别小鼠的惊吓反射幅值进行了方差分析。
结果显示,应激类型对雄性小鼠惊吓反射反应幅度有显著影响((2,57)=7.17,=0.002,η=0.09,图2),在天敌暴露应激和电击应激后均出现了惊吓反射上升(天敌组与控制组,=0.001,95%CI=[22.6,109.0];电击组与控制组,< 0.001,95%CI=[53.0,136.0]);基因型主效应不显著;基因型与应激类型交互作用显著,(2,57)=3.20,=0.048,η=0.043。进一步的简单效应分析显示,经历电击应激的雄性+/-小鼠相比控制组和天敌应激组,听觉惊吓反射幅度更高(电击组与控制组,< 0.001,95% CI=[63.5,192.0];电击组与天敌组,=0.022,95% CI=[6.76,145.0]),而不同应激处理组的野生型雄性小鼠惊吓反射幅值无差异(> 0.05)。不同测量时间惊吓反射有显著变化,(3.37,192.34)=20.4,< 0.001,η=0.18 (图2)。对应激效果的简单效应分析显示,在应激后1 天、2天、10 天,电击组雄性+/-小鼠的惊吓反射幅值均显著高于控制组(应激后1 天,=0.031,95%CI=[13.0,312];应激后2 天,< 0.001,95% CI=[84.4,325];应激后10 天,=0.002,95% CI=[68.3,311]),天敌组雄性+/-小鼠与控制组在各个时间点无显著差异;野生型小鼠,仅在应激后1 天,天敌应激组惊吓反射显著高于控制组(=0.025,95% CI=[22.6,374]),在其它时间点天敌组和电击组小鼠的惊吓反射幅值均与控制组无显著差异。对基因型影响的简单效应分析显示,在应激后第10天,经足底电击的雄性+/-小鼠惊吓反射幅值显著高于野生型(=0.010,95% CI=[42.4,283]),其他时间点各处理组之间不同基因型小鼠惊吓反射无显著差异(> 0.05)。上述结果说明,+/-小鼠在电击应激后产生了持续10 天以上的惊吓反射上升表现;基因型对应激引起的惊吓反射幅度上升的影响表现在应激后数天,而非即刻影响。

图2 雄性小鼠在应激前后听觉惊吓反射幅值变化
3.3 Tph2 基因对雌性小鼠应激后听觉惊吓反射的影响
不同于雄性小鼠在应激后出现明显的惊吓反射上升现象,雌性小鼠在天敌或电击应激后均没有明显的惊吓反射变化,不同基因型间无差异,但是应激刺激、基因型与测试时间三者之间存在显著的交互作用,(6.16,166.39)=2.62,=0.018,η=0.027 (图3)。进一步的简单效应分析显示,在应激后10 天,接受天敌应激的雌性+/-小鼠惊吓反射幅值显著高于野生型(=0.021,95% CI=[20.5,207]);其他时间点,各个应激组的不同基因型小鼠之间无显著差异。上述结果说明,雌性小鼠在天敌暴露应激和足底电击应激后早期(应激后1天)没有出现明显的惊吓反射幅度变化,天敌应激后10天+/-小鼠有惊吓反射小幅上升现象。
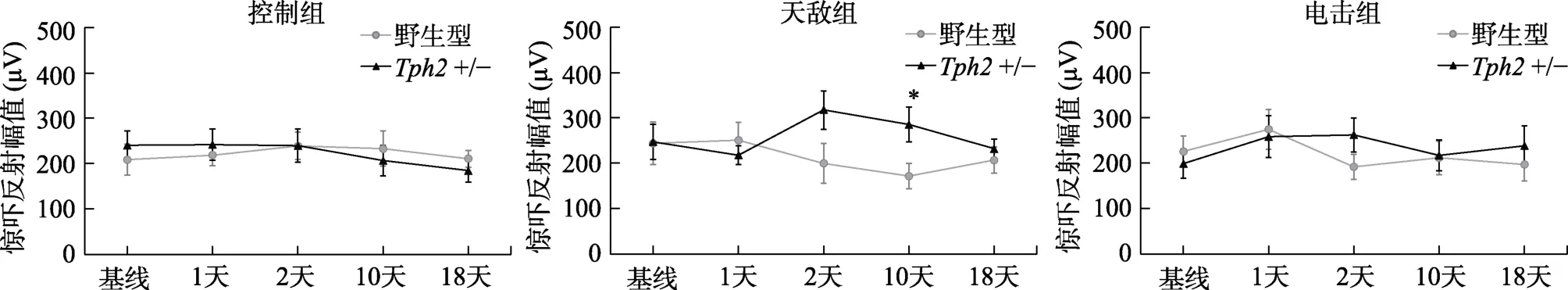
图3 雌性小鼠在应激前后听觉惊吓反射幅值变化
4 讨论
本研究关注5-HT 对创伤应激诱发的高唤醒的影响,通过天敌暴露和足底电击两种创伤应激手段,以听觉惊吓反射作为唤醒水平客观指标,对比了5-HT 合成酶基因缺失小鼠与野生型小鼠在创伤应激后急性与慢性高唤醒反应变化。结果发现,雄性野生型小鼠在创伤应激后出现明显的急性高唤醒表现,随后逐渐恢复,慢性反应不明显,而雄性基因缺失小鼠在创伤应激后不仅有明显的急性高唤醒表现,并且能持续10 天以上,具有一定程度的慢性高唤醒,体现了基因与环境的交互作用;雌性小鼠的惊吓反射幅度明显低于雄性小鼠,野生型小鼠在创伤应激后没有表现出惊吓反射水平波动,雌性基因缺失小鼠在天敌暴露应激后有相对较弱的慢性唤醒上升表现。
对雄性小鼠应激前后多次听觉惊吓反射测量结果显示,+/-小鼠与野生型小鼠的唤醒基线水平没有明显差异,但是在应激后约两周内+/-小鼠唤醒水平持续处于较高状态。这一结果提示,基因缺失导致的较低水平5-HT 可能参与创伤应激后高唤醒状态的保持,说明5-HT 可能具有促进应激反应恢复的作用。有研究显示,功能失调小鼠对社会挫败应激、束缚应激、天敌应激等急性应激表现出更高的易感性(Brivio et al.,2018;Lieb et al.,2019;Russo et al.,2019;Sachs et al.,2015;Weidner et al.,2019),同时也有研究发现基因缺陷小鼠在多个焦虑行为测试中与野生型没有显著差异(Mosienko et al.,2014;Savelieva et al.,2008;Strekalova et al.,2021)。结合本研究中+/-小鼠在应激后才出现唤醒水平持续上升的现象,我们推测基因缺陷引起的5-HT 低水平主要参与强应激后相对缓慢的恢复过程,但是不影响较弱应激刺激引起的即时反应。Tph2 分布在中缝核的5-HT 神经元内,是中枢神经系统内5-HT 合成过程中的重要催化酶,相关的基因缺陷会引起5-HT 合成的效率和总量降低(Abela et al.,2020;Gutknecht et al.,2012;Jacobsen et al.,2012;Liu et al.,2011)。通过光遗传等技术对5-HT神经元进行调控的研究发现,激活中缝核的5-HT神经元会引起焦虑和恐惧行为增强,损毁神经元或阻断下游受体则降低焦虑(da Silva Soares et al.,2019),具体的神经通路是中缝核到基底杏仁核或到背侧海马的5-HT 投射(Abela et al.,2020;Bernabe et al.,2020;Sengupta &Holmes,2019)。上述结果提示,短期内5-HT 释放增加具有增强焦虑、恐惧等应激反应的效果。但是,在我们的研究中,经过基因敲除的小鼠Tph2 一直处于低水平,对5-HT 系统及其下游神经结构的功能有持续影响及代偿效果,因此得到不同于光遗传或药理实验中急性干预5-HT 系统的行为结果。对基因缺陷动物的研究发现,5-HT 系统出现 5-HT 分解速度降低(Mosienko et al.,2014)、5-HT1A 受体功能和表达量改变(Gutknecht et al.,2012;Jacobsen et al.,2012)。因此,基因缺损引起的强应激后持续高唤醒可能不仅与5-HT 合成降低有关,还与5-HT 递质-受体系统的整体平衡失调有关。
本研究结果提示,雄性基因缺陷小鼠在强应激后出现持续时间更长的高唤醒状态。对应激后高唤醒状态与PTSD 其他症状发展的研究发现,高唤醒能够预测其他症状的发生或严重程度(Coronas et al.,2011;Greene et al.,2020;Shaikh al arab et al.,2012),高唤醒可能是驱动PTSD 病程发展的关键因素。另一方面,有研究发现基因的单核苷酸多态性与PTSD 和抑郁症的症状发展、治疗效果有关(Cao et al.,2014;Tao et al.,2018;Xu et al.,2016)。基于本研究结果,我们认为基因缺陷可能通过加剧急性应激后的高唤醒状态增加PTSD 或抑郁症的患病率,同时提示在创伤应激后早期对5-HT系统的干预可能降低PTSD 的发生率。目前选择性5-羟色胺重摄取抑制剂(selective serotonin re-uptake inhibitors,SSRIs)是治疗PTSD 的主要临床药物,尽管治愈率仅为20%~30%,仍然高于其他类型药物(Akiki &Abdallah,2018;Thakur et al.,2021)。目前对 SSRIs 用于创伤后早期干预的报道十分有限(Sijbrandij et al.,2015),创伤后使用SSRIs 能否降低PTSD 的发生率或严重程度仍需要更多临床证据。我们的结果提示,在应激后数日内使用SSRIs,增加可用的5-HT,可能缓解基因缺损造成的中枢神经系统5-HT 不足的个体的高唤醒状态。
本研究采用了天敌暴露和足底电击两种急性应激方式诱发持续的高唤醒反应。结果发现,天敌应激对雄性野生型和+/-小鼠的惊吓反射反应没有造成持续影响,与控制组的差异只在应激后24 小时达到统计显著水平,而较强的足底电击引起雄性+/-小鼠惊吓反射持续处于较高水平。两种应激方式都是当前动物模型中常见的诱发PTSD 样行为的强刺激,均能引起多种PTSD 样行为,且持续时间超过一个月(Cohen et al.,2011;Cohen &Zohar,2004;Smith et al.,2019;Török et al.,2019)。两种应激方式相比,天敌应激是纯粹的心理应激,而电击应激伴随以痛觉为主的伤害性体验,二者受到不同神经环路的调节,诱发的应激反应存在一些差异(Gross &Canteras,2012)。对创伤应激后惊吓反射变化的研究相对较少,其中Cohen 实验室的结果显示,天敌或天敌气味暴露10 分钟能够引起应激后一个月时出现惊吓反射上升。但是,该反应存在明显的个体差异,在雄性大鼠中,惊吓反射明显上升的个体约占40%,而雌性大鼠的比例较低,只有约16% (Koresh et al.,2016)。也有研究发现,天敌应激和电击应激均对惊吓反射幅值没有明显影响(Smith et al.,2019;Zoladz et al.,2019),甚至有降低惊吓反射的效果(Gonzales et al.,2008)。我们的研究中,雄性小鼠在应激后短期出现了明显的惊吓反射上升,而基因缺陷雄性小鼠在电击应激后出现了超过10 天的惊吓反射上升现象。这种现象可能是由于我们选择的小鼠具有更高的基因相似性,个体差异小于Cohen 实验室采用的封闭群大鼠,并且基因缺损导致的5-HT 系统失衡增强了惊吓反射上升的持续时间。
本研究对比了雄性和雌性野生型和+/-小鼠在创伤应激后的惊吓反射反应,发现雌性小鼠的惊吓反射基线水平低于雄性小鼠,且在强应激后早期没有出现幅度变化,仅在应激后10 天经天敌应激的雌性+/-小鼠发现了较弱的惊吓反射上升现象。这一结果说明,应激引起的惊吓反射反应性别差异明显。对人的惊吓反射研究没有发现男性与女性基线反应存在差异(Hubbard et al.,2011;Verona&Kilmer,2007),但是对雌性大鼠惊吓反射的研究发现,雌性动物的惊吓反射幅度低于雄性(Voulo &Parsons,2017),我们的结果认为小鼠也同样有此现象。雌性动物惊吓反射偏低可能与性激素的调节有关,因为有研究显示,卵巢切除的雌性动物惊吓反射有所上升(Zoladz et al.,2019)。我们的结果还发现,雌性小鼠在应激后没有出现雄性小鼠中发现的惊吓反射急性上升现象,这同样与以往研究报道的雌性大鼠应激后的表现相似(Voulo &Parsons,2017,2019)。事实上,女性中PTSD患病率高于男性(Kessler et al.,1995;Kilpatrick et al.,2013),与睡眠相关的高唤醒症状比男性更严重(Kobayashi &Mellman,2012)。性别差异对惊吓反射的影响及其机制可能不同于其他PTSD 症状,目前尚无相关研究证据。本研究结果显示雌性基因缺陷小鼠在天敌应激后10 天相比野生型小鼠有惊吓反射幅度上升,但是相比同组动物应激前的惊吓反射水平并没有明显差异,与未经历应激的控制组转基因雌鼠相比亦无差异。这一结果可能提示,雌性动物脑内较低水平的5-HT 可能引起应激后慢性的唤醒增强。对5-HT 调节慢性应激反应中的性别差异的研究较少,仅有少量研究显示,雌性基因缺陷小鼠在应激后没有明显焦虑反应(Auth et al.,2018),5-HT 转运体相关基因缺陷的雌性小鼠在应激后脑内杏仁核区域脑血流无明显变化,而雄性小鼠该脑区的脑血流受到相关基因的明显调控(Kolter et al.,2021)。
综上所述,本研究结果发现,5HT 合成中关键催化酶基因缺陷的雄性小鼠在创伤应激后高唤醒持续时间更长,体现了基因和环境共同影响PTSD 高唤醒症状的发生、发展,也验证了5-HT 在高唤醒的产生发展中的关键作用,说明5-HT 不足会导致应激后更高的唤醒水平,难以恢复。这一结果为进一步研究PTSD 高唤醒症状以及其5-HT 机制提供了行为遗传模型。
