高效液相色谱-串联质谱法同时测定10种脂溶性贝类毒素
2022-06-05万嘉峻孟凡华代先东范崇旭
万嘉峻, 孟凡华, 代先东, 范崇旭, 曹 瑛*
(国民核生化灾害防护国家重点实验室,北京 102205)
海洋生物贝类毒素特指由海洋生物产生、能够在海洋生物尤其是双壳贝类中富集的一类小分子有毒化学物质[1],可对其他生物包括人类产生危害。这类海洋生物贝类毒素根据其溶解性可分为水溶性贝类毒素和脂溶性贝类毒素,其中脂溶性贝类毒素主要为含聚醚结构的化合物,具有一定的热稳定性,易溶于甲醇、乙醚等有机溶剂[2]。目前,常见的脂溶性贝类毒素主要有大田软海绵酸毒素(Okadaic Acid,OA),以及其衍生物鳍藻毒素(Dinophysistoxin,DTX)组、虾夷扇贝毒素(Yessotoxin,YTX)组、原多甲藻酸毒素(Azaspiracid,AZA)组、蛤毒素(Pectenotoxin,PTX)组、环亚胺毒素(Cyclic Imine,CI)组[3],结构如图1所示。贝类毒素易通过食物链传递并累积在滤食性的双壳类软体动物中,消除半衰期长达数十天甚至数月,给消费者带来潜在危害[4]。美国对OA组和AZA组毒素的安全限量为160 μg/kg[5],欧盟在此基础上还设置了PTX组和YTX组的安全限量,分别为160 μg/kg(PTX)和3 750 μg/kg(YTX)[6]。我国对贝类毒素在食品中安全限量的相关研究起步较晚,目前国家标准以毒性为计量单位,将OA组毒素安全限量设定为0.05 MU/g[7]。

图1 常见脂溶性贝类毒素的基本结构Fig.1 The basic structure of common lipophilic shellfish toxin
目前脂溶性贝类毒素分析方法主要有小鼠毒性分析法、细胞毒性分析法、免疫分析法、高效液相色谱法和高效液相色谱-串联质谱(HPLC-MS/MS)法[8]。其中,HPLC-MS/MS法在贝类毒素分析中具有灵敏度高、特异性强、分析时间短、能够准确定量不同毒素组分等特点[9],被各国推荐用作脂溶性贝类毒素检测的标准方法。2015年,欧盟制定了HPLC-MS/MS法测定软体动物中脂溶性贝类毒素的统一标准操作程序[10],我国规定HPLC-MS/MS法为测定贝类中腹泻性贝类毒素的标准方法[11]。近年来,随着新材料与新方法的引入,对脂溶性贝类毒素分析检测方法的研究越来越多,检测方法也在不断完善[12 - 15]。
HPLC-MS/MS法在分析脂溶性贝类毒素时具有灵敏度高、检出限低、重复性好和检测速度快等特点,但贝类基质严重影响目标物的质谱响应,导致样品预处理流程复杂、耗时长,使得该方法在应用中受到一定限制。本研究采用甲醇提取,利用正己烷液-液萃取除油脂,结合固相萃取柱富集净化,建立了HPLC-MS/MS同时检测贝类中10种脂溶性贝类毒素的方法。10种脂溶性贝类毒素包括OA组的OA、DTX1、DTX2,YTX组的YTX、hYTX,AZA组的AZA1、AZA2、AZA3,CI组的米氏裸甲藻毒素(Gymnodimine,GYM)以及PTX组的PTX2,涵盖了目前海产品中常见的脂溶性贝类毒素。该方法前处理后的溶液更加澄清,减少了对液相色谱和质谱仪的污染,降低了基质干扰,提高了目标物的质谱响应。
1 实验部分
1.1 仪器及试剂
Agilent 1260-6400Triple Quad高效液相色谱-质谱仪(美国,Agilent公司);12位固相萃取装置(美国,Agilent公司);RVC 2-18 CD plus真空离心浓缩仪(德国,Christ公司);Lab Dancer旋涡混合器(德国,IKA公司);Sigma 3-16PK高速离心机(德国,Sigma公司);Oasis HLB固相萃取小柱(60 mg/3mL,美国Waters公司)、Strata-X固相萃取小柱(30 mg/3mL,美国Phenomenex公司)、Bond Elut-C18固相萃取小柱(200 mg/3mL,美国Agilent公司)。
脂溶性贝类毒素标准品:AZA1(1.30±0.07 μg/mL)、AZA2(1.22±0.06 μg/mL)、AZA3(1.18±0.05 μg/mL)、PTX2(4.40±0.13 μg/mL)、GYM(2.50±0.13 μg/mL)、YTX(5.10±0.24 μg/mL)、hYTX(5.75±0.31 μg/mL)、OA(8.40±0.4 μg/mL)、DTX1(7.80±0.5 μg/mL)、DTX2(3.80±0.2 μg/mL),均购自加拿大海洋生物科学研究所;甲酸、甲酸铵(质谱纯,德国CNW公司);甲醇、乙腈(色谱纯,美国Sigma公司);氨水、正己烷(分析纯,上海麦克林生化科技有限公司)。实验用水均来自Milli-Q超纯水系统(美国Millipore公司)。
实验所用贝类样品购买于海产品市场。
1.2 实验方法
1.2.1 样品前处理用清水冲洗新鲜贻贝外壳,去除杂质,切开闭壳肌,取出全部软体组织并用超纯水冲洗,去除泥沙后,沥干水分并充分均质。称取样品1.0±0.05 g于50 mL离心管中,加入4.5 mL甲醇,涡旋振荡2 min,10 000 g离心10 min,转移上清液至50 mL离心管中;向沉淀中加入4.5 mL甲醇,重复提取1次,合并两次上清液,加超纯水定容至15 mL并混匀,加入15 mL正己烷,涡旋振荡2 min,静置待其分层,移除正己烷层,再加入15 mL正己烷,重复除油一次,用超纯水定容至35 mL。
固相萃取(SPE)柱依次用3 mL甲醇、3 mL 25%甲醇水溶液进行活化,将提取液缓慢上样后,用3 mL 25%甲醇水溶液淋洗,6 mL 1%氨水-甲醇洗脱,合并洗脱液,真空离心浓缩至干,1 mL 30%乙腈水溶液充分溶解,10 000 g离心10 min,取上清液进行HPLC-MS/MS检测。
1.2.2 高效液相色谱条件Kinetex XB-C18色谱柱(50 mm×2.1 mm,2.6 μm);流动相A为水,B为95%乙腈水溶液,均含0.1%甲酸和10.0 mmol/L甲酸铵。正离子模式梯度下洗脱程序:0~3.0 min,30%~90%B;3.0~9.0 min,90%B;9.0~11.0 min,90%~30%B,11.0~16.0 min,30%B;负离子模式下梯度洗脱程序:0~1.0 min,40%~50%B;1.0~8.0 min,50%~70%B,8.0~10.0 min,70%B,10.0~12.0 min,70%~40%B,12.0~16.0 min,40%B。进样体积10.0 μL;柱温30.0 ℃;流速0.200 mL/min。
1.2.3 质谱条件电喷雾电离(ESI)源;正负离子模式扫描;多反应监测模式(MRM)检测;毛细管电压4.0 kV;干燥气温度350 ℃;干燥气流量:10 L/min;雾化气压力:103.42 kPa;分辨率:单位分辨。
2 结果与讨论
2.1 质谱条件优化
AZA1、AZA2、AZA3、PTX2、GYM采用正离子模式;OA、DTX1、DTX2、YTX、hYTX采用负离子模式。使用200 μg/L毒素标准溶液对质谱条件进行优化,分别在正、负离子模式下进行全扫描,得到目标化合物的分子离子峰,将其作为母离子,以目标物响应为参数优化碎裂电压(Fragmentor)。对选取母离子进行二级质谱分析,以丰度高的两个碎片离子分别作为定性与定量分析的特征离子对,再以确定的母离子和子离子进行MRM扫描,优化碰撞能。10种毒素经优化后的质谱条件如表1所示。

表1 10种脂溶性贝类毒素的质谱多重反应监测仪器条件
2.2 色谱条件优化
文献报道的脂溶性贝类毒素的HPLC-MS/MS检测,流动相多采用含甲酸-甲酸铵的水-乙腈体系或含氨水的水-乙腈体系。比较两种流动相的检测结果发现,含氨水的水-乙腈体系的流动相用于正离子模式时,会导致离子峰强度显著降低;含0.1%甲酸-10.0 mmol/L甲酸铵的水-乙腈溶液作为流动相时,10种目标物均出峰,且峰形良好。在选定的10种脂溶性贝类毒素中,OA与DTX2的特征离子对完全相同,需要完全分离才能实现两者的定性与定量分析。本研究通过调整流动相比例,实现了OA和DTX2的完全分离。另外,YTX和hYTX的保留时间相近,可以通过质谱靶向检测实现对两者的定量分析。
10种脂溶性贝类毒素在优化后的色谱条件下的色谱图见图2。

图2 10种脂溶性贝类毒素定量离子MRM色谱图(a.正离子模式下提取离子流图;b.负离子模式下提取离子流图)Fig.2 Quantitative ion MRM chromatogram of 10 lipophilic shellfish toxins(a.Extracting ion chromatogram in positive ionization;b.Extraction ion chromatogram in negative ionization)
2.3 除油条件优化
甲醇提取脂溶性贝类毒素的过程中,大量脂质、色素和蛋白质等杂质同时进入提取液,一些低极性的杂质在后续SPE净化过程中严重影响SPE效率。因此,本研究引入正己烷液-液萃取过程,在样品进行SPE前,预先去除提取液中的低极性杂质,以提高SPE效率。本研究均以AZA1(1.30 μg/kg)为代表优化除油条件,然后将优化后的条件应用到其他毒素检测中,均有较好的回收率。首先,为提高目标物的回收率,将甲醇提取液用水稀释至100%、80%、60%后再进行液-液萃取净化。结果表明,随着甲醇浓度的降低,脂溶性贝类毒素回收率呈增加趋势(图3a),60%甲醇水溶液得到AZA1的平均回收率达90.8%。然后,考察萃取次数对脂溶性贝类毒素回收率的影响,结果表明两次萃取后即可得到较高的回收率,增加萃取次数不能明显提高回收率(图3b),反而会因为操作的增多导致目标物流失。

图3 (a)提取液甲醇浓度对回收率的影响;(b)正己烷萃取次数对回收率的影响Fig.3 (a)Effect of methanol concentration of extraction on recovery;(b)Effect of extraction times of n -hexane on recovery
2.4 SPE富集净化条件的优化
本研究选择常见的三种SPE柱,其填料分别为C18、HLB、Strata-X,比较它们的富集净化效果,结果如图4所示。实验结果表明,HLB柱对10种脂溶性贝类毒素的平均回收率均高于C18、Strata-X柱,且经过HLB柱处理后的溶液更清澈透明。因此,本实验最终采用Oasis HLB SPE柱进行富集净化。本研究所采用的SPE柱易得、便宜、操作方便,且富集净化效果与特殊填料SPE柱相近[16]。

图4 不同固相萃取柱对回收率的影响Fig.4 Effect of different solid phase extraction cartridges on recovery
本研究以AZA1(1.30 μg/kg)为代表对SPE过程中的上样、淋洗进行优化。实验通过调整上样体系中甲醇含量,直接进行SPE净化的方法(即SPE大体积上样),既保证了目标物的有效富集,又节省了上样前的浓缩时间,兼顾了操作的连续性与稳定性,降低了操作要求。最终确定的最佳上样条件为25%甲醇,淋洗条件为3 mL 25%甲醇。根据文献报道[17],洗脱液酸碱性会影响洗脱效果。本实验通过添加1%甲酸或1%氨水改变洗脱液酸碱性,比较不同酸碱条件下的回收率。结果表明,10种脂溶性贝类毒素在使用碱性洗脱液时的回收率明显高于酸性洗脱液(图5)。因此,本研究选择1%氨水甲醇溶液作为洗脱条件。

图5 SPE洗脱液酸碱性对脂溶性贝毒回收率的影响Fig.5 Effect of acidity and alkalinity of SPE eluent on the recovery of lipophilic shellfish toxins
2.5 方法学考察
2.5.1 基质效应本研究以目标物在基质与溶剂中的响应比考察方法的基质效应。图6是贻贝样品中,经本方法净化处理和参考欧盟方法[10]处理后(即无正己烷萃取和SPE净化)的基质效应比较。结果表明未经过净化处理的贻贝样品对OA组的3种毒素产生了轻微的抑制效应,对其余7种毒素产生了严重的抑制效应;经过本方法净化处理后,抑制效应得到改善,显著降低了基质对目标物质谱响应的干扰,提高了方法的灵敏度。
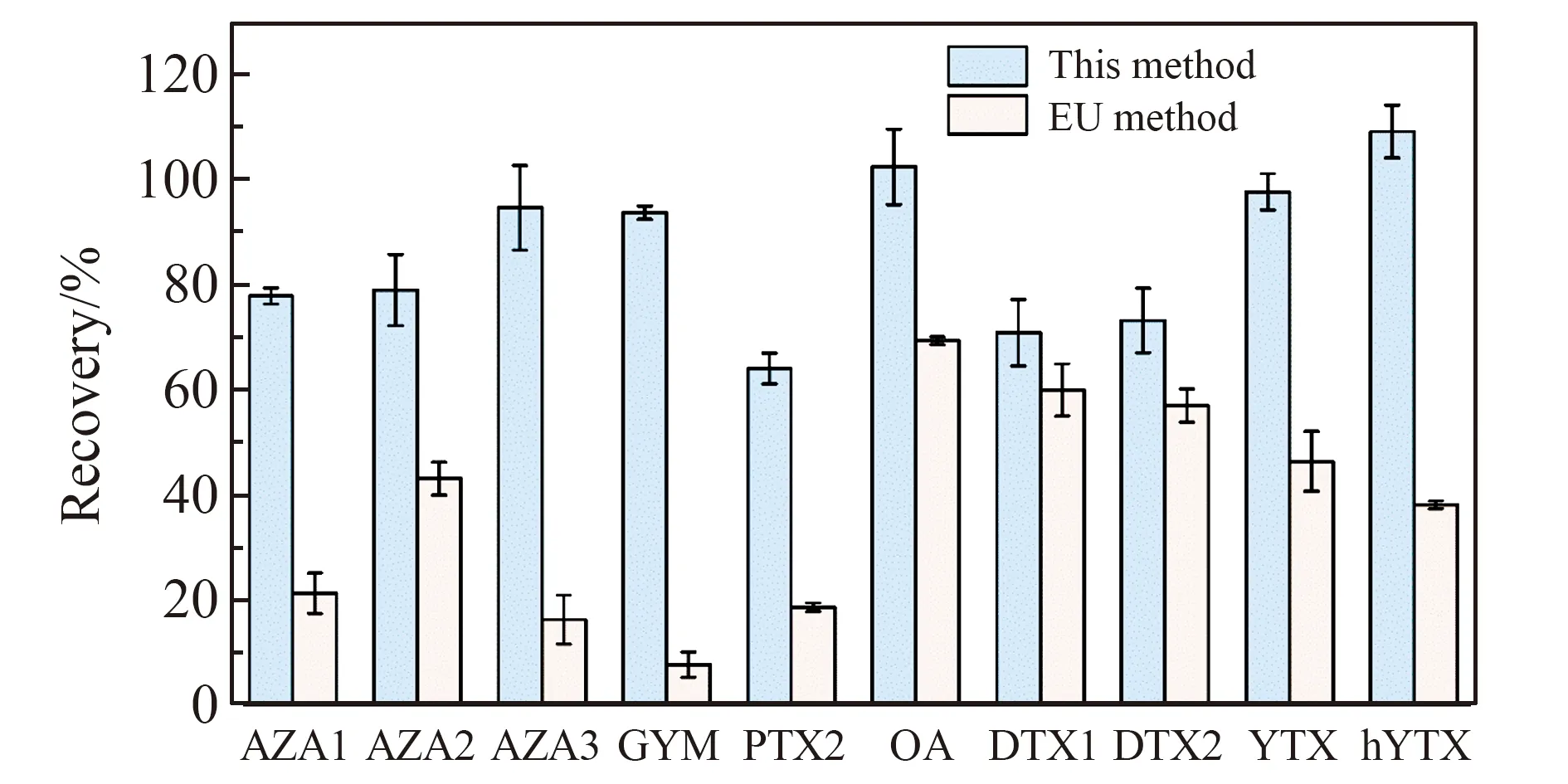
图6 正己烷除油和SPE对基质效应的影响Fig.6 Matrix effect after SPE and n-hexane extraction
2.5.2 线性范围与检测限按“1.2.1”处理空白贻贝样品,得到空白基质。添加各脂溶性贝类毒素标准溶液,配制各脂溶性贝类毒素的工作溶液,以峰面积为纵坐标,脂溶性贝类毒素添加浓度为横坐标绘制标准曲线。10种脂溶性贝类毒素的线性范围、线性方程、相关系数(R2)见表2。结果表明,10种分析物在相应的质量浓度范围内线性相关系数R2均大于0.996,线性良好,满足仪器分析的需要。方法的检出限(LOD)和定量限(LOQ)分别以3倍信噪比和10倍信噪比计算,结果见表2。

表2 脂溶性贝类毒素的线性关系、检测限(LOD)与定量限(LOQ)
其中YTX和hYTX的LOD、LOQ略高于其他脂溶性贝毒。分析原因:一是YTX组毒素含有磺酸基,与其他脂溶性贝类毒素结构上差异较大,因此所使用的通用前处理条件对YTX和hYTX的回收率偏低;二是YTX和hYTX保留时间一致,离子化过程存在竞争,效率偏低。两个因素可能会导致YTX系列的检出限较高,但该方法的定量限远小于欧盟制定的限量标准(3 750 μg/kg),因此使用本研究中的通用前处理条件能够满足脂溶性贝类毒素的检测要求。
2.5.3 回收率及精密度以1.00 g贻贝样品为空白基质,添加低、中、高三种不同浓度的脂溶性贝类毒素标准溶液作为质量控制样品,每个质量控制样品平行实验6次,计算各分析物对应的平均回收率和精密度,如表3所示。10种分析物的平均回收率为77.54%~116.9%;相对标准偏差(RSD)为1.07%~12.3%。

表3 10种脂溶性贝类毒素的平均回收率和相对标准偏差(RSD)(n=6)

(续表3)
2.5.4 实际样品分析为考察方法的适应性和实用性,采用本方法对市场上购买的6种贝类(贻贝、文蛤、青蛤、缢蛏、花蛤和扇贝)进行分析检测。结果显示OA组、YTX组和PTX2在所有样品中均未检出,但是在4个样品(花蛤、青蛤、文蛤和扇贝)中检出了GYM(0.461~1.610 μg/kg),在花蛤样品中检出了AZA1(0.400 μg/kg)。阳性贝类样品检测结果如图7所示,均低于脂溶性贝类毒素安全限量。

图7 阳性贝类样品色谱图Fig.7 Chromatograms of positive shellfish sample
3 结论
采用甲醇提取,正己烷除油脂,HLB固相萃取柱富集净化,使用HPLC-MS/MS法检测,建立了贝类样品中10种脂溶性贝类毒素的同时定量分析方法。该方法回收率高、检出限低、线性良好,能够实现目标物的痕量检测。将该方法应用于6种实际贝类样品的检测,部分样品呈阳性,含量均低于毒素安全限量。该方法为海产品安全的检测方法提供参考。
