平足蛋白表达与OSCC患者临床特征的关系及其对CAL-27细胞株增殖和迁移的作用机制
2022-06-04金城
金城
(北京积水潭医院 口腔科, 北京 100000)
平足蛋白(podoplanin)为一种跨膜唾液酸黏蛋白样糖蛋白,在肿瘤细胞中表达上升,被认为与多种恶性肿瘤关系密切,主要参与肿瘤的侵袭及转移等生物学功能[1-3]。口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)是头颈部最常见的恶性肿瘤之一[4]。有研究显示Podoplanin高表达于低分化的OSCC中,表达水平与肿瘤侵袭能力相关[5];Alvarez等[6]研究表明在OSCC细胞中,Podoplanin的单克隆抗体及外源凝集素可抑制Podoplanin的表达,进而破坏线粒体膜的通透性,诱导细胞凋亡,提示Podoplanin可参与OSCC的侵袭及凋亡。因此,Podoplanin的表达是否与OSCC相关、能否成为预后标志物,是值得关注的研究方向;除细胞凋亡外,Podoplanin的表达是否影响OSCC细胞增殖及侵袭转移,进而影响OSCC的进展及预后,也是值得探讨的方向。有鉴于此,本研究先选取76例OSCC患者,探讨Podoplanin与其临床特征及预后的关系;再选取人OSCC CAL-27细胞株探讨Podoplanin在OSCC中的具体作用机制,现将结果汇报如下。
1 材料与方法
1.1 实验材料
1.1.1细胞及组织来源 人OSCC CAL-27细胞株购自上海生命科学研究院细胞资源中心,同时收集2017年1月—2018年7月OSCC手术患者的组织病理标本蜡块,入选标准为首次确诊的、未接受过放化疗的OSCC患者,预计生存期>12周,患者均充分知情且签署知情同意书;共纳入OSCC患者76例,男45例、女31例,年龄42~79岁、平均(57.36±8.67)岁,组织分化程度高、低各有50、26例,肿瘤分期(tumor,lymphnode and metastasis stage,TNM)为T1、T2、T3及T4期分别有19、24、20及13例,临床分期Ⅰ、Ⅱ、Ⅲ期分别有29、20、及27例,有淋巴结转移40例、无转移26例。患者术后均电话或门诊做生存期随访,每半年1次。
1.1.2主要试剂与仪器 噻唑蓝染料(美国Sigma),Podoplanin抗体、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)抗体、磷酸化磷脂酰肌醇3-激酶(phospho-phosphatidylinositol 3-kinase,p-PI3K)抗体、蛋白激酶B(protein kinase B,AKT)抗体及磷酸化AKT(phospho-AKT,p-AKT)抗体(美国Cell Signaling Technology),Podoplanin及β-actin引物(上海生工生物工程),聚合酶链式反应(polymerase chain reaction,PCR)试剂盒(日本Takara),Trizol及 Lipofectamine3000试剂盒(美国Invitrogen),逆转录试剂盒(立陶宛Fermentas),其余试剂(上海碧云天生物);细胞培养箱(美国赛默飞世尔),实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)仪(立陶宛 Fermentas),倒置荧光显微镜(日本Olympus)。
1.2 实验方法
1.2.1人体口腔癌标本免疫组织化学染色 收集的标本固定于10%福尔马林,石蜡包埋后切片机4 μm切片,梯度乙醇洗脱,石蜡包埋,60 ℃烤片;切片室温封闭、柠檬酸组织抗原缓冲液中染色、磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,过氧化物酶阻断剂孵育、再次冲洗、加一抗4 ℃孵育过夜、清洗,加鼠单克隆二抗、孵育冲洗;使用二氨基联苯胺显色,冲洗后苏木精复染,脱水固定并封片;显微镜下选择5个不同区域观察Podoplanin染色阳性细胞数量,阳性细胞的比例≤20%时计0分、>20%时计1分,同时染色无着色、淡黄色、棕黄色及以上分别计0、1及2分,2项得分合计≤1分即为低表达组,>1分为高表达组。
1.2.2细胞沉默及过表达模型构建 为获得Podoplanin 沉默及过表达的CAL-27细胞模型,首先将CAL27细胞放入含10%胎牛血清的完全培养基,置于37 ℃、5%CO2培养箱中培养,取对数期CAL27细胞接种至6孔板中,待细胞贴壁后,使用OPTI-MEM用于稀释Lipofectamine 3000,混匀、静止孵育8 min,分别设置4个不同转染的质量浓度(1 ∶0.02、1 ∶0.04、1 ∶0.06及1 ∶0.08),转染后利用荧光倒置显微镜查看荧光情况,确定1 ∶0.06为最合适转染质量浓度。Podoplanin沉默组模型构建:设置空白组、空白沉默组及沉默组,空白组细胞不做任何处理;空白沉默组细胞清洗之后加OPTI-MEM 2 mL,与1 ∶0.06的OPTI-MEM-Lipofectamine 3000混合物、避光培养6 h,清洗细胞,加无抗细胞培养液3 mL/孔、继续培养24 h,收集细胞;沉默组细胞清洗之后加入合成的Podoplanin si-RNA与1 ∶0.06的OPTI-MEM-Lipofectamine 3000混合物、避光培养6 h,清洗细胞,加无抗细胞培养液3 mL/孔、继续培养24 h,收集细胞。Podoplanin过表达组模型构建:设置空白组、空白过表达组及过表达组,空白组细胞不做任何处理;空白过表达组细胞清洗后加 OPTI-MEM 2 mL,与1 ∶0.06的OPTI-MEM-Lipofectamine 3000混合物、避光培养6 h,清洗细胞,加无抗细胞培养液3 mL/孔、继续培养24 h,收集细胞;过表达组细胞清洗之后,加入合成的Podoplanin 质粒与1 ∶0.06的OPTI-MEM-Lipofectamine 3000混合物、避光培养6 h,清洗细胞,加无抗细胞培养液3 mL/孔、继续培养24 h,收集细胞。
1.2.3细胞沉默及过表达模型验证 取1.2.2项下的空白组、空白沉默组(空白过表达组)及沉默组(过表达组)细胞,使用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction ,qPCR)及Western blot验证沉默及过表达效果。(1)qPCR方法:收集细胞之后,使用Trizol试剂盒提取细胞总核糖核酸(ribonucleic acid,RNA),保证提取的总RNA的纯度;qPCR总反应体系为10 μL,其中Syber GreenⅠ 5 μL、上下游引物各0.6 μL、互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA) 0.5 μL、 ddH2O 3.9 μL;扩增条件为94 ℃ 5 min,94 ℃ 30 s、54 ℃ 40 s、72 ℃ 40 s、72 ℃ 10 min,共40个循环;Podoplanin上游序列为5′- TGACTCCAGGAACCAGCGAAG -3′,下游序列为5′- GCGAATGCCTGTTACACT -3′; β-actin上游序列为5′-ATAGCACAGCCTGGATAGCAACGTAC-3′,下游序列为5′-CACCTTCTACAATGAGCTGCGTGTG-3′。(2)Western blot方法:收集各组细胞用于提取总蛋白,100 ℃煮沸10 min,冷冻保存; Western blot时配制10%十二烷基硫酸钠聚丙烯酰胺凝胶,待胶凝固,拔出上样梳,上样细胞蛋白20 μL/孔,设置80 V、30 min及120 V、2 h跑胶;据Marker指示及Podoplanin等目标蛋白分子量切胶,转至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜,稍清洗之后脱脂牛奶封闭4 h;清洗PVDF膜,分别加Podoplanin及β-actin抗体,4 ℃孵育过夜;次日取膜清洗,加二抗,孵育1 h,洗膜后显影,观察显影条带,使用Image J软件测量条带灰度值。验证成功后,分别选取上述沉默组及过表达组用于后续实验。
1.2.43-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐比色法[3-(4,5-Dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]法检测细胞增殖 取对数期生长的CAL-27细胞接种至96孔板,设置对照组,并按照1.2.2项下沉默组及过表达组中获得的细胞分别为沉默组及过表达组,将细胞置于细胞培养箱中分别培养12、24及48 h;弃培养液,清洗细胞,每孔加配制好的5 g/L MTT溶液20 μL,细胞培养箱中孵育4 h,弃上清;加二甲基亚砜150 μL/孔,上酶联免疫检测仪测定各孔的光密度(optical density,OD)值。
1.2.5细胞集落形成实验 取对数期生长的CAL-27细胞接种至6孔板,设置对照组,取1.2.2项下沉默组及过表达组获得的细胞分别为沉默组及过表达组,培养48 h后细胞集落形成后即停止培养;磷酸缓冲盐溶液(phosphate buffer salt, PBS)冲洗,结晶紫染色,再次PBS冲洗,拍照记录。
1.2.6细胞迁移能力测定 取对数期生长的CAL-27胞接种至24孔板,接种密度为4×104个/孔,设置对照组,将1.2.2项下沉默组及过表达组中获得的细胞为沉默组及过表达组,各组细胞于Matrige l4 ℃冰箱融化过夜,1 ∶6与无血清培养液混合,transwell 板上室加混合液30 μL,置于细胞培养箱中使其形成胶状物质,将细胞消化制成单细胞悬液,于Transwell上室加细胞悬液100 μL和无血清培养基300 μL,置于细胞培养箱培养24 h;干棉签擦去上层细胞,将聚碳酯膜下表面的细胞用10%甲醛溶液固定,结晶紫染液, PBS清洗、干燥,拍照,计数。
1.2.7PI3K/AKT信号通路蛋白的表达 收集对照组、沉默组及过表达组细胞用于提取总蛋白,100 ℃煮沸10 min,冷冻保存;配制10%十二烷基硫酸钠聚丙烯酰胺凝胶,待胶凝固,拔出上样梳,上样细胞蛋白20 μL/孔,设置80 V、30 min及120 V、2 h跑胶;据Marker指示及目标蛋白分子量切胶,转至PVDF膜,稍清洗之后脱脂牛奶封闭4 h;清洗PVDF膜,分别加一抗及β-actin抗体,4 ℃孵育过夜;次日取膜清洗,加二抗,孵育1 h,洗膜后显影,观察显影条带,使用Image J软件测量条带灰度值。
1.2.8临床及随访资料收集 从患者住院病历及检查报告中收集年龄、性别等基本信息及TNM分期、淋巴结转移情况、分化程度等信息;患者术后均电话或门诊做生存期随访,每半年1次,随访截止时间为2020年12月31日,患者从明确诊断为OSCC至患者死亡或随访终止的时间定为总生存期(overall survival, OS)。
1.3 统计学分析
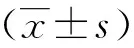
2 结果
2.1 OSCC患者Podoplanin的表达
免疫组织化学染色结果显示,低分化OSCC患者口腔癌组织Podoplanin染色阳性细胞数量多于于高分化患者。见图1。

高分化 低分化图1 不同分化程度OSCC患者的Podoplanin表达(免疫组织化学,×100)Fig.1 Podoplanin expression in OSCC patients with different degrees of differentiation (immunohistochemistry,×100)
2.2 OSCC患者Podoplanin表达与临床特征、预后的关系
低分化及淋巴结转移OSCC患者的Podoplanin高表达率高于高分化及无淋巴结转移的患者,差异有统计学意义(P<0.05);与低表达组相比,Podoplanin高表达组OSCC患者的OS降低,差异有统计学意义(P<0.05)。见表1和图2。
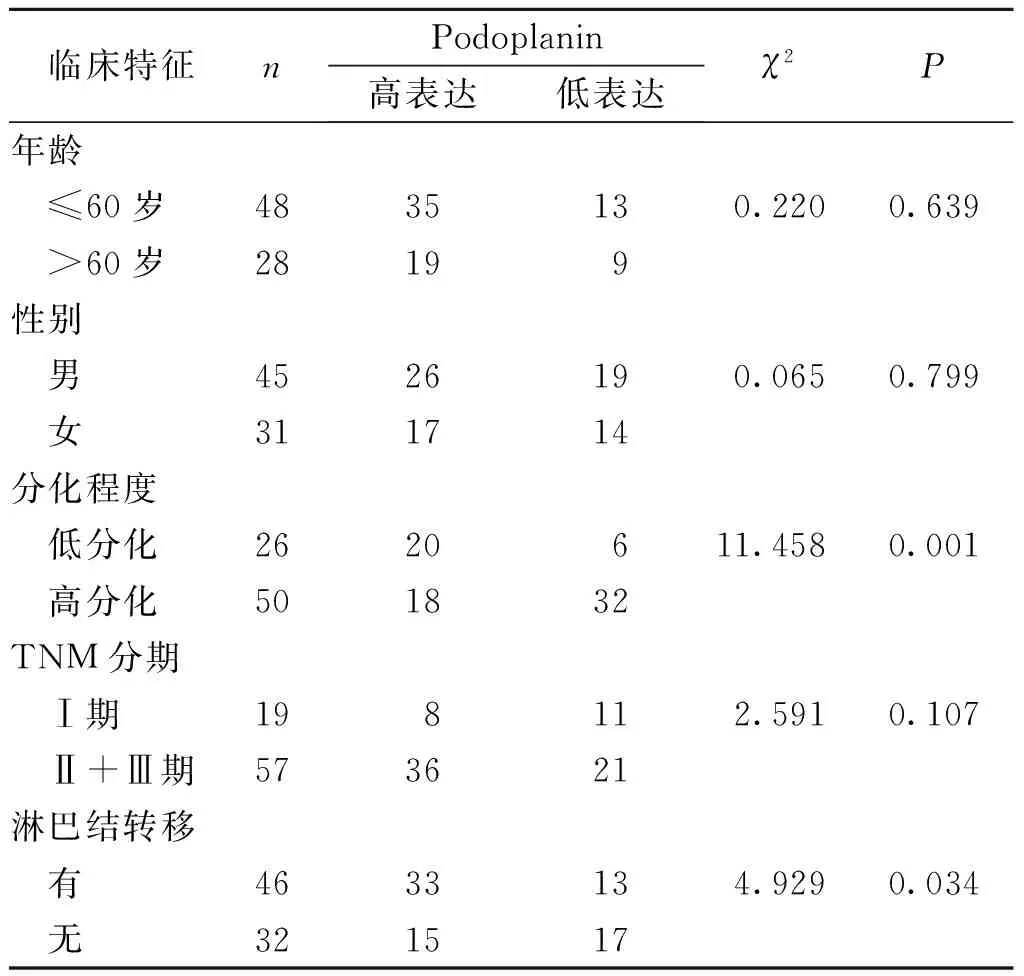
表1 Podoplanin表达水平与OSCC 患者临床特征的相关性Tab.1 Correlation between Podoplanin expression and clinicopathological features of OSCC patients
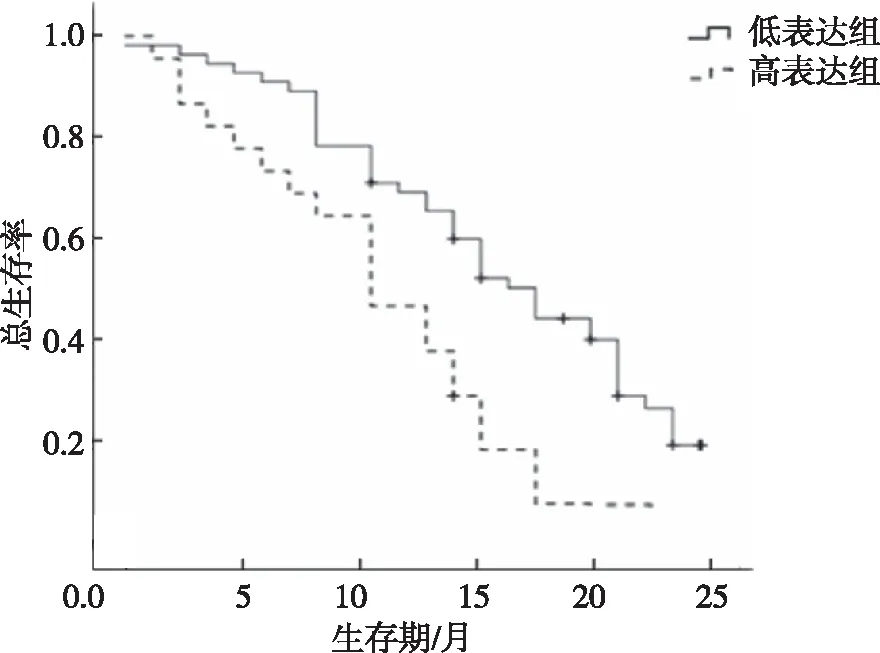
图2 OSCC患者Podoplanin表达与预后的关系Fig.2 Relationship between Podoplanin expression and OS of OSCC patients
2.3 CAL27细胞中沉默或过表达Podoplanin模型验证
Werstern blot及qRT-PCR测定结果显示,与空白组相比,沉默组CAL-27细胞中Podoplanin的蛋白及mRNA表达下降(P<0.05),过表达组CAL-27细胞中Podoplanin的蛋白及mRNA表达升高(P<0.05),但空白沉默组及空白过表达组CAL-27细胞中Podoplanin蛋白及mRNA比较,差异无统计学意义(P>0.05)。见图3。
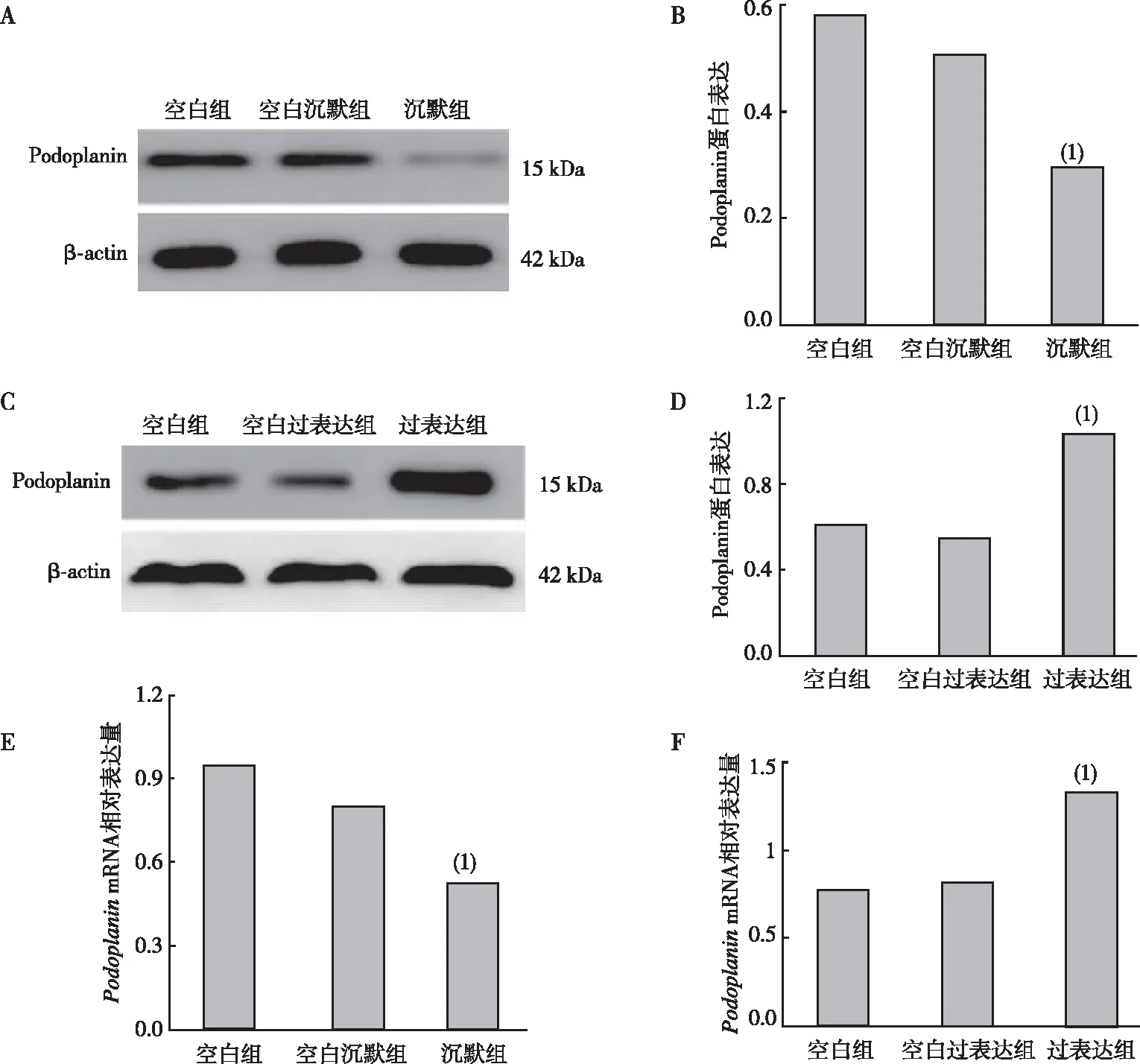
注:A、B为空白组、空白沉默组及沉默组CAL27细胞中Podoplanin蛋白表达及其定量结果,C、D为空白组、空白过表达组及过表达组细胞中Podoplanin蛋白表达及其定量结果,E、F为Podoplanin mRNA相对表达量;(1)与空白组比较,P<0.05。图3 各组CAL-27细胞中Podoplanin蛋白和mRNA表达Fig.3 Podoplanin protein and mRNA expression levels in CAL-27 cells of each group
2.4 细胞增殖、集落形成及细胞周期
与对照组相比,Podoplanin过表达组CAL-27细胞24 h时细胞增殖明显,48 h时沉默组细胞增殖及集落形成能力降低,过表达组细胞增殖及集落形成能力增加,差异均有统计学意义(P<0.05);细胞周期结果表明,与对照组相比,Podoplanin沉默组CAL-27细胞G1/S比值升高,过表达组G1/S比值降低,差异均有统计学意义(P<0.05)。见图4。
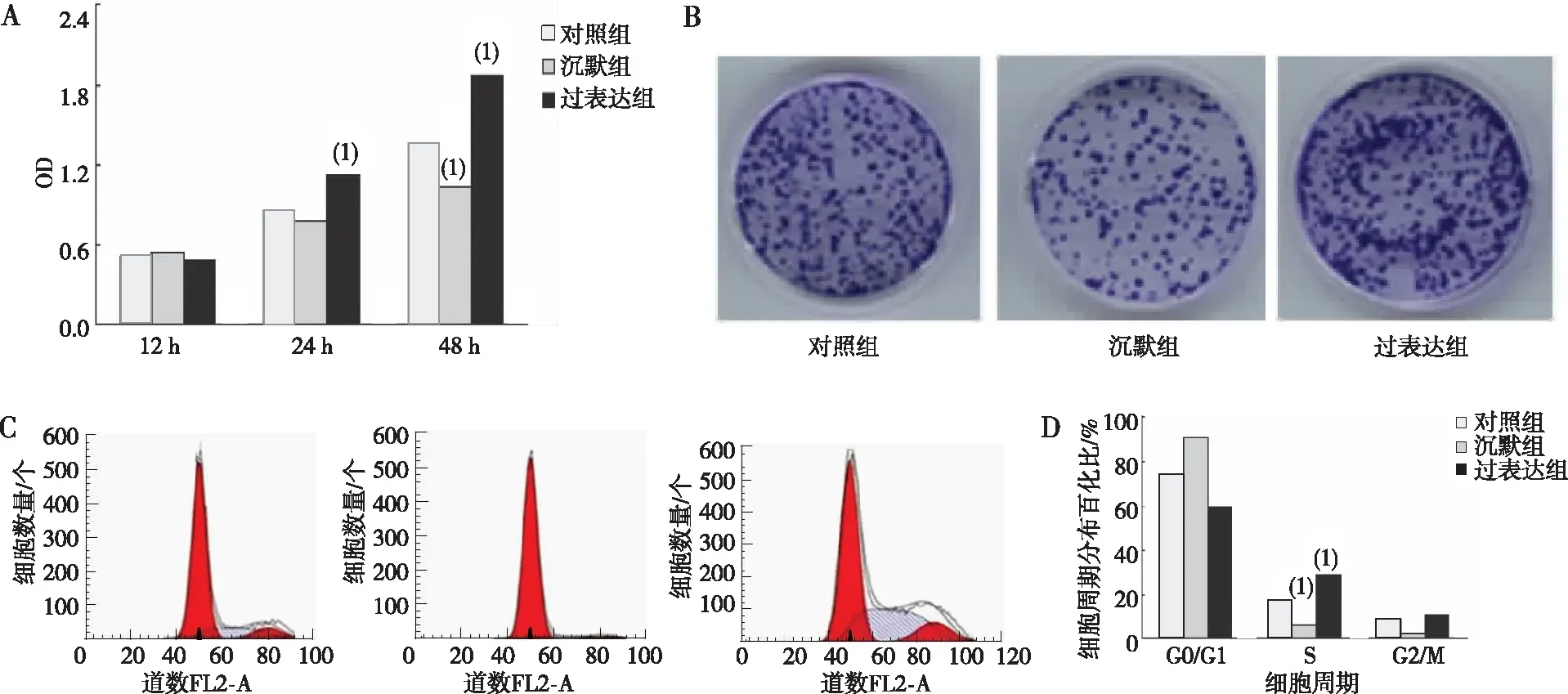
注:A为12、24及48 h时各组细胞增殖能力,B为各组细胞48 h集落形成能力(结晶紫染色,×100),C为各组细胞周期变化,D为细胞周期分布;(1)与对照组比较,P<0.05。图4 各组CAL-27细胞的增殖、集落形成及细胞周期Fig.4 Proliferation, colony formation, and cell cycle of CAL-27 cells in each group
2.5 细胞迁移能力
Transwell实验表明,与对照组相比,Podoplanin沉默组CAL-27细胞迁移能力降低、过表达组CAL-27细胞迁移能力升高,差异均有统计学意义(P<0.05)。见图5。
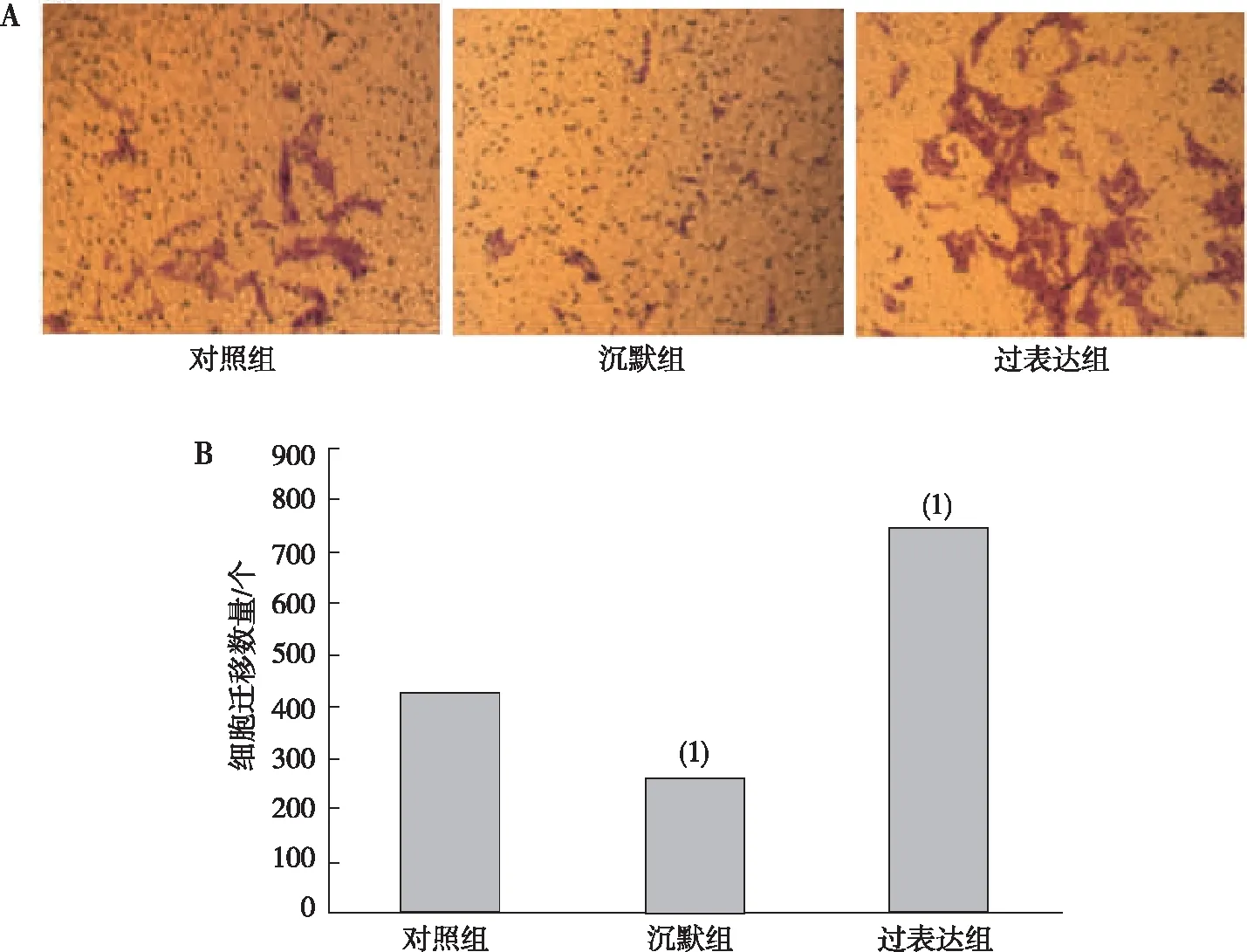
注:A为细胞迁移的结晶紫染色结果(100×),B为细胞迁移能力的定量结果;(1)与对照组比较,P<0.05。图5 各组CAL-27细胞的迁移能力Fig.5 Migration ability of CAL-27 cells in each group
2.6 PI3K/AKT信号通路相关蛋白表达
与对照组相比,Podoplanin沉默组CAL-27细胞中p-AKT/AKT和p-PI3K/P13K比值降低,过表达组p-AKT/AKT及p-PI3K/P13K比值升高,差异均有统计学意义(P<0.05)。见图6。
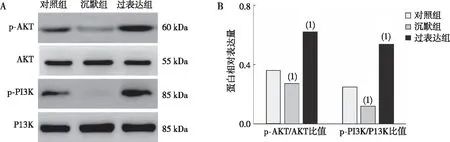
注:A为蛋白表达,B为蛋白表达的定量结果;(1)与对照组比较,P<0.05。图6 各组CAL-27细胞中PI3K/AKT信号通路相关蛋白的表达Fig.6 Expression of PI3K/AKT signaling pathway related proteins in CAL-27 cells in each group
3 讨论
在肿瘤发展初期,血管生成的同时,淋巴管也参与其中,两者共同参与肿瘤侵袭转移[7-8]。Podoplanin作为淋巴管生成的重要组成部分,在侵袭性强的肿瘤中其预后预测价值也逐渐显现[9]。Podoplanin在多种肿瘤中表达升高[10-12]。在恶性肿瘤的生物学功能中,Podoplanin调控的生长增殖与迁徙转移机制已被证实[13]。在OSCC中,Podoplanin与肿瘤细胞自分泌的热休克蛋白A9相互作用,参与细胞的增殖与侵袭[14];Podoplanin还可促进上皮间质转化的发生,促进肿瘤细胞的转移[15];在乳腺癌中,Podoplanin的表达可增强恶性肿瘤细胞活性,与不良预后密切相关[16];另外,Podoplanin可促进血小板聚集及肿瘤血栓形成,进而促进肿瘤的血液转移[17]。
本研究OSCC患者免疫组织化学染色结果表明,低分化患者中Podoplanin表达量较高,进一步分析Podoplanin的表达与肿瘤分化程度与淋巴结转移明显相关,且能影响预后。低分化及淋巴结转移是恶性肿瘤分期及预后的关键因素,Podoplanin在低分化及淋巴结转移的患者表达明显升高,与肿瘤的恶性程度呈正相关,进而影响预后,提示Podoplanin的表达可作为OSCC患者预后的标志物。此结果与Chang等[18]肺鳞癌中研究结果类似。还有研究表明卧床肿瘤患者中Podoplanin的表达影响静脉血栓的形成,此机制与Podoplanin参与血小板聚集有关,静脉血栓的形成也是影响恶性肿瘤患者的重要因素之一[19],但在OSCC中Podoplanin影响患者预后是否与静脉血栓的形成有关,仍需进一步研究。
细胞无限增殖是恶性肿瘤的核心机制[20],为了解Podoplanin在OSCC增殖及集落形成中的作用,本研究利用RNA干扰及质粒转染技术沉默及上调Podoplanin后,观察细胞增殖及集落形成能力的变化,结果表明抑制Podoplanin表达48 h后,细胞增殖明显减弱,集落形成能力减弱,而上调Podoplanin之后24 h及48 h呈现相反的结果,提示Podoplanin的表达可影响OSCC细胞的增殖及集落形成。细胞周期实验结果表明沉默Podoplanin后,G1期细胞数增多,S 期细胞数减少,沉默Podoplanin后G1/S比值明显高于对照组,过表达组G1/S比值明显降低,提示Podoplanin可通过影响细胞周期进而调控细胞增殖。
众多研究表明,Podoplanin在恶性肿瘤中最重要的机制为影响细胞迁移,Podoplanin可结合Ezrin/Radixin/Moesin家族蛋白,促进细胞增殖,在此过程中,伴随Ras超家族A蛋白的激活,还可诱发上皮间质转化的形成,导致细胞侵袭转移[21-23]。在OSCC中,Podoplanin可使基质金属蛋白酶9表达升高,降解细胞外基质,破坏细胞屏障,促进肿瘤细胞的迁徙转移[24]。本研究结果显示沉默Podoplanin后细胞迁移能力减弱,上调之后细胞迁移能力增强,提示Podoplanin的表达对OSCC的细胞迁移具有一定意义。
PI3K/AKT是肿瘤细胞增殖迁移中重要的信号通路之一,可通过作用于细胞周期蛋白调控细胞增殖,在鳞癌细胞中,AKT的持续表达可诱导上皮间质转化,诱导细胞侵袭转移[25-27]。本研究结果显示沉默Podoplanin后,PI3K及AKT的磷酸化水平降低,过表达后二者磷酸化水平升高,提示Podoplanin的表达可影响PI3K/AKT信号通路的水平,但是Podoplanin影响细胞增殖及迁移能力是否通过PI3K/AKT通路,仍需使用通路的抑制剂进一步证明。
综上所述,Podoplanin与OSCC患者的分化程度及淋巴结转移明显相关,且可影响患者预后,沉默Podoplanin后细胞增殖及集落形成能力呈抑制状态,上调Podoplanin表达后呈现明显相反的结果,Podoplanin的表达量也可影响细胞迁移能力,低表达时迁移能力减弱,高表达则迁移能力增强,PI3K/AKT可能是其中的影响机制之一。在后续实验中,可采用更大样本量的OSCC组织标本,阐明Podoplanin与OSCC的关联,还可采用Podoplanin不同表达的体内模型,研究Podoplanin在OSCC中的作用机制,为OSCC的临床诊治提供新思路。
