N2a/APP695细胞表达载脂蛋白E4对线粒体自噬的影响*
2022-06-04付燕林吴昌学郑菊龙培艳张文萍高霄王正微齐晓岚肖雁
付燕林, 吴昌学, 郑菊, 龙培艳, 张文萍, 高霄, 王正微, 齐晓岚, 肖雁*
(贵州医科大学 地方病与少数民族疾病教育部重点实验室 & 贵州省医学分子生物学重点实验室, 贵州 贵阳 550004)
阿尔茨海默病(Alzheimer's disease, AD)是一种以细胞外β-淀粉样蛋白(amyloidP protein, Aβ)沉积和细胞内Tau蛋白磷酸化形成的缠结为主要病理学特征的神经系统退行性疾病[1]。淀粉样蛋白级联假说提出后,关于Aβ沉积的研究开展得更多,结果表明Aβ的有害作用不可否认,还提出Aβ沉积会触发该疾病的其他致病机制的新观点[2]。然而,随着AD发病机制研究的深入,Aβ沉积被认为有可能不是AD的早期发病机制,因为大脑新陈代谢和线粒体功能障碍在AD早期已经发生改变[3-4]。因此有关学者提出线粒体功能障碍可能是AD的早期发病原因,但具体机制尚不明确。载脂蛋白E(apolipoprotein E, APOE)是一种由星形胶质细胞合成的脂质转运蛋白,其主要功能是将星形胶质细胞合成的胆固醇运输到神经细胞中,在某些特定的情况,神经细胞中也会合成APOE以维持细胞内脂质的稳定。APOE根据其突变位点不同分为3种不同亚型,分别为APOE4、APOE43、APOE2[5]。有研究发现,APOE4的携带者患AD的风险比其他亚型携带者增加约4~12倍,APOE4携带者患AD的时间早于非携带者[6-7]。同时还发现APOE4携带者在AD早期认知功能正常时,大脑区域就有葡萄糖代谢减退,在未受AD影响的皮质区域,线粒体复合Ⅳ的活动已经减少,提示APOE4与线粒体功能障碍也有关[8-9]。特别是在神经元中,APOE4与线粒体呼吸受损、神经生长减少和神经毒性发生有关[10-11]。线粒体对神经元的生存、发育和功能十分重要,神经元的数量和质量通过线粒体分裂融合调控,而线粒体分裂融合则由线粒体融合蛋白-2 (mitofusin 2,MFN2)、线粒体融合蛋白-1(mitofusin1,MFN1)、线粒体分裂蛋白-1(fission 1,FIS1)调控[12-13]。正常情况下线粒体分裂融合保持相对稳定,但当线粒体分裂融合平衡破坏后会增强线粒体自噬的发生将受损线粒体清除,PINK1/Parkin信号通路是线粒体自噬的关键通路[14-15]。正常情况下,位于线粒体外膜的张力蛋白同源物诱导的假定激酶1 (PTEN-induced putative kinase 1, PINK1),经转位酶的调节,转移至线粒体内膜;但当线粒体受损后,PINK1膜内转移受阻,线粒体外膜的PINK1累积增加,导致自身磷酸化而被激活[16]。E3泛素连接酶 (E3 ubiquitinpotein ligase parkin,Parkin)作为PINK1的下游分子,在接受PINK1刺激活化后,募集至线粒体基质与微管相关蛋白1轻链3Ⅰ(microtubule-associated protein 1 light chain 3Ⅰ, LC3Ⅰ)结合,LC3Ⅰ与磷脂酰乙醇胺相结合,从而形成 LC3Ⅱ,LC3Ⅱ促进线粒体包裹进入自噬体,从而导致线粒体自噬的发生[17]。该途径能够将受损线粒体清除,使细胞产生新的有效的线粒体,而当线粒体自噬途径出现异常时,受损的子线粒体无法通过自噬途径清除而堆积于细胞内,将会影响线粒体功能甚至对细胞造成损伤[15]。研究表明APOE4的神经元中胆固醇外排减少,而高胆固醇累积于细胞中会影响细胞线粒体自噬异常[18-19]。因此,推测APOE4表达可能使线粒体自噬发生异常从而引起线粒体功能障碍。本研究以稳定表达APP695小鼠来源神经瘤母细胞株(mouse neuroblastoma cell line, N2a)为AD的细胞模型(N2a/APP695),通过构建表达APOE4细胞株,探讨APOE4表达时对N2a/APP695细胞中线粒体自噬的影响。
1 材料与方法
1.1 实验材料
1.1.1细胞来源 N2a/APP695细胞由贵州医科大学分子生物学重点实验室谭俊教授惠赠。
1.1.2主要试剂和仪器 FIS1、β-Actin抗体(美国 GeneTex公司),MFN2、MFN1、PINK1、Parkin抗体和Cholesterol Assay Kit(Cell-Based)(美国 Abcam公司),LC3、LC3Ⅱ、CYC、HRP标记的兔二抗及鼠二抗(美国 CST公司),APOE4慢病毒及阴性对照慢病毒(上海 吉凯基因医学科技股份有限公司),线粒体探针(上海 碧云天生物技术有限公司),DMEM培养基、opti-MEM培养基及胎牛血清(美国 Gibco公司);细胞培养箱 (美国ermo fisher公司) ,多功能酶标仪(美国 BIOTEK公司),激光共聚焦显微镜(日本 Olympus公司),高速离心机(德国 Eppendorf公司),GeneGnome XRQNPC化学发光成像仪(英国 Syngen公司),BG-power600 型稳流电源(北京百晶生物)。
1.2 研究方法
1.2.1细胞培养、分组和嘌呤霉素筛选处理 高糖DMEM培养基、opti-MEM选择培养基、胎牛血清和双抗以45 ∶44 ∶10 ∶1的比例配成完全培养基;N2a/APP695细胞悬液、2 mL完全培养基加入15 mL离心管中,离心(1 000 r/min,5 min);去上清,加入4 mL完全培养基吹打混匀后于T25培养瓶中恒温培养(37 ℃,5%CO2),取对数生长期N2a/APP695细胞接种于6孔板中;设N2a/APP695正常细胞组(正常组)、APOE4慢病毒感染组(表达组) 和阴性对照慢病毒空载组(阴性对照组),除正常组外,各组加入对应的慢病毒和助感染试剂;感染培养72 h后经过嘌呤霉素的培养基不断筛选(正常组中细胞不含有嘌呤抗性基因,阴性对照组和APOE4表达组中含有嘌呤抗性基因)具有抗性的细胞。
1.2.2APOE4、MFN2、MFN1、FIS1、PINK1、Parkin和LC3蛋白表达 N2a/APP695细胞用1XPBS洗3次,每孔加入100 μL/100 PMSF的RIPA裂解液,冰上裂解30 min,离心(14 000 r/min,20 min)后收集上清液,BCA蛋白定量法测定蛋白浓度;通过12%的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)30 mA恒流电泳至蛋白质标准物分离到合适间距(约1.5~2 h),结束电泳;将凝胶中的蛋白质通过湿法电转印转移至 PVDF膜上(200 mA,2 h),用含5%脱脂奶粉室温封闭1 h,分别加入一抗APOE4(1 ∶1 000)、MFN1(1 ∶1 000)、MFN2(1 ∶1 000)、FIS1(1 ∶1 000)、LC3(1 ∶1 000)、PINK1(1 ∶200)、Parkin(1 ∶1 000)、β-Actin(1 ∶4 000),4 ℃摇床过夜;第二日TBST漂洗3次,每次10 min;加入对应的二抗(1 ∶5 000),室温孵育1 h;TBST 漂洗3次,每次10 min;使用ECL发光试剂盒和GeneGnone XRQ曝光仪进行曝光,Image J软件分析目标蛋白条带灰度值。
1.2.3线粒体形态变化 将细胞以1×104个/孔种于共聚焦培养皿, 37 ℃培养24 h,Mito-Tracker Green(1 ∶20 000)稀释于无酚红培养基配置成工作液,37 ℃预温育15 min;细胞去除原培养液,PBS洗1次后,用无酚红DMEM洗涤1次,加入Mito-Tracker Green染色工作液1 mL/孔,37 ℃孵育60 min;去掉Mito-Tracker Green染色工作液,用无酚红DMEM洗1次后加完全培养基,激光共聚焦显微镜观察。
1.2.4细胞胆固醇染色荧光观察 细胞以5×105个/孔种于激光共聚焦培养皿中,37 ℃培养,待细胞长到60%后备用;去掉培养基,加入Cholesterol Assay Kit中的固定液固定15 min、去掉固定液,洗涤液洗3次、每次5 min;加入配置好的染色试剂,黑暗环境常温孵育40 min,洗涤液洗3次,每次5 min;激光共聚焦观察荧光情况。
1.2.5细胞免疫荧光染色 将细胞以5×104个/孔种于激光共聚焦培养皿中,37 ℃培养24 h,去掉细胞培养基,PBS洗3次,每次5 min;加入4%的细胞组织固定液固定细胞20 min,PBS洗3次、每次5 min;加入1 mL 0.3%的Triton溶液15 min,PBS洗3次、每次5 min;加入1 mL山羊血清封闭液30 min,回收山羊血清封闭液,加入按比例用羊血清配制好的一抗稀释液,4 ℃过夜;次日回收一抗,PBS洗3次、每次5 min;用PBS配制好的二抗稀释液,室温避光孵育1 h,PBS洗3次、每次5 min;激光共聚焦检测。
1.3 统计学分析
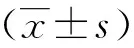
2 结果
2.1 APOE4蛋白表达
嘌呤霉素筛选结果显示,正常组细胞在含有嘌呤霉素的培养基中逐渐死亡,阴性对照组和表达组仅有少量细胞死亡;Western blot结果显示,正常组和阴性对照组细胞中不表达APOE4,表达组细胞中表达APOE4蛋白;鉴定慢病毒感染成功。见图1。
注:A为经过含嘌呤霉素的培养基筛选出来具有抗性的细胞结果(20×),B为Western blot检测细胞APOE4表达。图1 嘌呤霉素培养基筛选具有抗性N2a/APP695细胞及APOE4蛋白表达(Western blot)Fig.1 Puromycin dihydrochloride culture medium screened N2a/APP695 with resistance and APOE4 expression (Western blot)
2.2 MFN1、MFN2、FIS1蛋白含量及线粒体形态变化
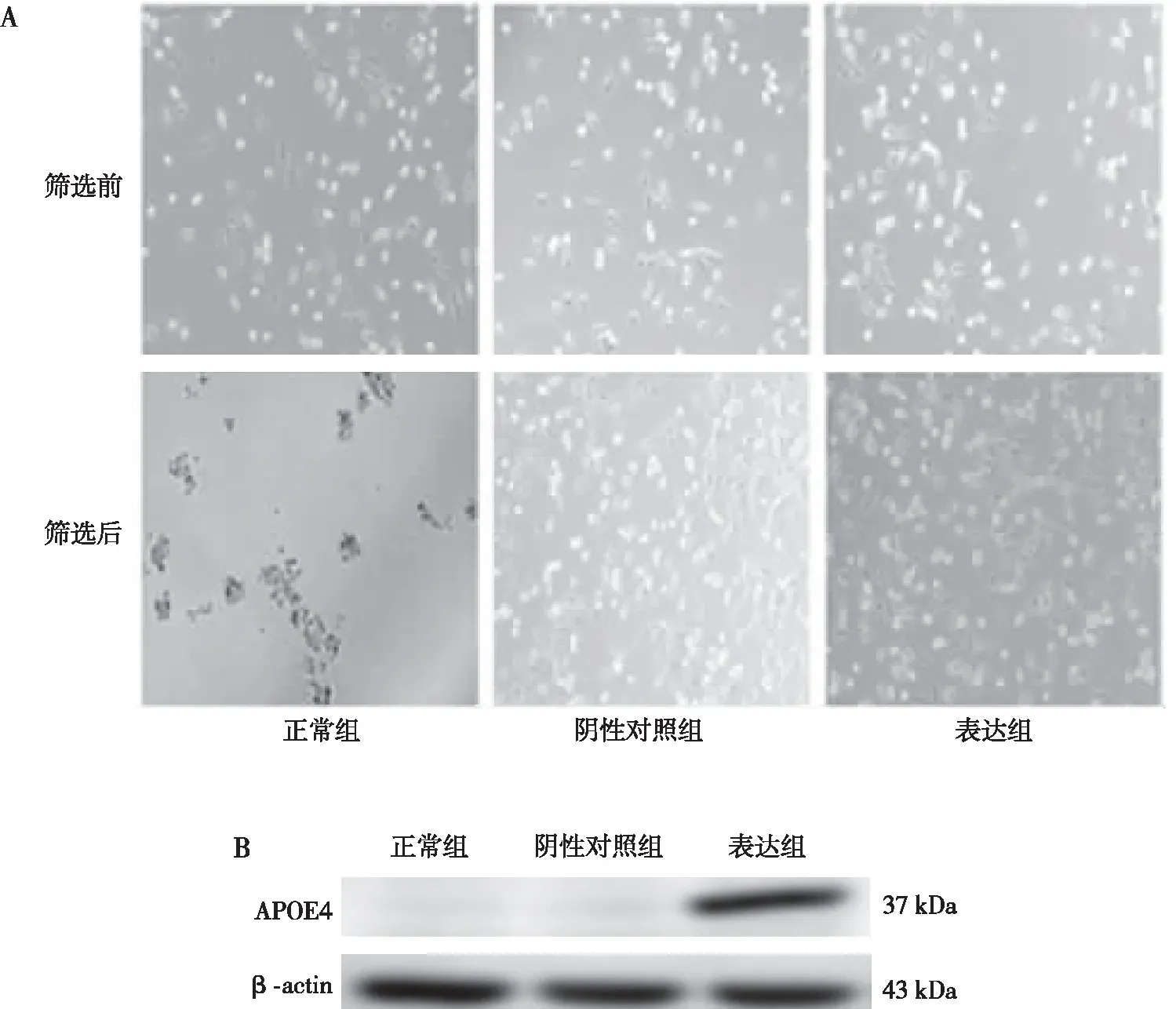
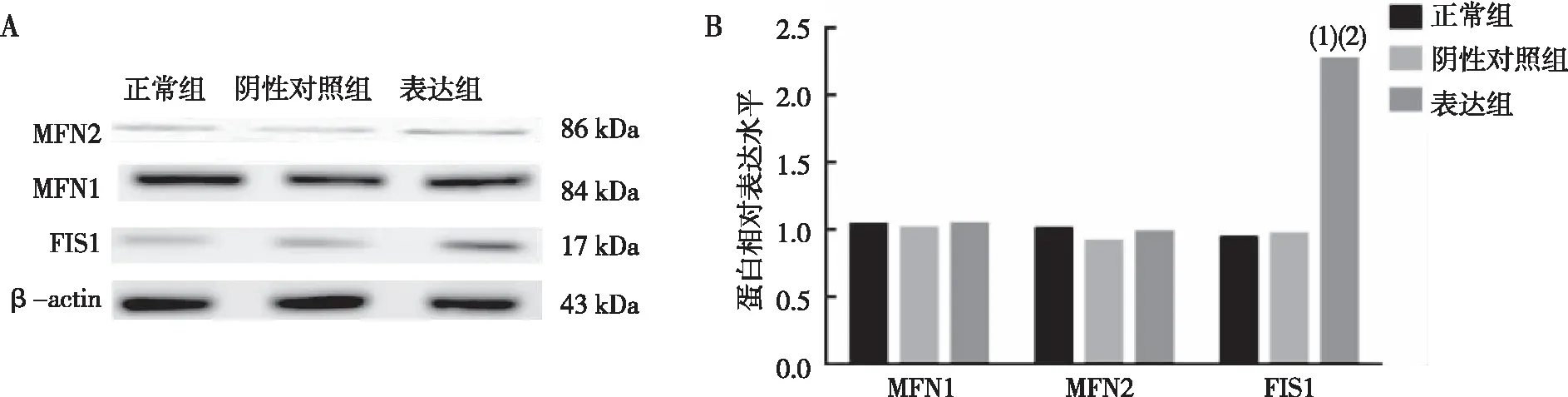
Western blot结果显示,与正常组和阴性对照组相比,表达组中线粒体融合蛋白MFN1、 MFN2差异无统计学意义(P>0.05),线粒体分裂蛋白FIS1明显上调(P<0.01,图2);Mito-Tracker Green荧光染色结果显示,与正常组和阴性对照组相比,表达组中线粒体形态呈现碎片化(图3)。
注:A为Western blot法检测各蛋白表达结果,B为各蛋白表达的定量结果;(1)与正常组比较,P<0.01;(2)与阴性对照组比较,P<0.01。图2 各组N2a/APP695细胞中MFN1、MFN2及FIS1蛋白的表达(Western blot)Fig.2 MFN1, MFN2, and FIS1 protein expression in cells of all groups(Western blot)
注:蓝色为细胞核,绿色为线粒体。图3 各组N2a/APP695细胞中线粒体形态变化(荧光染色,×100)Fig.3 Mitochondrial morphological changes in cells of all groups(fluorecent staining,×100)
2.3 PINK1、Parkin和LC3蛋白含量
结果显示,与正常组和阴性对照组相比,表达组细胞中线粒体自噬蛋白PINK1和Parkin明显上调(P<0.01),LCⅡ/Ⅰ下调(P<0.05,图4)。
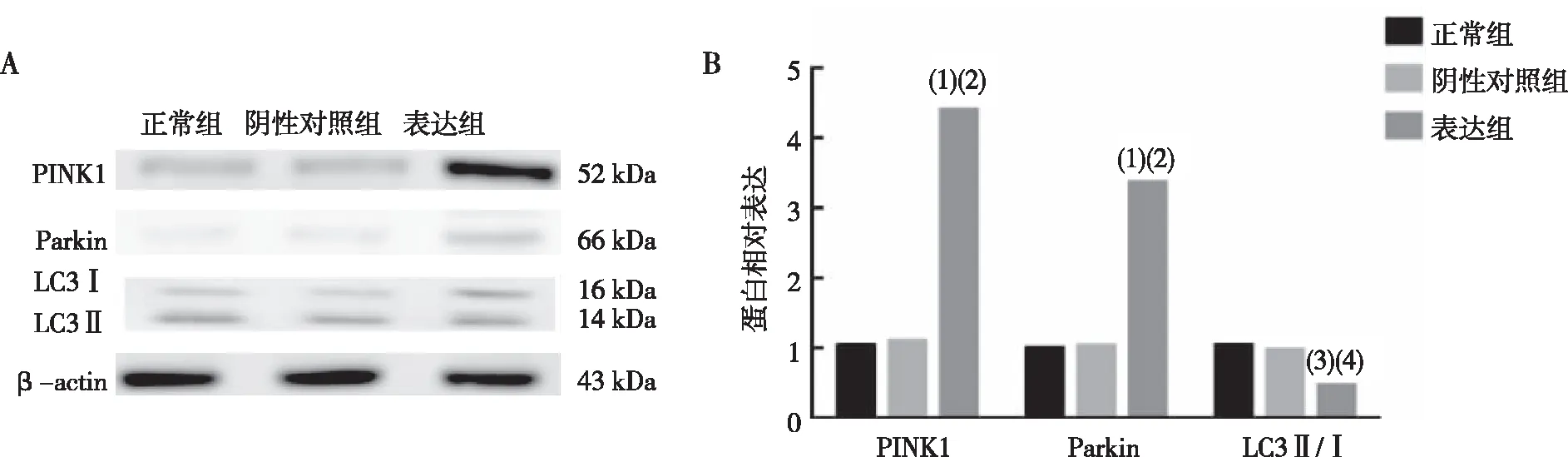
注:A为Western blot法检测各蛋白表达结果,B为各蛋白表达定量结果;与正常组比较,(1) P<0.01, (3) P<0.05;与阴性对照组比较,(2) P<0.01, (4) P<0.05。图4 各组N2a/APP695细胞中PINK1、Parkin和LC3蛋白表达(Western blot)Fig.4 The expression of PINK1, Parkin, and LC3 protein in cells of all groups(Western blot)
2.4 细胞中胆固醇染色结果
结果显示,正常组与阴性对照组中胆固醇主要分布在细胞膜上,表达组中细胞胆固醇不仅在细胞膜上,同时在细胞内高分布(红色箭头所指,图5)。
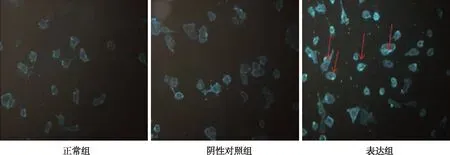
图5 各组N2a/APP695细胞胆固醇染色结果(荧光染色,×20)Fig.5 Cellular cholesterol staining in all groups(cell immunofluorescence,×20)
2.5 LC3Ⅱ与线粒体之间的共定位情况
细胞色素C(cytochrome C, CYC)位于真核细胞的线粒体膜上,可作为线粒体上的标志蛋白,免疫荧光检测CYC与LC3Ⅱ的共定位情况结果显示,与正常组和阴性对照组相比,表达组中LC3Ⅱ与CYC的共定位减少(黄色部分)。见图6。
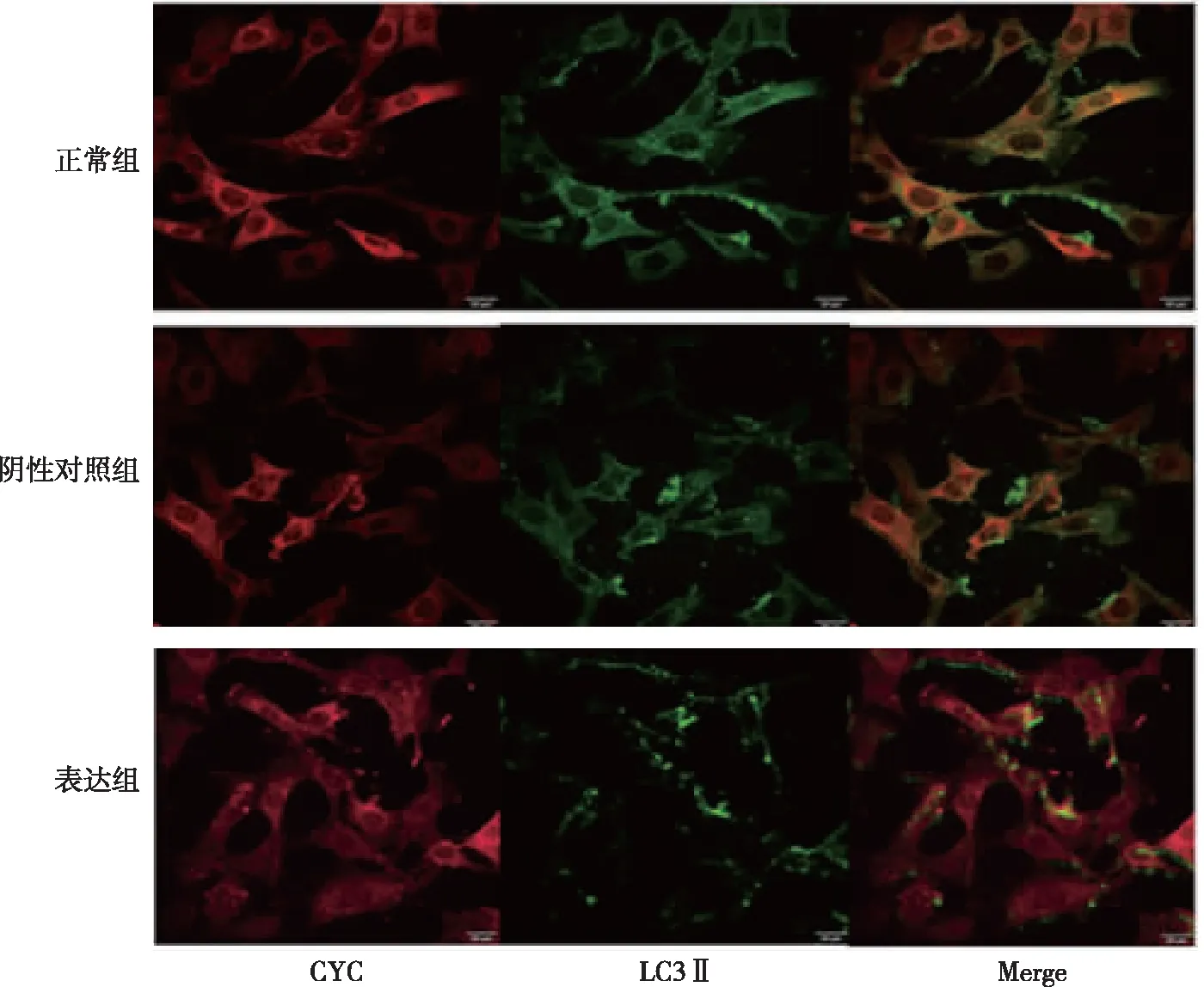
注:红色为线粒体,绿色为LC3Ⅱ,黄色为线粒体与LC3Ⅱ共定位。图6 各组N2a/APP695细胞CYC与LC3Ⅱ之间的共定位情况(免疫荧光,×100)Fig.6 Co-localization between CYC and LC3Ⅱ in all groups(immunofluorescent,×100)
3 讨论
本研究通过成功构建表达APOE4的N2a/APP695细胞,观察APOE4对线粒体分裂融合蛋白的影响,结果显示,与正常组和阴性对照组相比,表达组中MFN2和MFN1未观察到表达水平改变,但是FIS1蛋白上调,线粒体荧光染色发现表达组中线粒体形态呈现碎片化,这提示APOE4可促进线粒体裂变。线粒体分裂融合的不平衡容易造成线粒体自噬的异常,进而影响线粒体功能的变化。进一步检测线粒体自噬关键通路蛋白,结果表明自噬蛋白PINK1、Parkin显著上调,LCⅡ/Ⅰ下调,这提示线粒体自噬出现异常。受损的线粒体募集PINK1蛋白在线粒体外膜的累积增加,激活Parkin蛋白,但是可能没有与LC3Ⅱ结合,阻碍线粒体包裹入溶酶体,从而导致线粒体自噬通路发生异常,导致大量损伤线粒体无法排除细胞外,堆积于细胞内。这与ROCA等人[20]研究结果相似,在神经元细胞中,胆固醇介导的抗氧化线粒体防御下调触发了 PINK1-Parkin信号通路,激活PINK1蛋白和Parkin蛋白高表达,但溶酶体无法识别受损线粒体导致线粒体不完全降解,LC3Ⅱ/Ⅰ下降,线粒体自噬不足。同时,APOE4是胆固醇与脂质的载体,有研究发现神经细胞中APOE4的脂质结合域与脂质结合,减少胆固醇对外运输,使得细胞体内胆固醇积累,高胆固醇能破坏自噬体与溶酶体囊泡的融合,从而破坏了线粒体自噬通路[21]。本研究对各组细胞内胆固醇进行荧光染色检测,结果显示,正常组与阴性对照组中胆固醇主要分布在细胞膜上,表达组中细胞胆固醇不仅在细胞膜上,同时在细胞内高分布。这提示APOE4可能通过减少胆固醇外排而影响受损线粒体与LC3的结合从而导致线粒体自噬的异常。
综上所述,本研究成功构建表达APOE4的N2a/APP695细胞,在有APOE4表达的神经细胞中线粒体分裂增多,但自噬途径发生异常而导致大量损伤线粒体堆积于细胞中,这可能是AD发病机制中线粒体功能障碍的原因之一。
