水产养殖活动对水体营养盐及浮游植物组成的影响
——以桑沟湾围隔实验为例
2022-06-03柴正晴李瑞环宁志铭董书航宁晓燕刘素美
柴正晴, 李瑞环,2, 宁志铭,3, 董书航, 宁晓燕,4, 刘素美,5
(1. 中国海洋大学 深海圈层与地球系统前沿科学中心和海洋化学理论与工程技术教育部重点实验室, 山东 青岛 266100;2. 中国科学院南海海洋研究所, 广东 广州 510301; 3. 广西大学海洋学院, 广西 南宁 530004;4. 海洋高等研究院, 山东 青岛 266237; 5. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室, 山东 青岛 266237)
中国是世界第一水产养殖大国,是世界上最大的贝、藻类养殖国家。在养殖海湾,水产养殖导致的环境问题会反过来限制养殖水域生态系统的可持续性发展[1-2]。许多研究表明,高密度筏式养殖对潮流具有阻碍作用,使得表层流速减慢,导致养殖海湾内外水交换滞缓,对生源要素的输送和循环产生影响[3-6]。为了应对这一问题,多营养层次的综合养殖模式(Integrated Multi-trophic Aquaculture, IMTA)被广泛应用[7]。

本文通过现场受控培养实验,对比贝类单养、大型藻类单养及贝藻混养模式下水体营养盐含量的变化及浮游植物粒径结构的变化进行了对比,关注不同模式下营养盐对养殖活动的响应,进一步探究了不同模式的养殖活动对养殖海域生态环境带来的影响。
1 研究区域、样品采集及研究方法
1.1 研究区域
2013年7月28日—8月7日(夏季),在黄海西部的桑沟湾内选择位于贝藻混养区的站位MC(37°05′E, 122°33′N)进行现场围隔实验。
1.2 围隔实验及样品采集
实验所用围隔袋子由较厚的,长、宽、高各1 m的透明聚乙烯塑料膜做成,体积约为1 m3,共5个。围隔袋固定在由铁架和浮漂制成的浮床上,底部封闭,顶部向大气敞开,开口位置比水面高约0.5 m,浮床固定在湾内距离楮岛码头约500 m的闲置鱼排上。围隔内光照、水温、水流扰动等情况与现场水体保持一致,但不与周边水体进行水交换。采用采样后添加营养盐的方式,分别在实验的第三天和第六天向围隔中添加NaNO3、KH2PO4、Na2SiF6储备液,以补充围隔内的营养盐消耗,使围隔水体营养盐浓度尽量与周围水体营养盐的浓度保持一致。
桑沟湾内养殖的滤食性贝类主要为栉孔扇贝和长牡蛎,采用筏式养殖,养殖周期一般为5—11月,海带养殖周期通常为11月至次年4—5月[14]。由于实验在7—8月进行,该季节湾内海带已收获,湾内养殖大型藻类以龙须菜为主,因此选用栉孔扇贝与龙须菜为养殖物种进行培养实验。栉孔扇贝、龙须菜及营养盐的添加方式及各围隔袋营养盐初始浓度及贝藻含量如表1所示。对照1和对照2 为对照实验,对照1中仅添加栉孔扇贝作为养殖物种,两个对照袋中均不添加营养盐。实验原本采用梯度添加栉孔扇贝的方式,设置了4只、7只、10只扇贝的实验组,对照组取中间值的添加量,即7只。从营养盐及叶绿素的样品检测的结果来看,各梯度之间数据结果差距不大。为了使实验结果的展示更加简明,并方便与对照组进行比较,本文仅选取添加了7只扇贝的实验组进行分析,将栉孔扇贝用托盘悬挂于围隔袋子中。围隔袋设置好后,立即测定各围隔中的水文参数,同时采集并测定此时各围隔内营养盐和叶绿素a浓度,即为初始浓度。之后在实验的1~6天和第9天每天采集一次营养盐及叶绿素a样品,并测定围隔内的水文参数。水样采集后,立即使用0.4 μm的聚碳酸酯膜过滤,滤液倒入125 mL事先用1 mol·L-1盐酸浸泡并用Milli-Q水洗净的聚四氟乙烯瓶中,-20 ℃冷冻保存,用来测定营养盐。用干净的铝箔包裹过完水样的0.4 μm的聚碳酸酯膜,并记录体积,-20 ℃冷冻保存,用来测定总叶绿素a含量。分级叶绿素a水样先经200 μm 筛绢过滤,然后用20、2、0.2 μm三种孔径滤膜过滤,获得不同粒级样品,同样在-20 ℃下避光冷冻保存,带回实验室后立即进行分析测定。
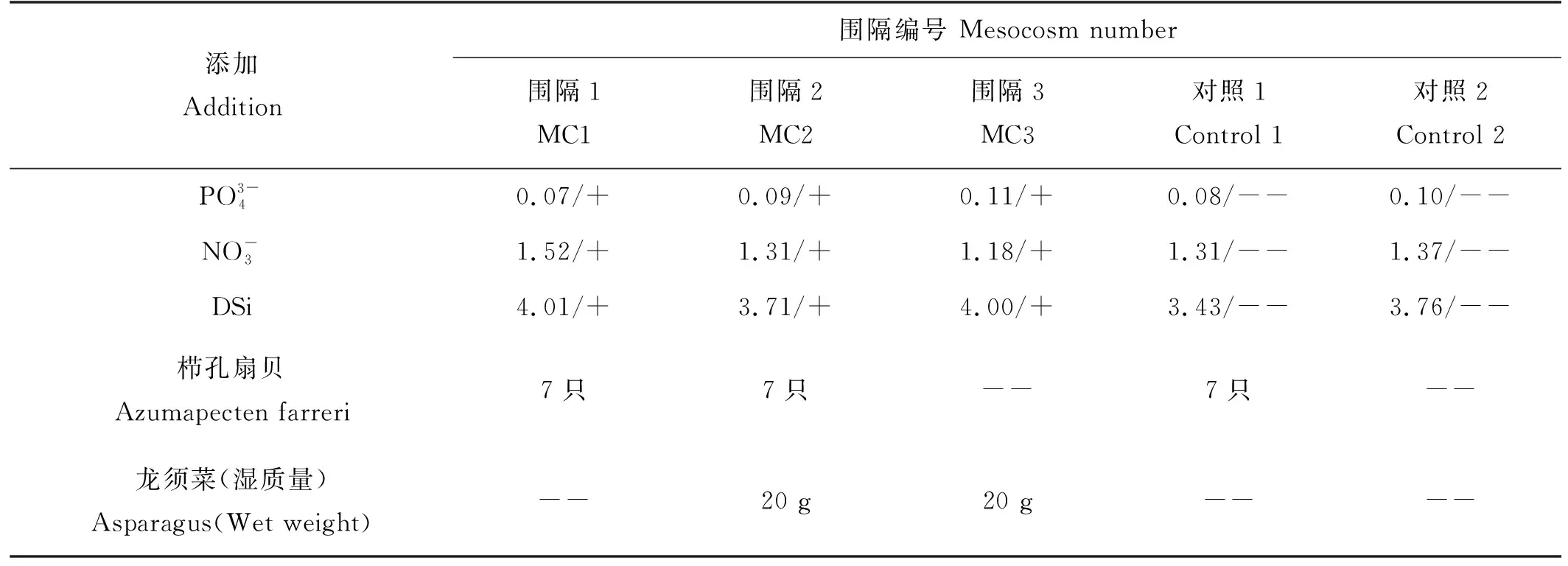
表1 围隔受控培养实验营养盐初始浓度添加情况及养殖物种添加情况Table 1 Initial concentration of nutrients and addition of nutrients and cultured species in mesocosm /(μmol·L-1)
为了确定营养盐添加的浓度与比例,查找了桑沟湾养殖海域营养盐含量比值的长期变化。在进行对比后,选择了2003年[15]和2006年[16]的DSi/DIN(0.41、0.37)值作为参考,最终确定围隔中添加营养盐的DSi/DIN为32/12(0.375)。同时,2003与2006年的调查结果显示,夏季桑沟湾DIN/DIP分别为70.1、105,DIP平均含量分别为0.24、0.12 μmol·L-1;由于夏季桑沟湾本就存在磷限制的现象[11],且部分围隔中养殖了大型藻类,会大量消耗营养盐,因此为防止围隔中出现严重磷限制,最终确定了DIP的添加量为0.25 μmol·L-1,添加的DIN/DIP为32/1。基于以上,在第3天和第6天采样后分别添加8.00、0.25、3.00 mmol的NaNO3、KH2PO4、Na2SiF6储备液至围隔袋中,营养盐添加的浓度分别为6.15、0.19、2.31 μmol·L-1,氮、磷、硅添加浓度的比例为32/1/12。
1.3 分析方法
2 结果与讨论
2.1 理化因子变化
如图1,由于受控实验是开放的体系,各围隔水温差距较小,变化范围均在19.6~24.7 ℃。其中培养的第一天和第八天因为有降雨,引起水温下降。DO在6.61~11.6 mg·L-1范围内波动变化,没有明显的规律性。添加了龙须菜的MC2、MC3两个围隔,因为大型藻类光合作用释放氧气,DO均值稍高于其他围隔。pH范围为8.295~8.841,和DO有相似的变化趋势,DO浓度高时pH也相应变高。MC2、MC3中pH均值稍高,说明龙须菜的添加引起pH升高。第一天(7月30日)采样时,正在下雨,且现场雾很大,能见度低,降雨使得围隔上层水体中盐度显著降低。一般采样时会将探头下放至围隔深度的约二分之一处测定,而第一天采样时受限于环境条件,探头放的可能不够深,且采样前未将围隔内水体混合均匀,所以导致测出的盐度过低。之后采样时,未再出现相同的情况,因此盐度的测定不再受影响,恢复至正常水平。
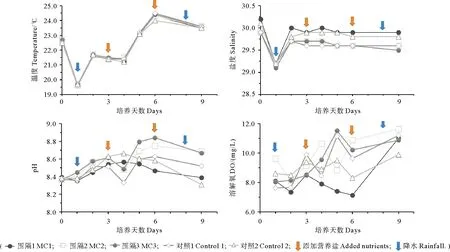
图1 围隔袋内温度、盐度、溶解氧(DO)、pH的变化Fig.1 Changes of temperature, salinity, dissolved oxygen (DO) and pH in mesocosm
2.2 养殖活动对营养盐结构组成的影响
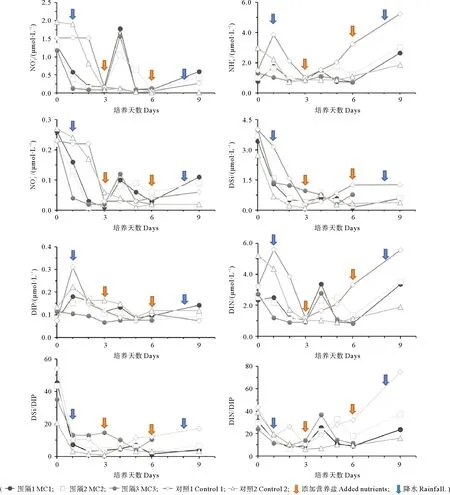
图2 围隔袋内溶解无机态营养盐含量及组成变化Fig. 2 Changes of dissolved inorganic nutrients content and composition in mesocosm
本实验所用大型藻类为龙须菜,生长过程中不吸收DSi,因此DSi的降低均是由浮游植物的吸收利用所导致。各围隔中Chla含量的变化如图3所示,在实验的前三天,MC1、MC2、MC3中的Chla均呈先上升后下降的趋势。尽管在三个围隔中MC3中的DIN、DIP降低的比例最高,围隔内溶氧含量的增加也最为明显,但Chla增加的比例(3.3%)却远远小于其他两个围隔(MC1, 52.9%; MC2, 24.5%),说明大部分的营养盐均被龙须菜所吸收。大型藻类对营养盐的竞争利用,限制了MC3中浮游植物的生长。MC2中虽然也养殖了大型藻类,但贝类的排泄释放起到了补充营养盐的作用。此外,通过MC1、MC2与空白组的对比,可知扇贝的养殖可以增加水体内浮游植物对DSi的消耗。有研究指出,贝类喜欢摄食脂肪类含量高的颗粒物质,且高脂肪酸的饵料能够促进扇贝的摄食速率。由于甲藻细胞脂肪酸含量高于硅藻,因此扇贝对甲藻有更强的摄食选择性[19-20]。许多研究均表明,贝类的养殖导致桑沟湾甲藻的丰度显著降低,而硅藻的优势度则增加[21-23],这可能是MC1、MC2中DSi迅速降低的原因之一。
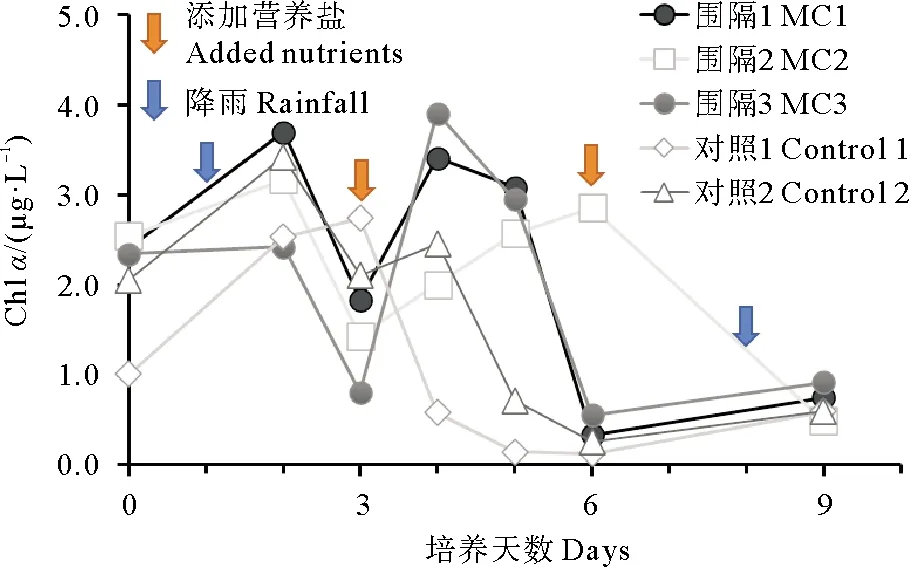
图3 围隔袋内叶绿素a(Chl a)含量的变化Fig.3 Changes of Chl a concentration in mesocosm

2.3 养殖活动对溶解有机态营养盐结构的影响

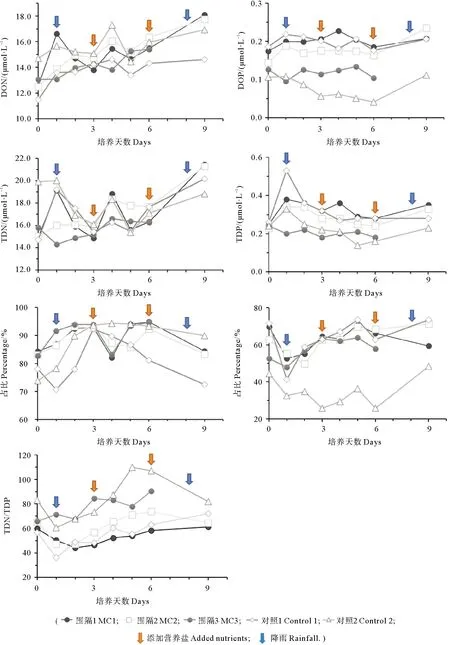
图4 围隔带袋内溶解有机态及总溶解态营养盐含量及DON (a)、DOP (b)的浓度占比变化情况Fig.4 The concentration of dissolved organic and total nutrients and the proportions of DON (a) and DOP (b) in mesocosm
从DON与DOP的含量变化上来看,添加了扇贝的围隔内观察到溶解有机态营养盐的积累更为明显,这可能是由于贝类排泄中含有较多的有机成分导致的。实验中出现的DOP的降低可能是由于该季节存在磷限制的情况,无机磷供应不足,因此部分DOP被浮游植物吸收利用所导致。许多研究均发现,在无机磷匮乏的海域,溶解有机磷可以通过浮游植物自身的生物化学作用和酶水解等作用作为补充磷源被浮游植物吸收利用[32-34]。第一天被贝类单养的围隔MC1、对照1中TDN/TDP为50/1、36/1,实验结束时为61/1、72/1。从营养盐的结构变化上来看,含磷营养盐的累积不如含氮营养盐明显,这可能与桑沟湾水体中磷的含量本身较低有关。
2.4 养殖活动对浮游植物粒径结构的影响
围隔中叶绿素a含量整体呈降低趋势(见图3)。实验的前三天,MC1、MC2、MC3中Chla含量均呈现先升高后降低的趋势,第2天为Chla在前三天的峰值。MC1中贝类排泄带来的营养盐刺激了浮游植物的生长,因此水体Chla升高最明显。MC2中藻类与贝类的作用相互抵消,因此Chla的变化趋势虽然与MC1相似,但相对滞后。此外这三个围隔中第3~6天中所观察到的Chla的升高均是由于添加营养盐引起的。由于是采样后添加营养盐,因此在MC1、MC3均是在第四天观察到峰值,分别为3.42和3.19 μg·L-1。MC2在第六天才观察到峰值,为2.86 μg·L-1。总体来看,贝藻混养的体系MC2中浮游植物生长变化相对迟缓,对营养盐添加的反应也不如MC1、MC3灵敏,可见贝藻混养更有助于维持养殖生态系统的可持续发展。
从培养的第3天开始,扇贝滤食作用变得明显。贝类单养的围隔MC1、对照1内浮游植物构成由micro-级浮游植物为主转为pico-级浮游植物为主(见图5)。这一变化与扇贝的滤食选择性相关。许多研究表明滤食性贝类对粒径较大的食物有着更高的摄食效率,对于2 μm以下的食物截留率较低,这是由扇贝的器官结构和摄食机制导致的[27,35-36]。此外,在藻类单养的围隔MC3中,也出现了浮游植物粒径构成向小型化转变的现象,培养一段时间后micro-级浮游植物的占比显著降低。这可能是由于大型藻类与浮游植物竞争利用营养盐导致水体营养盐的匮乏,而粒径较小的pico-级和nano-级浮游植物拥有更大的比表面积,在吸收营养盐时比micro-级浮游植物更具有竞争力,因此可以更好的适应低营养盐的环境[35-36]。因此大型藻类的养殖同样会促使水体内浮游植物向小型化发展。MC2中的浮游植物同时受到贝类滤食及大型藻类竞争利用营养盐的影响,浮游植物构成也由micro-级浮游植物为主转为pico-级浮游植物为主。许多对桑沟湾养殖海区内浮游植物粒级结构的调查发现,在桑沟湾内滤食性贝类养殖区和贝藻混养区,浮游植物均出现小型化趋势,nano-级和pico-级浮游植物占总浮游植物的比例高于海带养殖区[39-41]。以上结果说明在水产养殖体系中,贝类与藻类养殖都会使水体浮游植物向小型化发展,促使nano-级和pico-级浮游植物成为优势种。随着培养时长的增加,各围隔中pico-级浮游植物的占比开始回落,但Chla的总量并没有明显的回升,说明当大部分大粒级的浮游植物被滤食以后,小粒级的浮游植物也被扇贝摄食。

图5 围隔袋内Chl a含量变化及不同粒级Chl a所占比例(FChl a)Fig.5 The change of Chl a concentration and the proportion of Chl a in different particle size fractions in the enclosure bag

3 结论
本文通过围隔实验,探究了不同养殖模式下,养殖海湾内营养盐与浮游植物粒径结构的变化特征。主要有以下几项结论:

(2)贝类的滤食作用使硅藻在浮游植物群落中的优势度增加,因此会加速水体硅酸盐的消耗,改变养殖水体的氮、磷、硅比值。
(3)贝类的选择性滤食使养殖水体内浮游植物粒径结构向小型化转变,nano-级和pico-级浮游植物更具优势。同时当大型藻类养殖导致营养盐供应不足时,也会使水体浮游植物向小型化发展。因此在贝藻综合养殖模式下,浮游植物偏小型化,nano-级和pico-级浮游植物更易成为优势种。
