蝙蝠蛾拟青霉-蛹虫草复方的安全性评价及调节免疫活性研究
2022-06-03焦春伟梁慧嘉随晶晶陈家明谢意珍
焦春伟 梁慧嘉 随晶晶 陈家明 谢意珍



摘 要:目的:评价蝙蝠蛾拟青霉-蛹虫草复方安全性与免疫增强活性。方法:采用小鼠急性毒性试验、骨髓细胞微核试验、精子畸形试验、微粒体酶(Ames)试验、迟发型变态反应试验、血清溶血素滴度检测和脾细胞抗体生成细胞试验,观察受试物的安全性和免疫功能。结果:蝙蝠蛾拟青霉-蛹虫草复方对小鼠急性毒性最大耐受量>20.0 g/kg bw,属无毒级物质,且小鼠骨髓细胞微核试验、精子畸形试验及Ames试验呈阴性;细胞免疫试验中,中剂量(0.33 g/kg bw)、高剂量(0.99 g/kg bw)复方能显著提高小鼠足跖厚度差值(中剂量:p<0.05;高剂量:p<0.01);体液免疫试验中,高剂量复方能极显著提高小鼠溶血空斑数与半数溶血值(p<0.01),说明复方能增强小鼠细胞免疫与体液免疫。结论:该复方在试验剂量内安全无毒,且具有增强免疫功效。
关键词:蝙蝠蛾拟青霉;蛹虫草;毒理学;调节免疫;安全性评价
Safety Evaluation and Immunomodulatory Activity of a Combination of Paecilomyces hepiali and Cordyceps militaris
JIAO Chunwei1,2, LIANG Huijia2, SUI Jingjing2, CHEN Jiaming2, XIE Yizhen1,2*
(1.Guangdong Yuewei Biotechnology Co., Ltd., Zhaoqing 526000, China; 2.Guangdong Yuewei Edible Fungi Technology Co., Ltd., Guangzhou 510663, China)
Abstract: Objective: To evaluate the safety and immunomodulatory activity of the combination of Paecilomyces hepiali and Cordyceps militaris. Method: Acute toxicity test in mice, bone marrow cell micronucleus test in mice, sperm malformation test in mice, microsomal enzyme(Ames)test, delayed metamorphosis test in mice, serum hemolysin titer detection and spleen cell antibody - producing cell assay were used to observed to determine the toxicity and immune effect. Result: The maximum tolerated oral acute toxicity of the compound in mice was
>20.0 g/kg bw, which was a non-toxic substance, and the mouse bone marrow cell micronucleus test, sperm malformation test and Ames test were negative; in the cellular immunity test, the medium (0.33 g/kg bw) and high
(0.99 g/kg bw) doses of the compound significantly increased the difference in foot and plantar thickness in mice (medium dose: p<0.05. High dose: p<0.01); In the humoral immunity test, the high dose of the compound significantly increased the number of hemolytic vacuoles and hemolytic values in mice (p<0.01), indicating that the compound could enhance cellular and humoral immunity in mice. Conclusion: the compound is safe and non-toxic at the doses tested and has immune-enhancing effects.
Keywords: Paecilomyces hepiali; Cordyceps militaris; toxicology; immunomodulatory; safety evaluation
冬蟲夏草(Cordyceps sinensis)是我国传统名贵中药材之一,因其药效显著而被广泛用于中医、藏医及其他民族医学[1-2]。现代药理研究结果显示冬虫夏草富含多糖、虫草酸及腺苷等活性成分,可在机体中发挥调节免疫[3]、抗肿瘤[4]及降血脂[5]等多种生理活性。然而,由于其生长环境苛刻,导致现有资源难以满足消费者的需求[6]。
近年来,研究发现蝙蝠蛾拟青霉(Paecilomyces hepiali)和蛹虫草(Cordyceps militaris)具有与冬虫夏草相似的成分组成,部分活性成分甚至高于冬虫夏草,是两种较为理想的替代品[7]。药理学研究结果显示,蝙蝠蛾拟青霉与蛹虫草均具有较好的调节免疫活性[8-10]。蝙蝠蛾拟青霉含高度分支的甘露聚糖与多种氨基酸,具有诱导淋巴细胞转化,增加血清免疫球蛋白的功效,还能改善肿瘤患者因化疗药物带来的免疫损伤[11-12]。蛹虫草含有的杂多糖与多种核苷类物质是发挥该活性的重要物质基础[13-14]。
本研究所选用的蝙蝠蛾拟青霉与蛹虫草均为安全且无明显毒副作用的原料,但以两种原料复配所得的混合物安全性尚不明确,因此本研究先通过急性毒性实验、小鼠骨髓细胞微核试验等对该混合物的安全性进行评价。在明确其安全性的基础上,通过迟发型变态反应试验、小鼠脾细胞抗体生成试验等评价其调节免疫活性,为相关保健食品的开发提供理论依据。
1 材料和方法
1.1 原料
蝙蝠蛾拟青霉-蛹虫草复配物由广东粤微食用菌技术有限公司提供。
1.2 试验动物
无特定病原体(Specific Pathogen Free,SPF)级昆明小鼠(Kunming Mice,KM)小鼠,体重18~22 g,雌雄过半;SPF级斯泼累格·多雷(Sprague Dawley,SD)大鼠,体重66~76 g;所有动物均由广东省医学试验动物中心提供,生产许可证号:SCXK(粤)2013-0002。试验期间,所有试验动物均饲养于广东省医学实验动物中心的SPF级环境中,饲养条件为室温20~26 ℃,湿度40%~70%,12 h/12 h明暗交替,试验期间自由摄食和饮水。
1.3 主要仪器与试剂
CO2培养箱;CASY DT型细胞计数仪;SOFT
maxPRO酶标仪;超净工作台;倒置显微镜;显微镜;温箱;游标卡尺;RPMI1640培养基;绵羊红细胞等。
1.4 试验方法
1.4.1 急性毒性试验
采用最大耐受量法进行经口急性毒性试验。将20只KM小鼠(雌雄各半)分为雌雄两组,禁食不禁水16 h,经口灌胃受试物溶液(20.0 g/kg bw)两次(时间间隔为4 h),每次灌胃0.2 mL/10 g bw,观察并记录小鼠一周内的中毒表现及死亡情况。
1.4.2 遗传毒性试验
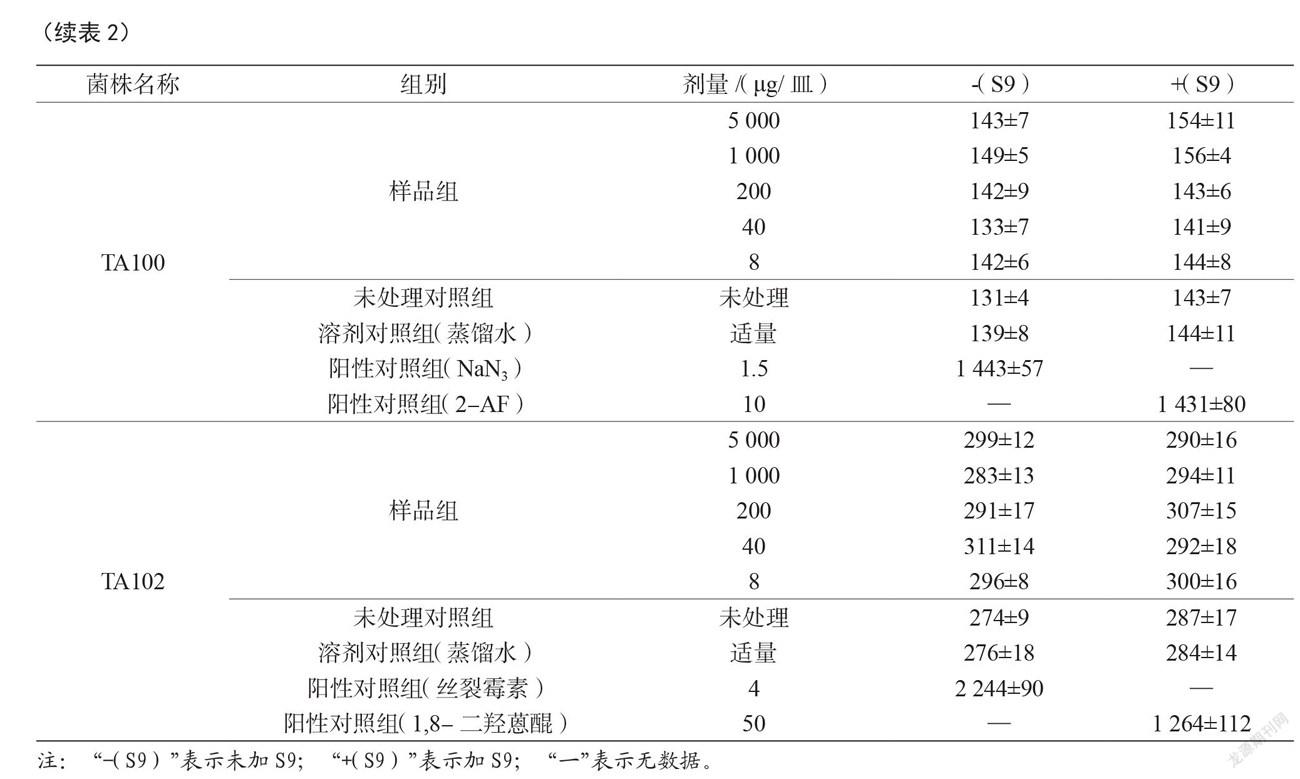
(1)Ames试验。选用经鉴定符合要求的鼠伤寒沙门氏菌组氨酸缺陷型TA97、TA98、TA100、TA102试验菌株,以多氯联苯诱导的大鼠肝脏匀浆S9液为代谢活化系统,设置5个样品组(5 000 μg/皿、
1 000 μg/皿、200 μg/皿、40 μg/皿及8 μg/皿)、未处理对照组、溶剂对照组(蒸馏水)及阳性对照组。染毒后置于37 ℃条件下培养48 h,记录每皿回变菌落数。
(2)小鼠骨髓细胞微核试验。将50只SPF级健康KM小鼠随机分为5组(每组10只,雌雄各半):阴性对照组,受试物低、中、高剂量组,阳性对照组。阴性对照组每日灌胃纯净水,受试物低、中、高剂量组灌胃2.50 g/kg bw、5.00 g/kg bw、10.00 g/kg bw
剂量溶液,阳性对照组灌胃40 mg/kg bw环磷酰胺(Cytoxan,CTX)溶液。采用30 h給受试物法进行试验,经口灌胃,灌胃量均为0.2 mL/10 g bw,第一次染毒24 h后以同样的剂量进行第二次染毒,6 h后,处死小鼠取胸骨骨髓进行制片、染色,油镜下每只小鼠计数1 000个嗜多染红细胞(Polychromatic Erythrocytes,PCE),观察含有微核的PCE数;若一个PCE中出现两个或两个以上微核,仍按一个有微核细胞计数:计算各组微核发生率(‰)。同时计数观察到200个PCE时所见到的成熟红细胞(Normochromatic Erythrocyte,NCE)数,计算嗜多染红细胞数与成熟红细胞数的比值(PCE/NCE)。
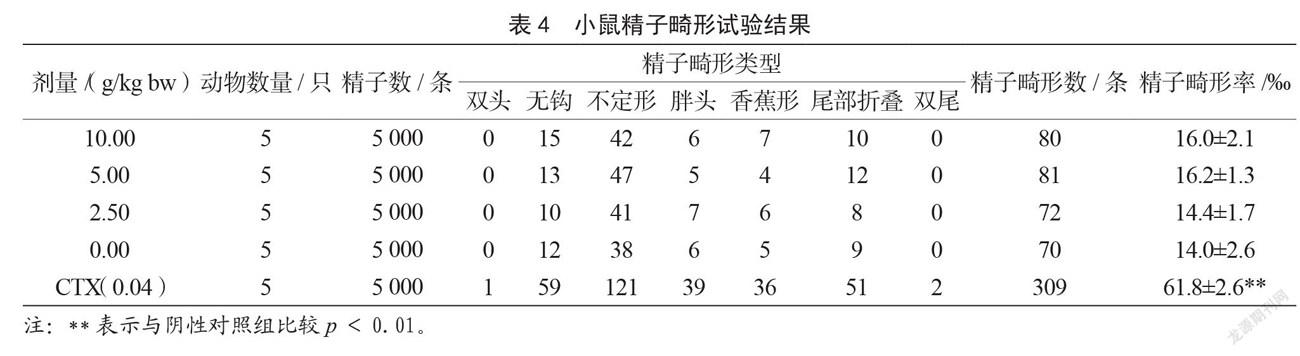
(3)小鼠精子畸形试验。将25只SPF级健康KM雄性小鼠随机分为5组,每组5只,根据急性毒性试验结果,设受试物最高剂量为10.00 g/kg bw,该剂量以下设5.00 g/kg bw、2.50 g/kg bw两个剂量,阴性对照组给予等量的纯净水,阳性对照组选用40 mg/kg bw CTX溶液。采用经口灌胃方式给予受试物,每天灌胃一次,连续灌胃5 d,灌胃量均为0.2 mL/10 g bw,首次染毒后第35 d处死动物取双侧附睾制片、染色,高倍镜下镜检观察,每只小鼠计数1 000条完整精子,每组共检查5 000条精子,求出精子畸形发生率(‰)。
1.4.3 免疫活性评价试验
将小鼠分为4组:低、中、高剂量组和阴性对照组,低、中、高剂量组分别灌胃0.17 g/kg bw、0.33 g/kg bw、0.99 g/kg bw的受试物,阴性对照组每天灌胃0.1 mL/10 g bw纯净水,持续4周。根据《保健食品检验与评价技术规范》要求进行迟发性变态反应、血清溶血素滴度检测和脾细胞抗体生成细胞试验。
1.5 试验数据统计
釆用方差分析,按方差分析的程序先进行方差齐性检验,方差齐,计算F值,F值>F0.05,各组均数间差异无显著性;F值≥F0.05,p≤0.05,用多个试验组和一个对照组间均数的两两比较方法进行统计;对非正态或方差不齐的数据进行适当的变量转换,待满足正态或方差齐要求后,用转换后的数据进行统计;若变量转换后仍未达到正态或方差齐的目的,改用秩和检验进行统计。
2 结果与分析
2.1 急性毒性试验
试验期间,各小鼠饮食、行为活动及毛色均正常;雌、雄鼠均无死亡,且生长良好,雌、雄小鼠的最大耐受量(Maximum Tolerated Dose,MTD)均大于20.0 g/kg bw,属安全无毒(见表1)。
2.2 遗传毒性试验
2.2.1 Ames试验
Ames试验结果由表2可知,复方对4种菌株的试验中,各剂量组回变菌落数与对照组相比无显著性差异(p>0.05);4种菌株各剂量回变菌落数均低于阴性对照组的2倍,说明受试物为非突变物。
2.2.2 小鼠骨髓细胞微核试验结果
由表3可知,各组小鼠骨髓细胞中均存在微核。与阴性对照组相比,低、中、高3种剂量受试物组小鼠骨髓微核率无显著性变化,但阳性对照组与阴性对照组存在极显著性差异(p<0.01);PCE/NCE结果显示,受试物各剂量组的PCE/NCE比值与阴性对照组比较,差异无统计学意义,并且不少于阴性对照组的20%。以上结果说明在2.5~10.0 g/kg bw,受试物对小鼠骨髓微核细胞无毒性,不存在致染色体畸变的可能。
2.2.3 小鼠精子畸形试验
由表4可知,3个干预组小鼠精子畸形率与对照组相比均无显著性差异(p>0.05),说明复方无精子致畸作用。
2.3 复方对免疫功能的影响
由表5可知,与对照组相比,低、中、高剂量组小鼠足跖厚度差值分别增加16.42%、31.34%、43.28%;其中中剂量组与对照组差异显著(p<0.05),高剂量组与对照组差异极显著(p<0.01),说明3种剂量的复方均能增强小鼠迟发型变态反应,且增强效果具有剂量依赖性。复方高剂量组小鼠脾细胞抗体生成水平较对照组增加15.24%,两组间差异极显著
(p<0.01);与SRBC小鼠模型相比,3个复方溶液组小鼠血清半数溶血值HC50明显升高,其中高剂量组极显著升高(p<0.01),较对照组增加12.94%,说明高剂量组复方能够增强小鼠体液免疫。
3 结论
毒性试验分急性毒性、亚慢性毒性及特殊毒性试验等[15]。本研究中急性毒性试验结果表明,KM小鼠对蝙蝠蛾拟青霉-蛹虫草混合物最大耐受剂量大于20.0 g/kg,相当于受试物日推荐剂量的606倍,属于无毒级物质;小鼠骨髓微核试验、精子畸形试验及Ames试验等特殊毒性试验结果显示,向小鼠灌胃2.50 g/kg、5.00 g/kg、10.00 g/kg混合物不具致突变作用和生殖毒性。
免疫系统由免疫器官、免疫细胞及免疫分子组成,是机体对病原体、传染病及污染物等的高度防御机制[16-17]。本试验结果显示,中、高剂量复方组小鼠足跖厚度差值较对照组显著增加(中剂量p<0.05,高剂量p<0.01),判定细胞免疫试验结果呈阳性;复方高剂量组小鼠溶血空斑数与半数溶血值较对照组显著增加(p<0.01),判定体液免疫结果呈阳性。
本研究通过毒理学试验与免疫活性评价试验,证明了蝙蝠蛾拟青霉-蛹虫草复方在本试验剂量范围内无明显毒副作用,食用安全性较高,且具有一定免疫增强活性。这一结论为该复配原料在保健食品领域的合理应用与机制研究奠定了理论基础。
参考文献
[1]李皓翔.冬虫夏草核苷类成分质量评价方法研究[D].广州:广州中医药大学,2021.
[2]王敦.冬虫夏草活性成分研究进展[J].环境昆虫学报,2021,43(4):779-787.
[3]ZHANG Q,LIU M,LI L,et al.Cordyceps polysaccharide marker CCP modulates immune responses via highly selective TLR4/MyD88/p38 axis[J].Carbohydrate Polymers,2021,271:118443.
[4]LIU X,ZHU Z,LIU Y,et al.Comparisons of the anti-tumor activity of polysaccharides from fermented mycelia and cultivated fruiting bodies of Cordyceps militaris in vitro[J].International Journal of Biological Macromolecules,2019,130:307-314.
[5]DENG Y,KIM B Y,PARK M J,et al.Paecilomyces tenuipes extracts affect lipid and glucose metabolic parameters similarly to Cordyceps militaris extracts[J].Journal of Asia-Pacific Entomology,2020,23(3):746-755.
[6]张成瑞,田泽园,范琪,等.冬虫夏草资源发展现状及可持续利用分析[J].中国食用菌,2021,40(10):79-88.
[7]姜雪,王春月,李兰洲,等.蝙蝠蛾拟青霉及蛹虫草与野生冬虫夏草活性比较[J].长春中医药大学学报,2017,33(4):544-547.
[8]周毓麟,李兰洲,胡文继,等.蝙蝠蛾拟青霉质量标准及免疫活性研究[J].中南民族大学学报(自然科学版),2017,36(1):24-27.
[9]张洁宏,赵鹏,李彬,等.蝙蝠蛾拟青霉菌丝体增强免疫力功能动物试验研究[J].广西医科大学学报,2013,30(4):520-522.
[10]YU Y A,QIANG W B,AO S C,et al.Isolation and immune activity of a new acidic Cordyceps militaris exopolysaccharide[J].International Journal of Biological Macromolecules,2022,194:706-714.
[11]滕伟卓.蝙蝠蛾拟青霉菌株发酵工艺优化、菌粉质量标准及免疫活性研究[D].长春:吉林大学,2015.
[12]傅惠英,張利棕,寿旗扬,等.中国被毛孢和蝙蝠蛾拟青霉小鼠免疫功能调节作用的比较[J].中国比较医学杂志,2012,22(9):16-20.
[13]于悦.蛹虫草胞外多糖的分离纯化及其免疫活性研究[D].长春:吉林农业大学,2021.
[14]徐悉哲,王言之,李世芬,等.蛹虫草对小鼠免疫功能的调节作用[J].江苏医药,2021,47(7):661-663.
[15]肖晶,樊永祥.食品安全检验方法标准体系建设探究[J].中国食品卫生杂志,2021,33(6):639-643.
[16]YU F,ZHANG Z,YE S,et al.Immunoenhancement effects of pentadecapeptide derived from Cyclina sinensis on immune-deficient mice induced by cyclophosphamide[J].Journal of Functional Foods,2019,60:103408.
[17]SHI J,ZHANG Q,ZHAO X,et al.The impact of caseinate oligochitosan-glycation by transglutaminase on amino acid compositions and immune-promoting activity in BALB/c mice of the tryptic caseinate hydrolysate[J].Food Chemistry,2021,350(4):129302.
