基于网络药理学与分子对接探讨“黄芪-当归”治疗年龄相关性黄斑变性的作用机制
2022-06-02孟欢刘自强韩梦雨农璐琪金明
孟欢 刘自强 韩梦雨 农璐琪 金明

摘要 目的:通过网络药理学和分子对接方法探讨中药“黄芪-当归”治疗年龄相关性黄斑变性(AMD)的作用机制。方法:借助中药系统药理学数据库与分析平台(TCMSP)获取中药黄芪、当归的有效成分与作用靶点,使用Uniport数据库进行基因ID的注释,在GeneCards、OMIM数据库中查找AMD的相关基因。使用Cytoscape 3.7.2将药物-关键有效成分-疾病靶点网络可视化,在String数据库平台构建蛋白质-蛋白质相互作用(PPI)网络,再利用Metascape基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析,使用AutoDock4.2.6软件对关键靶点蛋白及有效成分进行分子对接验证。结果:通过筛选,得到黄芪-当归有效成分22个,与AMD相关的关键有效成分14个,黄芪-当归与AMD的共同基因靶点52个;PPI中核心基因依次为CASP3、IL6、VEGFA、EGFR、ESR1等;GO功能富集得到1 064個条目,生物学过程主要涉及细胞凋亡、对类固醇激素的反应、活性氧代谢、对脂多糖的反应等;KEGG富集分析后得到119条信号通路,与癌症的通路、流体剪切力与动脉粥样硬化、HIF-1信号通路、TNF信号通路、VEGF信号通路等机制相关;分子对接结果表明,核心有效成分可与靶点蛋白形成构象能量较低、结构稳定的对接。结论:“黄芪-当归”治疗AMD具有多成分、多靶点、多通路的特点,为进一步研究AMD的治疗提供了思路。
关键词 黄芪;当归;年龄相关性黄斑变性;机制;网络药理学;分子对接
Mechanism of Astragali Radix and Angelicae Sinensis Radix on Age-related Macular Degeneration Based on Network Pharmacology and Molecular Docking
MENG Huan1,LIU Ziqiang1,HAN Mengyu1,NONG Luqi1,JIN Ming2
(1 Beijing University of Chinese Medicine,Beijing 100029,China; 2 China-Japan Friendship Hospital,Beijing 100029,China)
Abstract Objective:To explore the mechanism of Astragali Radix and Angelicae Sinensis Radix in the treatment of age-related macular degeneration(AMD) based on network pharmacology and molecular docking.Methods:The active ingredients and targets of Astragali Radix and Angelicae Sinensis Radix were obtained from TCMSP,and Uniport was used to annotate gene IDs.AMD-related genes were screened out in GeneCards and OMIM.Cytoscape 3.7.2 was used to visualize the drug-key active ingredient-disease target network and protein-protein interaction(PPI) network was plotted by String.Metascape was used to perform Gene Ontology(GO) and Kyoto Encyclopedia of Genes and Genomes(KEGG) enrichment analyses.AutoDock 4.2.6 was used for molecular docking of key target proteins to active ingredients.Results:Twenty-two ingredients of Astragali Radix and Angelicae Sinensis Radix were screened out,14 of which were key active ingredients related to AMD.There were 52 common gene targets of drugs and the disease.The core genes in the PPI network were CASP3,IL6,VEGFA,EGFR,ESR1,etc.GO function enrichment resulted in 1 064 entries,with biological processes mainly involving apoptosis,response to steroid hormones,active oxygen metabolism,and response to lipopolysaccharide.KEGG enrichment yielded 119 signaling pathways,which were related to cancer pathway,fluid shear force and atherosclerosis,HIF-1 signaling pathway,TNF signaling pathway,and VEGF signaling pathway.Molecular docking results showed that the core active ingredients could dock to the target proteins with low conformational energy and stable structure.Conclusion:The therapeutic effect of Astragali Radix and Angelicae Sinensis Radix on AMD is characterized by multiple components,multiple targets,and multiple pathways.This study is expected to provide a scientific basis for further research on the treatment of AMD.
Keywords Astragali Radix; Angelicae Sinensis Radix; Age-related macular degeneration; Mechanism; Network pharmacology; Molecular docking
中图分类号:R285;R276.7文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.07.008
年龄相关性黄斑变性(Age-related Macular Degeneration,AMD)是一种难治性眼底病变,以年龄为主要危险因素,临床根据有无脉络膜新生血管(Choroidal Neovascularization,CNV)分为干性与湿性2型,分别以眼底黄斑部玻璃膜疣、地图样萎缩及视网膜色素上皮(Retinal Pigment Epithelium,RPE)脫离、黄斑部出血水肿为主要特征表现,是全球第三大致盲因素,我国AMD患病人数预计在2050年达5 519万人,严重危害中老年人视力健康[1]。目前西医治疗AMD的方法较多,包括抗血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)玻璃体腔内注射、光动力疗法(Photodynamic Therapy,PDT)、激光及手术等[2],但均为针对CNV的治疗手段,对以地图样萎缩为主要表现的干性AMD尚无有效疗法,且存在治疗频率高、对药物的延迟应答或不应答等不足[3]。近年来,中医药在AMD的治疗中彰显了明确的优势,AMD在中医属“视瞻昏渺”“视直如曲”及“暴盲”的范畴,病位在肾、脾、肝,针对其本虚标实的病机,以扶正祛邪为治则,往往能取得较好的疗效,可改善患者视功能、延缓疾病进展。
黄芪味甘,性微温,被誉为补中益气之要药,来自豆科植物蒙古黄芪或者膜荚黄芪的根,归脾、肺经,具有健脾补中、升阳举陷、益气固表等功效;当归为伞形科植物当归的根,味甘、辛,性温,归肝、心、脾经,具有补血调经,活血止痛等功效,为补血之圣药[4]。黄芪、当归相须配伍,是临床非常常用的气血双补药对。现代药理学研究表明,黄芪与当归配伍可促进造血干细胞的增殖,通过提高机体免疫力、清除自由基发挥抗衰老作用,还可抑制病变部位血管内膜增生时血管局部的炎症反应[5-7],因此临床常将二者配伍用于AMD的治疗。
网络药理学是一门以系统生物学、生物信息学和高通量组织学为基础,集药理学和信息网络为一体的综合学科,对预测中药多成分、多靶点、多途径的作用机制有重要意义,在探索药物对疾病的基本作用与机制、分析中医理论及研究中药的应用等方面广泛运用[8-9]。因此,本研究采用网络药理学联合分子对接的研究方法,分析中药黄芪-当归治疗AMD的有效成分、作用靶点及参与的生物途径,探讨其可能的疗效机制,以期为今后进一步的实验探索提供理论依据。
1 资料与方法
1.1 药物主要有效成分及作用靶点的获取 借助中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)(http://tcmspw.com/tcmsp.php)获得药物的主要有效成分和作用靶点[10]。在其中搜索关键词“黄芪”“当归”,并将检索条件设置为口服生物利用度(Oral Bioavailability,OB)≥30%、类药性(Drug Likeness,DL)≥0.18,进一步筛选其主要有效成分和作用靶点。在Uniport数据库中对药物作用靶点进行标准化处理,转化为对应基因。
1.2 药物-疾病核心靶点的获取 与AMD疾病相关的基因靶点从在线数据库人类孟德尔遗传研究平台(OMIM,https://omim.org/)、人类基因信息数据库(GeneCards,https://www.genecards.org/)中分别检索获取。以“age-related macular degeneration”为关键词分别从中检索相关基因,删除重复后合并。将黄芪-当归的药物靶点基因与AMD的疾病相关基因取交集,所得交集基因即为黄芪-当归治疗AMD的核心基因,并对所得结果在线绘制韦恩图。
1.3 药物-关键有效成分-疾病靶点网络可视化 黄芪-当归及其关键有效成分与AMD靶点之间作用网络的可视化借助Cytoscape 3.7.2软件实现。通过药物与疾病的交集基因再次筛选药物有效成分后,可获得黄芪-当归治疗AMD的关键有效成分,将核心基因与关键有效成分同时导入软件,完成可视化处理。
1.4 构建蛋白质-蛋白质相互作用网络 药物-疾病交集基因的蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络分析由String在线数据库(https://string-db.org/)完成。将黄芪-当归与AMD所共有的基因在线导入,物种选择为人(Homo Sapiens),将所得结果隐藏离散点后,计算网络中蛋白质相互作用关系对数量,并按照节点度对核心基因进行排序。
1.5 生物信息富集分析 药物-疾病核心基因的生物信息富集分析通过在线基因注释工具Metascape(http://www.metascape.org/)实现。包括在基因本体(Gene Ontology,GO)生物信息(包括生物过程、细胞组分、分子功能)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路的富集分析等,了解黄芪-当归干预AMD主要参与的生物通路,探讨其作用机制。
1.6 分子对接 使用AutoDock4.2.6软件对PPI网络中节点度较高的关键靶点与可视化网络中呈现的黄芪与当归的关键有效成分进行分子对接。靶点蛋白与有效成分的分子结构分别来自于RCSB PDB数据库(http://www.rcsb.org/)和ZINC数据库(https://zinc.docking.org/),通过靶点与有效成分的最佳构象下的结合能评价活性成分和关键靶点之间的对接效果,并将最佳构象导入Pymol2.4.0软件对结果进行可视化分析。
2 结果
2.1 黄芪-当归有效成分筛选 在TCMSP数据库中共检索到黄芪-当归有效成分212个,其中黄芪87个,当归125个。按照同时满足OB≥30%和DL≥0.18的条件筛选后最终得到黄芪-当归的有效成分22个,其中黄芪20个,当归2个。
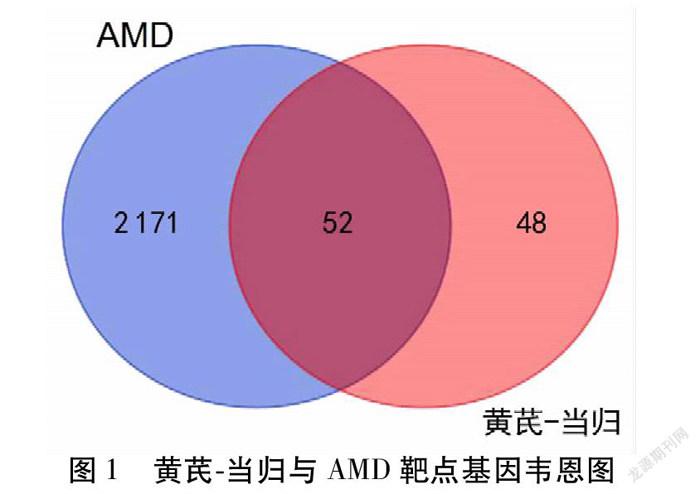
2.2 药物-疾病核心基因的获取 在TCMSP数据库中共检索到黄芪-当归主要有效成分的作用靶点共531个,去除重复及无意义的作用靶点后,使用Uniport数据库进行基因ID的注释,共获得100个药物作用靶点。在GeneCards及OMIM数据库中检索到2 607个与AMD疾病相关基因,筛除重复项后获得2 223个相关基因,将黄芪-当归与AMD的靶点基因进行映射,得到52个药物与疾病的共同基因靶点。见图1。
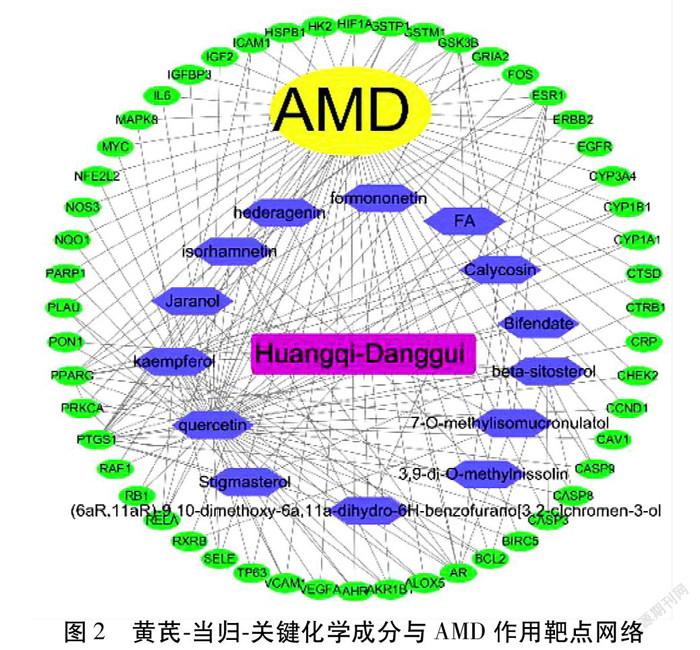
2.3 药物-关键化学成分-疾病网络的构建 将52个共同靶点基因与药物的22个有效成分进行匹配,再次筛选得到14个黄芪-当归治疗AMD的关键有效成分,然后将52个共同靶点基因和14个关键有效成分均导入Cytoscape软件进行可视化处理。其中蓝色六边形为药物关键化学成分,外圈绿色椭圆为作用于疾病的基因靶点。见图2。
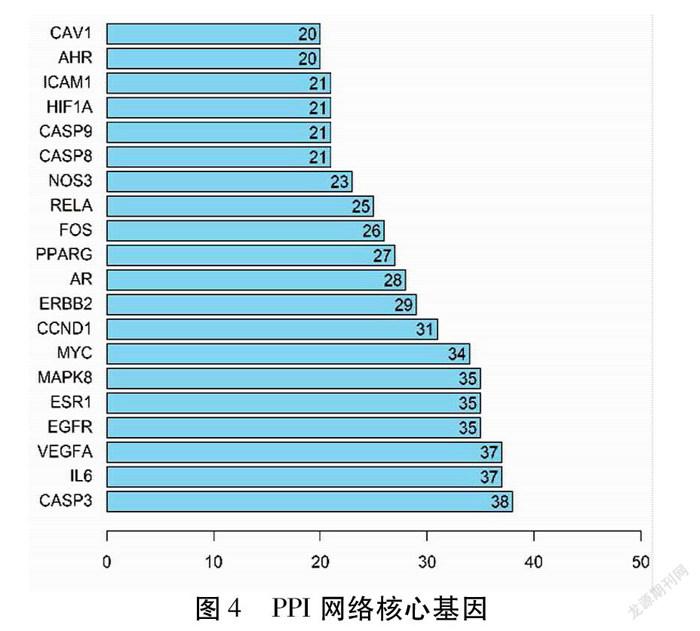
2.4 PPI网络分析 将52个黄芪-当归与AMD的共有的靶点基因输入String数据库平台,隐藏1个离散点后得到的PPI网络图。该图包含51个靶基因蛋白,924个PPI关系对,其中节点度处于前10位的分别为CASP3、IL-6、VEGFA、EGFR、ESR1、MAPK8、MYC、CCND1、ERBB2、AR。见图3~4,这些可能是黄芪-当归治疗AMD作用的关键靶点。
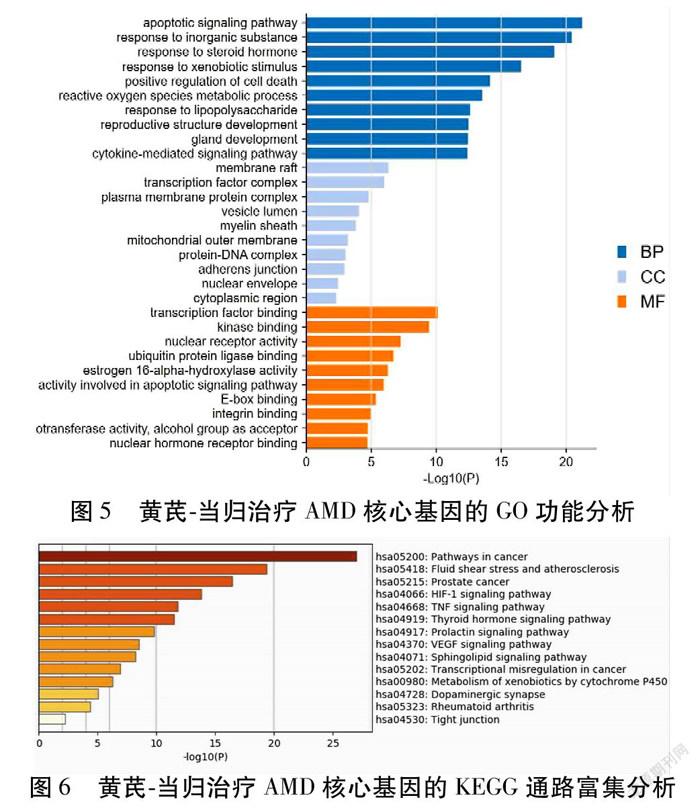
2.5 生物信息富集分析 对筛选出来的52个核心基因进行GO功能和KEGG通路富集分析。GO功能分析后得到1 064个条目,其中生物过程条目(Biological Process,BP)952个,主要与细胞凋亡、对类固醇激素的反应、活性氧代谢、对脂多糖的反应及细胞因子介导的信号通路等过程相关;细胞组分条目(Cellular Component,CC)36个,基因产物主要位于膜筏、转录因子复合物、质膜蛋白复合物、髓鞘、线粒体外膜等位置;分子功能(Molecular Function,MF)76个,主要与转录因子结合、激酶结合、核受体活性、泛素蛋白连接酶结合、雌激素16α-羟化酶活性、半胱氨酸型内肽酶活性与凋亡信号通路的关系等方面相关。将所得结果以GO分析的P值的-log10函数表示(P值越小,函数值越大)。见图5。P值越小表明富集程度越高。KEGG通路分析得到119条相关通路,列举了前14个集群中最具代表性的富集通路(以P值的-log10函数排序)。见图6。52个核心基因主要富集于癌症的通路、流体剪切力与动脉粥样硬化、HIF-1信号通路,此外还包括TNF信号通路、甲状腺激素信号通路、催乳素信号通路和VEGF信号通路等。
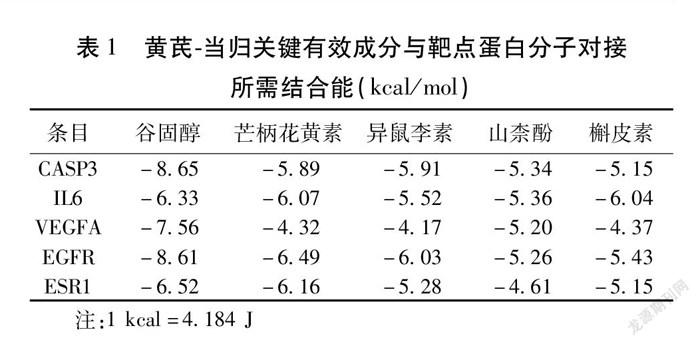
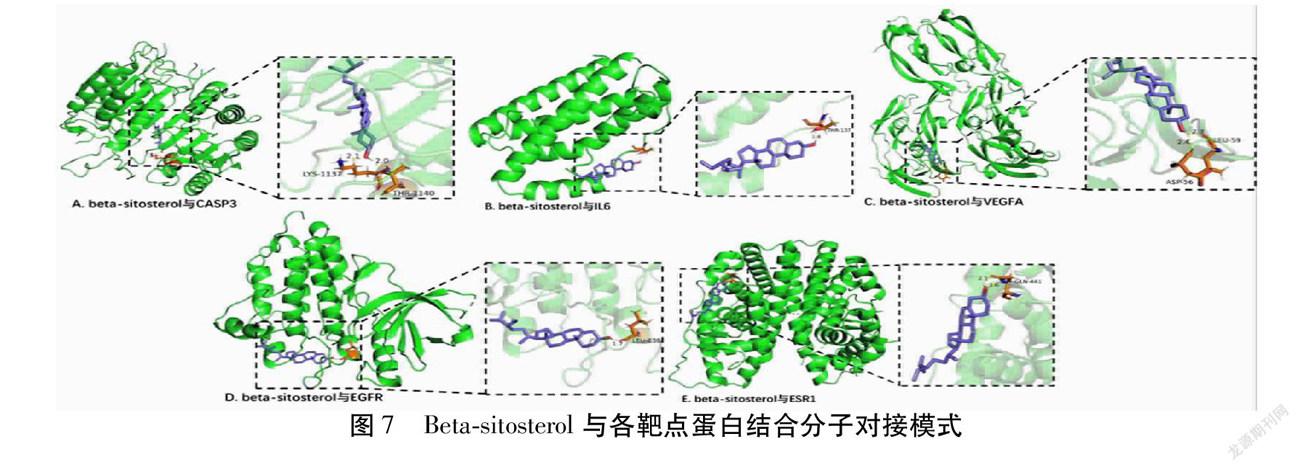
2.6 分子对接验证 利用AutoDock软件,选择PPI网络中节点度最高的5个靶点蛋白(CASP3、IL6、VEGFA、EGFR、ESR1)和“药物-关键化学成分-疾病”可视化网络中的5个关键有效成分(Quercetin、Kaempferol、Isorhamnetin、Beta-sitosterol、Formononetin)分别进行分子对接验证,在其最佳构象下靶点与有效成分结合所需的结合能。见表1。利用Pymol软件对分子对接结果进行可视化分析,图7即β-谷甾醇与各靶点蛋白分子对接的构象模式图。
3 讨论
中医学中没有“黄斑变性”这一病名,因其“外不见症,从内弊之”而被归于内障眼病范畴,《证治准绳·七窍门》中有相关症状描写:“目内外别无证候,但自视昏渺,蒙昧不清也”“视直物如曲,弓弦、界尺之类视之皆如钩。”中医从整体观出发,认为AMD的发生原因“有神劳、有血少、有元气弱、有元精亏而昏渺”,根本病机在于精、气、血的亏损,主要责之肾、脾、肝,是一个本虚标实的病理过程[11],治疗应以益气养血、扶正祛邪为原则。黄芪作为“补中益气之要药”、当归为“补血之圣药”,二者相须配伍,是补气生血的核心药对,《内外伤辨惑论》记载的当归补血汤即为黄芪、当归按一定的比例配伍而成,是“气血双补”代表方之一[12]。黄芪-当归在虚证的治疗中具有重要的意义,也是AMD临床组方的高频用药[13]。
本研究筛选出黄芪-当归治疗AMD的14个关键有效成分,包括槲皮素、山柰酚、芒柄花黄素、异鼠李素、联苯双酯、毛蕊异黄酮、豆甾醇及β-谷甾醇等。现代研究发现,以上有效成分,可分别通过对抗氧化应激或抑制新生血管生成等机制发挥对AMD的潜在治疗作用。槲皮素在体外能激活Keap1-Nrf2-ARE通路发挥对RPE细胞的抗氧化作用,还可以抑制促分裂原活化的蛋白激酶(Mitogenactivated Protein Kinase,MAPK)磷酸化和核因子κB信号通路,减轻RPE细胞的炎症反应,对AMD等老年性眼病有一定保护作用[14-16]。山柰酚则可调节活性氧(Reactive Oxygen Species,ROS)和超氧化物歧化酶(Superoxide Dismutase,SOD)活性,抑制H2O2(过氧化氢)诱导的RPE细胞内VEGF表达上调,还可通过靶向VEGF和胎盘生长因子(Placenta Growth Factor,PGF),抑制Src-AKT1-ERK1/2信号通路的激活,发挥抗新生血管的作用[17-18]。芒柄花黄素[19]和异鼠李素[20]可通过抑制H2O2诱导的RPE细胞和视网膜神经节细胞的凋亡,从而保护视网膜。此外,联苯双酯[21]、毛蕊异黄酮[22]在体外研究中也被证实具有一定抗氧化、抗炎等作用;豆甾醇[23]、β-谷甾醇[24]则可抑制体内VEGF表达,具有抗血管生成的活性。
由52個黄芪-当归与AMD共有的核心基因构建的PPI网络中,节点度较高的有CASP3、IL6、VEGFA、EGFR等,这些基因,极有可能是黄芪-当归治疗AMD的关键治疗靶点。胱天蛋白酶(Caspase)是细胞凋亡的核心,CASP3是细胞凋亡最重要的执行者,直接参与DNA断裂、染色质凝聚和凋亡小体的形成等过程[25]。研究发现,长期慢性炎症刺激下的RPE与脉络膜组织,其CASP3表达增加,凋亡途径被异常活化,直接导致了RPE细胞的死亡,是AMD的重要发病机制[26];IL-6是感染或外伤急性期反应的主要炎症诱导因子,研究发现IL6在干性AMD地图样萎缩患者和湿性AMD患者的血清中含量均明显升高[27-28],并且AMD患者眼底M1型巨噬细胞和小胶质细胞极化所分泌的IL6对CNV的发展有促进作用[29];VEGF是湿性AMD的主要致病因子,VEGFA是VEGF所有亚型中对血管内皮细胞增殖和分化影响最大、最重要的一个亚型,可以增加血管通透性、增强炎症反应并且诱导血管生成,AMD患者VEGF的表达提示了血-视网膜屏障的破坏和眼内病理性新生血管的生成[30],而敲除VEGFA基因可显著降低激光诱导的CNV模型小鼠的病变程度[31],因此抗VEGF治疗已成为湿性AMD的一线治疗方法;EGFR是表皮生长因子受体家族成员之一,吸烟是AMD的重要危险因素,研究表明香烟烟雾暴露可导致RPE细胞EGFR的高表达,而EGFR抑制剂的使用降低了香烟诱导下RPE分泌转化生长因子-β1及VEGF的水平,对AMD具有潜在治疗作用[32]。
GO功能与KEGG信号通路富集结果显示了黄芪-当归可能参与AMD的生物信号通路。GO富集结果显示BP主要涉及细胞凋亡、对类固醇激素的反应、活性氧代谢及对脂多糖的反应等生物途径。细胞凋亡和氧化应激是AMD发病的重要机制,其异常激活可破坏眼底微环境稳态、诱发RPE细胞及光感受器的死亡;类固醇激素具有抗炎、抗渗透和血管抑制作用,临床常用于治疗黄斑水肿的皮质类固醇类药物包括曲安奈德、地塞米松等,可以通过降低炎性因子和VEGF基因在眼内的表达水平,减轻细胞免疫反应、降低炎症血管的渗透性,从而实现稳定细胞膜,增强血-视网膜屏障的功能[33-34];脂多糖是革兰氏阴性菌外表面的一种成分,可诱导RPE内细胞因子、VEGF、肿瘤坏死因子受体(Tumor Necrosis Factor Receptor,TNFR)和肿瘤坏死因子相关凋亡诱导配体(TNF-related Apoptosis-inducing Ligand,TRAIL)的表达,通过氧化应激和核因子κB介导的炎症等机制导致急性眼部炎症,引起葡萄膜炎和不同程度的视网膜变性,常被用作AMD体外模型的制作[35]。
KEGG富集结果显示,治疗过程中可能涉及的信号通路包括癌症的通路、流体剪切力与动脉粥样硬化、缺氧诱导因子-1(Hypoxia-inducible Factor-1,HIF-1)信号通路、TNF信号通路及VEGF信号通路等。其中HIF-1调控近百种靶基因,涉及缺氧代偿性反应、免疫反应、新生血管的生成调节、能量代谢等多方面,以增加组织的缺氧耐受力,使机体更好地适应低氧环境,VEGF信号通路是血管生成的关键途径,AMD患者眼底缺血缺氧的状态可同时激活HIF-1信号通路与VEGF信号通路,诱导对HIF-1α和VEGF的表达,刺激CNV的生成[36-38];肿瘤坏死因子(Tumor Necrosis Factor,TNF)是重要的炎症介质,TNF-α在视网膜上的表达可通过刺激TNFR1和肿瘤坏死因子受体相关因子2[Tumor Necrosis Factor(TNF) Receptor Associated Factor 2,TRAF2],激活蛋白激酶Cδ/JNK1/2/c-Jun信号通路诱导细胞间黏附分子-1(Intercelluar Adhesion Molecule-1,ICAM-1)的表达,从而介导AMD等视网膜炎性疾病[39]。
本次分子对接选择了PPI网络中节点度最高的5个靶点蛋白与“药物-关键化学成分-疾病”可视化网络中的5个关键有效成分分别进行验证。结合能是衡量分子间是否能自发形成稳定结构的指标,结合能小于0,说明二者可以自发结合,最低结合能越小说明分子与靶点蛋白间结合越好,可形成相对稳定的结构,当结合能小于-5.0 kcal/mol时表示结合活性较好[40]。本次分子对接结果显示,5个有效成分与靶点蛋白的最低结合能大部分都小于-5 kcal/mol,相互间可形成能量低、结构稳定、结合活性较高的构象,展现出了良好的结合能力。
综上所述,本研究通过网络药理学与分子对接方法,分析了中药经典药对黄芪-当归参与AMD治疗多成分、多靶点、多通路的可能作用机制,为黄芪-当归治疗AMD提供了理论依据,也为更深入的实验研究奠定了基础。
参考文献
[1]Song P,Du Y,Chan KY,et al.The national and subnational prevalence and burden of age-related macular degeneration in China[J].J Glob Health,2017,7(2):020703.
[2]徐歡,葛琳,周美玲,等.湿性年龄相关性黄斑变性的新药研发进展[J].中国新药杂志,2019,28(23):2818-2824.
[3]丁小燕,王志容,孙立梅.创造向未来:湿性AMD治疗进展及展望[J].中华实验眼科杂志,2019,37(1):63-68.
[4]高学敏.中药学[M].北京:中国中医药出版社,2002:502-540.
[5]朱嘉欢,黄小平,邓常清.黄芪和当归的主要活性成分配伍促进衰老造血干细胞增殖作用的研究[J].中草药,2019,50(1):111-119.
[6]黄斌,刘仍海,刘薇,等.单味中药抗衰老研究进展[J].中华中医药学刊,2016,34(12):2874-2877.
[7]彭熙炜,阎卉芳,黄娟,等.黄芪-当归配伍对大鼠血管内膜增生模型炎性反应的影响[J].中华中医药杂志,2019,34(2):580-584.
[8]Zhou Z,Chen B,Chen S,et al.Applications of Network Pharmacology in Traditional Chinese Medicine Research[J].Evid Based Complement Alternat Med,2020,2020:1646905.
[9]Hopkins AL.Network pharmacology:the next paradigm in drug discovery[J].Nat Chem Biol,2008,4(11):682-690.
[10]Ru J,Li P,Wang J,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].J Cheminform,2014,6:13.
[11]金明.AMD中医病因机制认识与现代研究相关性[J].中国中医眼科杂志,2016,26(3):141-143.
[12]方欢乐,张慧,陶炎炎,等.黄芪-当归药对研究进展[J].海南医学院学报,2020,26(8):633-636,640.
[13]秦程遥.基于中医传承辅助平台的治疗年龄相关性黄斑变性的组方规律分析[D].南京:南京中医药大学,2017.
[14]Bungau S,Abdel-Daim MM,Tit DM,et al.Health Benefits of Polyphenols and Carotenoids in Age-Related Eye Diseases[J].Oxid Med Cell Longev,2019,2019:9783429.
[15]Zhu Q,Liu M,He Y,et al.Quercetin protect cigarette smoke extracts induced inflammation and apoptosis in RPE cells[J].Artif Cells Nanomed Biotechnol,2019,47(1):2010-2015.
[16]Cheng SC,Huang WC,S Pang JH,et al.Quercetin Inhibits the Production of IL-1β-Induced Inflammatory Cytokines and Chemokines in ARPE-19 Cells via the MAPK and NF-κB Signaling Pathways[J].Int J Mol Sci,2019,20(12):2957.
[17]Du W,An Y,He X,et al.Protection of Kaempferol on Oxidative Stress-Induced Retinal Pigment Epithelial Cell Damage[J].Oxid Med Cell Longev,2018,2018:1610751.
[18]Xu XH,Zhao C,Peng Q,et al.Kaempferol inhibited VEGF and PGF expression and in vitro angiogenesis of HRECs under diabetic-like environment[J].Braz J Med Biol Res,2017,50(3):e5396.
[19]Jia WC,Liu G,Zhang CD,et al.Formononetin attenuates hydrogen peroxide(H2O2)-induced apoptosis and NF-κB activation in RGC-5 cells[J].Eur Rev Med Pharmacol Sci,2014,18(15):2191-2197.
[20]Wang J,Gong HM,Zou HH,et al.Isorhamnetin prevents H2O2 induced oxidative stress in human retinal pigment epithelial cells[J].Mol Med Rep,2018,17(1):648-652.
[21]Gu X,Jiang Y,Chen J,et al.Synthesis and biological evaluation of bifendate derivatives bearing acrylamide moiety as novel antioxidant agents[J].Eur J Med Chem,2019,162:59-69.
[22]Liu B,Zhang J,Liu W,et al.Calycosin inhibits oxidative stress-induced cardiomyocyte apoptosis via activating estrogen receptor-α/β[J].Bioorg Med Chem Lett,2016,26(1):181-185.
[23]Michelini FM,Lombardi MG,Bueno CA,et al.Synthetic stigmasterol derivatives inhibit capillary tube formation,herpetic corneal neovascularization and tumor induced angiogenesis:Antiangiogenic stigmasterol derivatives[J].Steroids,2016,115:160-168.
[24]Sharmila R,Sindhu G.Modulation of Angiogenesis,Proliferative Response and Apoptosis by β-Sitosterol in Rat Model of Renal Carcinogenesis[J].Indian J Clin Biochem,2017,32(2):142-152.
[25]蘇胜有.Caspase家族与神经细胞凋亡的研究进展[J].世界最新医学信息文摘(连续型电子期刊),2019,19(80):76-77.
[26]Gao J,Cui JZ,To E,et al.Evidence for the activation of pyroptotic and apoptotic pathways in RPE cells associated with NLRP3 inflammasome in the rodent eye[J].J Neuroinflammation,2018,15(1):15.
[27]Krogh Nielsen M,Subhi Y,Molbech CR,et al.Systemic Levels of Interleukin-6 Correlate With Progression Rate of Geographic Atrophy Secondary to Age-Related Macular Degeneration[J].Invest Ophthalmol Vis Sci,2019,60(1):202-208.
[28]章玮,肖云,高晓唯,等.血清TGF-β1和IL-6与湿性年龄性黄斑变性相关研究[J].中国实用眼科杂志,2014,32(4):428-431.
[29]Xu J,Tu Y,Wang Y,et al.Prodrug of epigallocatechin-3-gallate alleviates choroidal neovascularization via down-regulating HIF-1α/VEGF/VEGFR2 pathway and M1 type macrophage/microglia polarization[J].Biomed Pharmacother,2020,121:109606.
[30]闫明.年龄相关性黄斑变性的相关机制与临床研究[D].广州:南方医科大学,2018.
[31]Askou AL,Alsing S,Benckendorff J,et al.Suppression of Choroidal Neovascularization by AAV-Based Dual-Acting Antiangiogenic Gene Therapy[J].Mol Ther Nucleic Acids,2019,16:38-50.
[32]Park GB,Kim D.Cigarette smoke-induced EGFR activation promotes epithelial mesenchymal migration of human retinal pigment epithelial cells through regulation of the FAK-mediated Syk/Src pathway[J].Mol Med Rep,2018,17(3):3563-3574.
[33]禡红燕,陈松.老年性黄斑变性脉络膜新生血管的药物治疗研究进展[J].中华眼底病杂志,2004,20(5):331-334.
[34]秦艳,游志鹏,胡娇莉,等.糖尿病性黄斑水肿的药物治疗进展[J].眼科新进展,2018,38(3):281-284,289.
[35]Ozal SA,Turkekul K,Gurlu V,et al.Esculetin Protects Human Retinal Pigment Epithelial Cells from Lipopolysaccharide-induced Inflammation and Cell Death[J].Curr Eye Res,2018,43(9):1169-1176.
[36]滑雅娜,鲁芙爱,王永福.HIF-1相关信号通路及其在自身免疫性疾病中作用[J].中国免疫学杂志,2019,35(8):1013-1017.
[37]Ibuki M,Shoda C,Miwa Y,et al.Therapeutic Effect of Garcinia cambogia Extract and Hydroxycitric Acid Inhibiting Hypoxia-Inducible Factor in a Murine Model of Age-Related Macular Degeneration[J].Int J Mol Sci,2019,20(20):5049.
[38]Xu J,Tu Y,Wang Y,et al.Prodrug of epigallocatechin-3-gallate alleviates choroidal neovascularization via down-regulating HIF-1α/VEGF/VEGFR2 pathway and M1 type macrophage/microglia polarization[J].Biomed Pharmacother,2020,121:109606.
[39]Lee IT,Liu SW,Chi PL,et al.TNF-α mediates PKCδ/JNK1/2/c-Jun-dependent monocyte adhesion via ICAM-1 induction in human retinal pigment epithelial cells[J].PLoS One,2015,10(2):e0117911.
[40]吳晨,魏昀,葛珊,等.夏天无对新型冠状病毒肺炎的网络药理学和分子对接研究[J].中医药信息,2020,37(3):104-111.
(2020-07-22收稿 本文编辑:王明)
