麻子仁丸治疗术后肠梗阻的网络药理研究
2022-06-02钱嘉惠周春宇杨成城张少辉张栋张涛马亦湘
钱嘉惠 周春宇 杨成城 张少辉 张栋 张涛 马亦湘




摘要 目的:通过网络药理学预测麻子仁丸治疗术后肠梗阻(POI)作用靶点,探讨其多成分-多靶点-多通路的潜在作用机制。方法:通过中药系统药理学数据库与分析平台(TCMSP)收集麻子仁丸中药化学成分,经口服生物利用度(OB)、类药性(DL)筛选得到药物的有效成分,并进行有效成分靶点预测;同时从GeneCards、OMIM、DisGeNet数据库检索POI相关靶点;取交集靶点后,使用Cytoscape 3.7.2软件构建成分-靶点互作网络;利用String数据库绘制靶点蛋白-靶点蛋白相互作用网络;并对核心靶點和核心成分分子对接;最后利用Metascape数据库进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)通路富集分析。结果:本研究共收集到POI相关靶点405个,麻子仁丸活性成分140个,涉及治疗POI靶点75个;GO生物过程分析显示,涉及对无机物的反应、对有害物质的反应、药物细胞应答、细胞因子介导的信号传导途径、对脂多糖的反应、对氧化应激的反应、对细菌源分子的反应、激酶活性的正调控、转移酶活性的正调控等。KEGG分析结果显示,涉及PI3K-AKT信号通路、TNF通路、HIF-1通路、IL-17通路、ErbB通路等信号通路。结论:麻子仁丸可通过潜在的多途径、多靶点、多通路改善术后肠梗阻炎症反应、调节肠黏膜免疫及肠道微循环等。
关键词 麻子仁丸;术后肠梗阻;网络药理学;分子对接;作用机制;核心靶点;通路分析;中药
Maziren Pills in Treatment of Postoperative Ileus by Network Pharmacology
QIAN Jiahui1,ZHOU Chunyu1,YANG Chengcheng2,ZHANG Shaohui2,ZHANG Dong2,ZHANG Tao1,MA Yixiang1
(1 Beijing University of Chinese Medicine,Beijing 100105,China; 2 General Surgery Department,Dongfang Hospital,Beijing University of Chinese Medicine,Beijing 100078,China)
Abstract Objective:To predict the targets of Maziren Pills in the treatment of postoperative ileus(POI) by network pharmacology and explore its multi-component,multi-target,and multi-pathway mechanism.Methods:The chemical components of Maziren Pills were collected from the Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform(TCMSP),and the effective components were obtained according to oral bioavailability(OB) and drug-likeness(DL),followed by the prediction of targets of the effective components.POI-related targets were retrieved from GeneCards,OMIM,and DisGeNet.After the common targets were obtained,the component-target interaction network was constructed by Cytoscape 3.7.2.The protein-protein interaction(PPI) network was plotted by using String.The core targets were docked to core components.Metascape was used for Gene Ontology(GO) and Kyoto Encyclopedia of Genes and Genomes(KEGG) enrichment analyses.Results:A total of 405 POI-related targets,140 active components of Maziren Pills,and 75 therapeutic targets were obtained.As revealed by GO enrichment analysis,biological processes involved response to inorganic substance,response to hazardous substance,cellular response to the drug,cytokine-mediated signaling pathway,response to lipopolysaccharide,response to oxidative stress,response to molecule of bacterial origin,positive regulation of kinase activity,positive regulation of transferase activity,etc.As revealed by KEGG enrichment analysis,pathways involved the PI3K-AKT signaling pathway,TNF signaling pathway,HIF-1 signaling pathway,IL-17 signaling pathway,ErbB signaling pathway,etc.Conclusion:Maziren Pills can improve postoperative intestinal obstruction inflammation,regulate intestinal mucosal immunity and intestinal microcirculation through multiple potential pathways,multiple targets and multiple pathways.
Keywords Maziren Pills; Postoperative ileus; Network pharmacology; Molecular docking; Mechanism of action; Core targets; Pathway analysis; Chinese medicine
中图分类号:R285;R256.3;R259文献标识码:Adoi:10.3969/j.issn.1673-7202.2022.07.007
术后肠梗阻(Postoperative Ileus,POI)是腹部术后常见的医源性并发症,其特征是胃肠运动暂时受到抑制[1],表现为腹痛、恶心、厌食、呕吐,以及无法顺利通过大便及胃肠胀气。POI由神经源性、药理学、炎症协同机制引起,主要原因与肠道操作诱导的肠肌层局部炎症有关[2],术后疼痛、阿片受体药物的应用、麻醉用药、水电解质紊乱加重了这一过程,最终导致胃肠动力减弱和肠壁水肿[3]。POI的第一阶段大约发生于手术开始到术后3 h内,主要由神经反射机制介导;第二阶段始于术后3~4 h,持续时间长,主要由炎症机制介导,此期对胃肠动力影响较大[4],是临床防治的重点和难点。随着康复外科的迅速发展,POI延长患者住院时间而增加住院费用[5],因此被认为是术后康复的重要环节。
麻子仁丸又名脾约丸,具有润肠泻热、行气通便之功效。临床主应用于治疗年老体弱、津枯血亏以及脾气虚弱之便秘,治疗功能性便秘、肛肠科手术后便秘等疗效确切[6]。早期的研究认为麻子仁丸在腹腔粘连动物模型中,具有促进肠系膜微循环、改善腹腔粘连的作用[7]。并能有效治疗阿片类药物所导致的胃肠功能障碍[8]。POI的中医病机为手术操作所致脏腑气机不畅,而术后病机虚实夹杂,常不耐峻下攻伐,取其缓下之意,麻子仁丸行气润肠从而达到治疗效果。目前对POI的治疗尚未达成共识,而中医药的应用为POI的治疗提供新的思路和方法。本研究借助网络药理学,对麻子仁丸治疗POI潜在机制进行挖掘,为中医药治疗POI提供新的理论支持。
1 资料与方法
1.1 麻子仁丸活性成分收集与筛选 在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP)中检索麻子仁(又名火麻仁)、厚朴、枳实、杏仁、大黄、赤芍所有化学成分。初步设定条件为口服生物利用度(Oral Bioavailability,OB)≥30%,类药性(Drug Likeness,DL)≥0.18,对成分库中的化学成分进行筛选。
1.2 POI及化合物相关靶点预测与筛选 通过GeneCards、OMIM、DisGeNET等在线数据库,以“Postoperative ileus”为关键词查询POI相关性靶标;利用Drugbank数据库查询活性成分的靶点。Drugbank未能查询到靶点的化学成分,下载2D结果,通过Swiss Target Prediction数据库进行靶点预测;将疾病、成分靶点分别去重并汇总,并导入Uniprot数据库,标准化命名。
1.3 化合物-作用靶点网络构建与分析 获得成分靶点与POI靶点之后,用R语言取二者交集靶点,利用Cytoscape 3.7.2网络编辑分析软件,构建化合物-疾病靶点可视化网络。
1.4 蛋白质-蛋白质相互作用网络构建 为寻找疾病治疗有重要意义的蛋白靶点,需研究蛋白之间的相互作用,构建蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络。将交集靶点蛋白上传至String数据库,置信度评分值设置为>0.700,获得PPI信息,通过Cytoscape软件绘制PPI网络。并依据PPI次数,通过R语言作图,确定核心蛋白。
1.5 分子对接验证 从Pubchem数据库(http://zinc.docking.org/)查询“1.3”中关键成分结构,优化结构并保存为mol格式。从PDB数据库下载核心靶点的3D结构,保存为PDB格式,使用PyMol软件删除蛋白结构的水分子和小分子配体,并导入AutoDockTools进行加氢等预处理。将活性成分和靶點蛋白均转换成pdbqt格式文件。最后运行AutoDockTools对活性成分和靶点蛋白分别进行对接,保存最低结合能数据作为分子对接的结果。结合能越低,表明活性成分与靶蛋白的结合力越强。一般认为结合能≤-5.0 kJ/mol的药物分子与靶点具有较好的结合活性。
1.6 富集分析 将交集靶点导入Metascape在线分析网站,设定研究物种为人类,进行基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。
2 结果
2.1 麻子仁丸活性成分收集与筛选 使用TCMSP数据库,以DL≥0.18,OB≥30%为化合物的初步筛选条件,补充纳入厚朴成分厚朴酚(Magnolol)、和厚朴酚(Honokiol)。其中枳实22个、杏仁19个、厚朴5个,麻子仁6个,大黄16个,柴胡29个,去除重复后,共收集到活性成分88个。DL数值前15的基本信息见表1。
2.2 靶点筛选 利用Drugbank、Swiss Target Prediction数据库,枳实113个、杏仁64个、厚朴174个、麻子仁105个、大黄58个、赤芍89个,去除重复靶点后,共检索到靶点315个;通过GeneCards、OMIM、DisGeNet在线数据库,以“Postoperative ileus”为关键词查询相关靶标,共获得POI相关靶点405个,获得75个麻子仁丸-POI交集靶点。
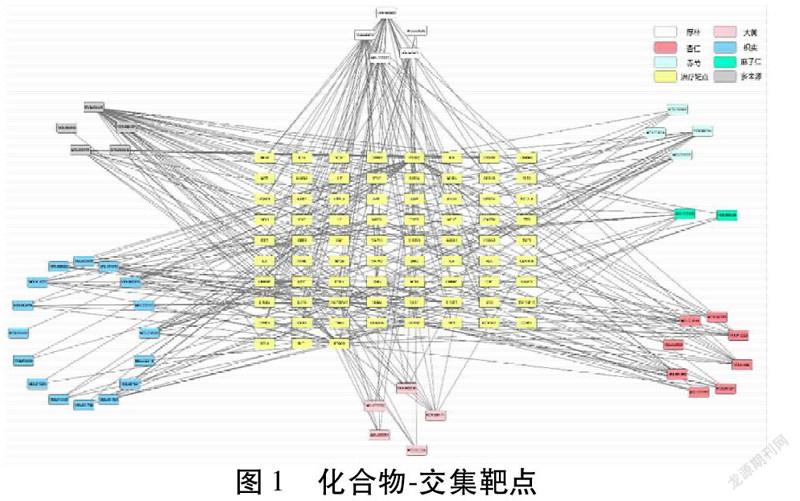
2.3 化合物-作用靶点网络构建与分析 运用Cytoscape软件构建化合物-交集靶点网络,网络中包含120个节点,329条边。度数(Degree)代表和节点相连的边数量。结果显示,Degree排名前5的化合物为:木犀草素(MOL000006,Degree=32)、和厚朴酚(MOL005955,Degree=24)、厚朴酚(MOL000210,Degree=23)、黄芩苷(MOL002714,Degree=13)、β-谷甾醇(MOL000358,Degree=13),以上化合物在药效中可能贡献较大,在治疗中发挥了主要作用。见图1。
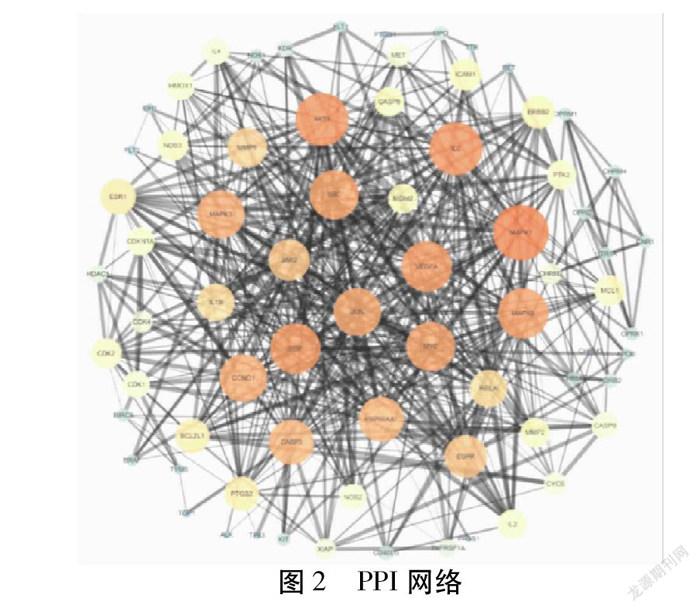
2.4 PPI网络 将交集靶点导入String数据库,获得PPI信息,利用Cytoscape软件建立可视化PPI网络。图中靶点大小、颜色用于反映Degree(PPI次数)值的大小,节点越大对应的Degree值越大,颜色由蓝变黄色;边粗细用于反映Combine Score的大小,Combine Score数值越大边越粗。分析结果显示共526条关系线条,平均Degree为14,Degree值大于30的靶点共8个(MAPK1、AKT1、IL-6、EGF、MAPK8、VEGFA、MYC、SRC)。见图2。Degree值前30见图3。
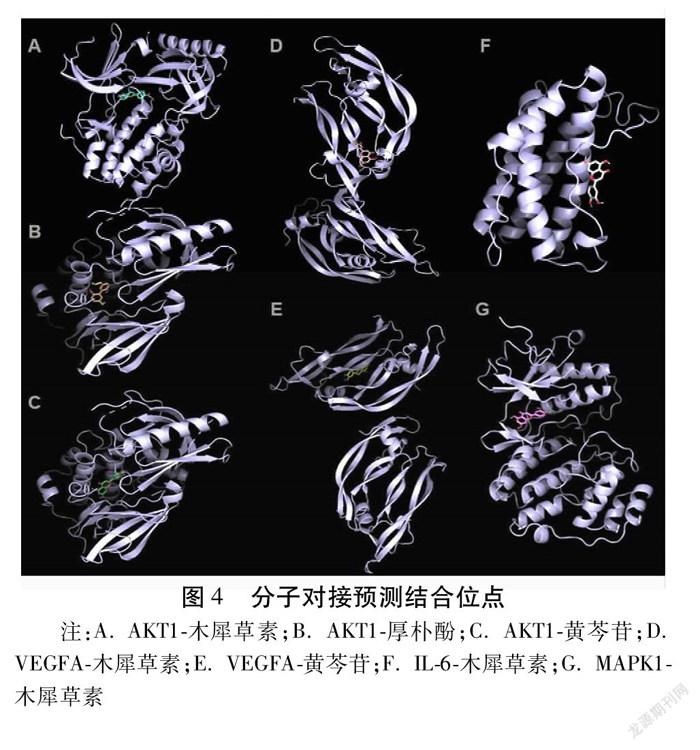
2.5 分子对接验证 将“2.4”中筛选得到部分核心靶点(MAPK1、AKT1、IL-6、VEGFA)与“2.3”中筛选得到的部分核心成分进行分子对接。AKT1与黄芩苷、木犀草素、厚朴酚,木犀草素与白细胞介素-6(IL-6)、MAPK1,VEGFA与黄芩苷、木犀草素结合能均小于-5.0 kJ/mol,结合能绝对值最大的为VEGFA与木犀草素、黄芩苷,各分子对接预测结合能见表2,预测结合位点见图4。以上结果间接证明,麻子仁丸活性主要成分可对核心靶点发挥调控作用。
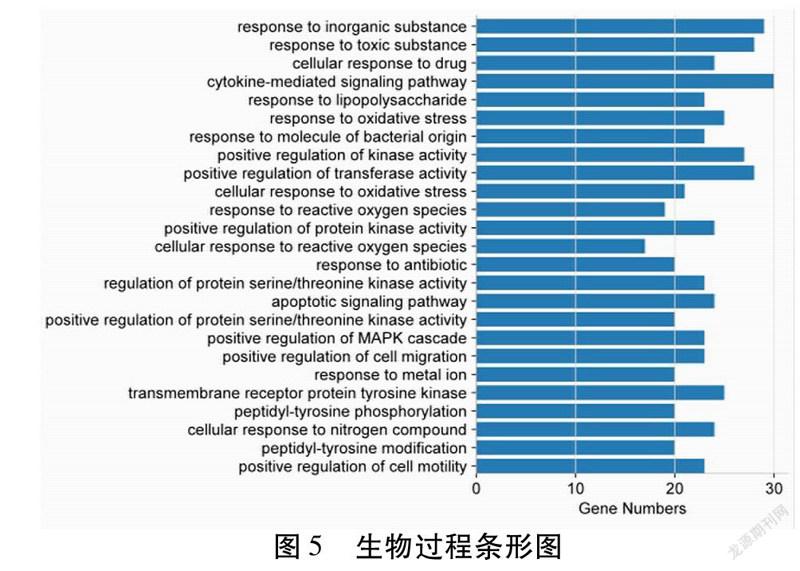
2.6 GO生物功能分析 为进一步阐明三味中药的作用机制,采用Metascape在线数据库对交集靶点进行生物过程、KEGG分析。分析结果显示,生物过程涉及563个条目,包括对无机物的反应、对有害物质的反应、药物细胞应答、细胞因子介导的信号转导途径、对脂多糖的反应、对氧化应激的反应、对细菌源分子的反应、激酶活性的正调控、转移酶活性的正调控、对氧化应激的细胞应答等。KEGG分析结果显示,涉及PI3K-AKT、TNF、HIF-1、IL-17、ErbB等信号通路。见图5~6。
3 讨论
POI属中医“肠结”病范畴。结合近年来临床证候研究成果过,该病的中医病机考虑为手术操作所致的络脉损伤,气滞血瘀导致脏腑气机失常,腑气不通,病位于大肠,在脏肝脾。麻子仁(又名火麻仁)中的脂肪油能刺激肠黏膜并促进肠分泌,并减少水分的吸收,使蠕动加快,从而发挥泻下作用,是为君药。杏仁富含油脂而质润[9],二者配伍起到行气润肠通便的作用。大黄、枳实、厚朴组成小承气汤轻下热结为佐。现代药理学研究证实三者均具有促进调节胃肠运动的功能。枳实提高胃底平滑肌张力,促进胃排空;提高小肠峰电活动,加强平滑肌的收缩强度[10]。莫黎等[11]认为枳实通降颗粒可促进结直肠肿瘤胃肠道手术后患者胃肠功能恢复,并对术后早期炎性肠梗阻有一定的防治作用。实验研究表明,大黄素能触发机体内乙酰胆碱的释放,从而促进肠道平滑肌收缩及肠道的蠕动功能[12]。厚朴皮提取物和厚朴酚可提高小鼠的胃排空率和肠道推进率,对胃肠蠕动的积极作用可能与5-羟色胺3受体和M乙酰胆碱受体有关[13]。3种药物配伍从而起到破气除胀、消积导滞的作用。赤芍为我国传统的活血化瘀类中药,现代药理学证实赤芍具有抗凝,调节缺血性损伤以及微循环,抗氧化、抗炎等作用[14]。配伍以上达到“治邪气腹痛,除血痹,破坚积”的疗效。
3.1 麻子仁丸有效分子治疗POI具有多途径的潜在作用
本研究共筛选麻子仁丸成分88个,POI潜在作用靶点75个。经“活性成分-疾病靶点”网络分析可知,木犀草素、和厚朴酚、厚朴酚、黄芩苷等成分可能发挥重要作用。
3.1.1 调控炎症反应 肥大细胞激活诱导白细胞浸润,加速POI的肌层炎症,是POI发生的重要机制[15-16]。木犀草素(Luteolin)抑制肥大细胞介导的炎症反应,并通过作用核因子κB、Toll样受体(Toll-like Receptor,TLR)4信号通路,抑制相关炎症介质的释放从而发挥抗炎症作[17]。和厚樸酚(Honokiol)抑制核因子κB调节的炎症基因产物[如:白细胞介素(Interleukin,IL)-8、单核细胞趋化蛋白(Monocyte Chemoattractant Protein,MCP)-1、肿瘤坏死因子(Tumor Necrosis Factor,TNF)-α、细胞间黏附分子(Intercelluar Adhesion Molecule,ICAM)-1和基质金属蛋白酶(Matrix Metalloproteinase,MMP)-9等],从而参与抑制炎症的发生[18]。黄芩苷通过抑制核因子κB的活性以及其下游相关的细胞因子和趋化因子,起抗氧化和减轻受伤组织的氧化应激反应的作用[19]。
3.1.2 调控胃肠动力 已知环氧合酶(Cyclooxygenase,COX-2)和类前列腺素的产生是诱导POI的重要机制。肠道操作可触发炎症转录因子的快速激活和炎症介质的上调,诱导肠肌层COX-2分子上调,促使胃肠道转运能力的降低[20]。厚朴酚及和厚朴酚均可显著抑制COX-2活性,从而抑制前列腺素生物合成。另外厚朴酚双向调节胃肠运动的部分机制是通过活化Ach和5-羟色胺实现的。厚朴酚还具有良好的抗菌、抗氧化、缓解急性炎性疼痛的作用[21]。
3.1.3 肠道黏膜损伤 手术损伤对肠道屏障造成一定程度上的损坏,并改变肠道通透性,而这一过程将会促使肠道微生物移位,进一步加重微生物群的暴露,激活免疫反应。在卵清蛋白诱导的小鼠食物过敏模型中,黄芩苷可促进密封蛋白和ZO-1的表达,从而对肠道黏膜损伤具有保护作用[22]。
分析以上可得,以上麻子仁丸活性成分可能通过抗炎、抗氧应激、调节胃肠运动、保护肠黏膜等方面发挥疗效。
3.2 麻子仁丸治疗POI具有调节多靶点的潜在作用 麻子仁丸与POI共同靶点共75个,PPI网络分析结果表明MAPK1、AKT1、IL-6、MAPK8、VEGFA等靶点在治疗中起关键作用。促分裂原活化的蛋白激酶(Mitogenactivated Protein Kinase,MAPK)1、MAPK8是MAPK激酶信号转导途径的组成部分,MAPK通过控制核因子κB的活化,在炎症介质和酶产生的调节中很重要[23]。IL-6是一种多效炎症介质,参与中性粒细胞募集并诱导趋化因子的产生,在急性炎症反应中处于核心地位[24]。IL-6是POI发病中的主要细胞因子[25]。蛋白激酶B(Protein Kinase B,AKT)1是丝氨酸/苏氨酸蛋白激酶之一,参与调节细胞生长和代谢,增殖及迁移,以及血管生成等[26]。血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)A诱导血管内皮细胞增殖与迁移,在生理病理情况下均对血管生成及维持血管稳定都具有重要意义[27];AKT促进VEGF表达,并调节内皮型一氧化氮合酶磷酸化激活生成一氧化氮,诱导血管再生及血管舒张[26]。
3.3 麻子仁丸治疗POI具有调节多通路的潜在作用
KEGG分析结果显示,涉及PI3K-AKT、HIF-1、ErbB、TNF、IL-17等信号通路。
3.3.1 潜在作用PI3K-AKT、TNF等通路调节炎症反应 尽管抑制性肾上腺素能神经信号传递大多在手术结束时结束,但POI的炎症反应是造成持续的胃肠动力异常的原因[25],而肠肌层肥大细胞在肠操作引起的炎症中起重要作用[16]。磷脂酰肌醇-3-激酶(Phosphatidylinositol-3-Kinase,PI3K)/AKT通过产生脂质第二信使调节多种生物过程,起着信号转导的作用。是控制细胞生长,迁移,增殖和代谢的重要节点。在炎症过程中干扰并促进激活NF-κB导致下游炎症介质的表达[28]。肿瘤坏死因子(Tumor Necrosis Factor,TNF)是一种多效的细胞因子,在炎症及宿主御防、细胞增殖和生存中发挥重要作用[29]。TNF-α通过依赖于促分裂原活化的蛋白激酶(Mitogenactivated Protein Kinase,MAPK)的磷酸化上调肥大细胞上ICOSL(可诱导共刺激配体)的表达,从而抑制肥大细胞脱颗粒[30]。
3.3.2 潜在作用IL-17、ErbB信号通路调节肠黏膜免疫及肠屏障修复 手术损伤对肠道屏障造成一定程度上的损坏,改变肠道通透性。Th17细胞产生细胞因子IL-17A,IL-17F、IL-22,它们通过诱导上皮细胞产生抗微生物肽,对肠黏膜免疫中起着重要作用,还可通过诱导趋化因子聚集炎性细胞[31]。IL-17在宿主对抗微生物的防御以及炎症疾病的发展起着至关重要的作用,并能与促有丝分裂生长因子成纤维细胞生长因子(Fibroblast Growth Factor,FGF)2协同刺激肠上皮细胞增殖和愈合[32]。IL-17C是IL-17家族成员之一,主要由上皮细胞产生的,可直接促进结肠上皮细胞紧密连接分子的表达,在维持肠屏障功能中发挥关键作用[33]。另外术后吻合口瘘同样为重要康复风险。ErbB家族包括原型成员表皮生长因子(Epidermal Growth Factor,EGF)受体(Receptor,R)/ErbB1以及ErbB2、ErbB3、ErbB4[34]。EGFR刺激增殖并减少细胞因子诱导的凋亡,并促进伤口愈合[35];已知COX-2在肠上皮细胞和固有层(肌层)白细胞中均有表达,炎症介质(如TNF)激活ErbB4,并由PI3K/AKT途径介导进而促进肠上皮细胞COX-2的表达,与肠肌层中COX-2减弱胃肠动力不同[20],COX-2还可促进结肠上皮细胞生长及存活,在损伤后保护、修复黏膜功能方面起着重要作用[36]。以上矛盾的结果解释了非甾体抗炎药(Nonsteroidal Anti-inflammatory Drugs,NSAIDs)虽能减轻术后炎症及肠梗阻的发生,但同时增加了术后吻合口瘘的风险。
3.3.3 潜在调节HIF-1、PI3K/AKT信号通路调节血管再生、肠道微循环 肠道操作诱导的局部炎症反应是POI重要发病机制,腹腔手术引起的组织缺血、缺氧是炎症发展的重要因素。缺氧诱导因子(Hypoxia-inducible Factor,HIF)-1作为PI3K/AKT通路的下游信号,与环境中的氧气浓度密切相关。大多数促血管生成因子(VEGF,TNF-α和IL-6等)和促血管生成酶(诱生型一氧化氮合酶、MMP-9和COX-2)受HIF-1调节[37]。
综上所述,麻子仁丸治疗POI的潜在机制可能与抗炎,调节恢复损伤、肠道微循环、调节肠黏膜免疫、促进胃肠动力有关。本研究采用分子对接方法对核心靶点与关键成分进行对接验证,间接证实了本研究预测的可靠以及准确性。本研究的不足之处为设定中药有效成分筛选条件(OB≥30%,DL≥0.18)合理性有待证实。中药药效成分大多生物利用度低,可经肠道菌群相互作用,促进吸收进而调节人體相关功能。除此之外,肠道菌群对POI的启动免疫、脑-肠互动、炎症、调节肠道内分泌、生物屏障等方面起着重要作用,因此肠道菌群对干预POI有着广泛的研究前景,有待进一步深入研究。
参考文献
[1]Stakenborg N,Gomez-Pinilla PJ,Boeckxstaens GE.Postoperative Ileus:Pathophysiology,Current Therapeutic Approaches[J].Handb Exp Pharmacol,2017,239:39-57.
[2]Bragg D,El-Sharkawy AM,Psaltis E,et al.Postoperative ileus:Recent developments in pathophysiology and management[J].Clin Nutr,2015,34(3):367-376.
[3]Harnsberger CR,Maykel JA,Alavi K.Postoperative Ileus[J].Clin Colon Rectal Surg,2019,32(3):166-170.
[4]Stakenborg N,Gomez-Pinilla PJ,Boeckxstaens GE.Postoperative Ileus:Pathophysiology,Current Therapeutic Approaches[J].Handb Exp Pharmacol,2017,239:39-57.
[5]Venara A,Neunlist M,Slim K,et al.Postoperative ileus:Pathophysiology,incidence,and prevention[J].J Visc Surg,2016,153(6):439-446.
[6]熊周芳.麻仁軟胶囊药理分析和合理应用解析[J].当代医学,2016,22(22):10-11.
[7]王德明.麻仁丸抗腹部手术后腹腔粘连作用的研究[J].药学进展,2000,24(1):45-47.
[8]李秀荣,李慧杰,杨梅.麻子仁丸加减方治疗阿片类药物所致便秘[J].中国实验方剂学杂志,2012,18(22):312-314.
[9]范海洲.浅谈杏仁的药性及功效[J].湖北中医杂志,2016,38(5):67-68.
[10]王梁凤,柳小莉,李慧婷,等.基于网络药理学的枳实挥发油治疗慢性传输型便秘的机制研究[J].中国中药杂志,2020,45(8):1909-1917.
[11]莫黎,何永恒,康安定,等.枳实通降颗粒对结直肠肿瘤患者术后胃肠功能恢复及术后早期炎性肠梗阻防治作用的双中心前瞻性研究[J].中医杂志,2017,58(20):1760-1763.
[12]赵旭龙.大黄、厚朴和枳实治疗肠梗阻的系统药理学研究[D].大连:大连理工大学,2019.
[13]巢蕾,曹雨诞,陈佩东,等.厚朴对胃肠动力障碍作用的研究[J].中国医药导报,2018,15(13):31-34.
[14]陆小华,马骁,王建,等.赤芍的化学成分和药理作用研究进展[J].中草药,2015,46(4):595-602.
[15]Peters EG,De Jonge WJ,Smeets BJ,et al.The contribution of mast cells to postoperative ileus in experimental and clinical studies[J].Neurogastroenterol Motil,2015,27(6):743-749.
[16]Tsuchida Y,Hatao F,Fujisawa M,et al.Neuronal stimulation with 5-hydroxytryptamine 4 receptor induces anti-inflammatory actions via α7nACh receptors on muscularis macrophages associated with postoperative ileus[J].Gut,2011,60(5):638-647.
[17]Nabavi SF,Braidy N,Gortzi O,et al.Luteolin as an anti-inflammatory and neuroprotective agent:A brief review[J].Brain Res Bull,2015,119(Pt A):1-11.
[18]Rauf A,Patel S,Imran M,et al.Honokiol:An anticancer lignan[J].Biomed Pharmacother,2018,107:555-562.
[19]Dinda B,Dinda S,DasSharma S,et al.Therapeutic potentials of baicalin and its aglycone,baicalein against inflammatory disorders[J].Eur J Med Chem,2017,131:68-80.
[20]Schwarz NT,Kalff JC,Türler A,et al.Prostanoid production via COX-2 as a causative mechanism of rodent postoperative ileus[J].Gastroenterology,2001,121(6):1354-1371.
[21]Zhang J,Chen Z,Huang X,et al.Insights on the Multifunctional Activities of Magnolol[J].Biomed Res Int,2019,2019:1847130.
[22]Bae MJ,Shin HS,See HJ,et al.Baicalein induces CD4(+)Foxp3(+) T cells and enhances intestinal barrier function in a mouse model of food allergy[J].Sci Rep,2016,6:32225.
[23]Zhang YX,Wang L,Xiao EL,et al.Ginsenoside-Rd exhibits anti-inflammatory activities through elevation of antioxidant enzyme activities and inhibition of JNK and ERK activation in vivo[J].Int Immunopharmacol,2013,17(4):1094-1100.
[24]Mihara M,Hashizume M,Yoshida H,et al.IL-6/IL-6 receptor system and its role in physiological and pathological conditions[J].Clin Sci(Lond),2012,122(4):143-159.
[25]Boeckxstaens GE,de Jonge WJ.Neuroimmune mechanisms in postoperative ileus[J].Gut,2009,58(9):1300-1311.
[26]Abeyrathna P,Su Y.The critical role of Akt in cardiovascular function[J].Vascul Pharmacol,2015,74:38-48.
[27]Matsumoto K,Ema M.Roles of VEGF-A signalling in development,regeneration,and tumours[J].J Biochem,2014,156(1):1-10.
[28]Pompura SL,Dominguez-Villar M.The PI3K/AKT signaling pathway in regulatory T-cell development,stability,and function[J].J Leukoc Biol,2018,103(6):29357116.
[29]Kalliolias GD,Ivashkiv LB.TNF biology,pathogenic mechanisms and emerging therapeutic strategies[J].Nat Rev Rheumatol,2016,12(1):49-62.
[30]Gao Y,Xu B,Zhang P,et al.TNF-α Regulates Mast Cell Functions by Inhibiting Cell Degranulation[J].Cell Physiol Biochem,2017,44(2):751-762.
[31]Yasuda K,Takeuchi Y,Hirota K.The pathogenicity of Th17 cells in autoimmune diseases[J].Semin Immunopathol,2019,41(3):283-297.
[32]Song X,Dai D,He X,et al.Growth Factor FGF2 Cooperates with Interleukin-17 to Repair Intestinal Epithelial Damage[J].Immunity,2015,43(3):488-501.
[33]Gu C,Wu L,Li X.IL-17 family:cytokines,receptors and signaling[J].Cytokine,2013,64(2):477-485.
[34]Wang Z.ErbB Receptors and Cancer[J].Methods Mol Biol,2017,1652:3-35.
[35]Frey MR,Brent Polk D.ErbB receptors and their growth factor ligands in pediatric intestinal inflammation[J].Pediatr Res,2014,75(1-2):127-132.
[36]Frey MR,Hilliard VC,Mullane MT,et al.ErbB4 promotes cyclooxygenase-2 expression and cell survival in colon epithelial cells[J].Lab Invest,2010,90(10):1415-1424.
[37]Xie Y,Shi X,Sheng K,et al.PI3K/Akt signaling transduction pathway,erythropoiesis and glycolysis in hypoxia(Review)[J].Mol Med Rep,2019,19(2):783-791.
(2020-10-09收稿 本文編辑:王明)
