抗氧化酶和植物螯合肽对苎麻重金属Cd胁迫的应答
2022-06-02全芮萍陈建福张蕾许明志杨瑞芳佘玮崔国贤
全芮萍 陈建福 张蕾 许明志 杨瑞芳 佘玮 崔国贤

摘 要:為了探究抗氧化酶和植物螯合肽在苎麻耐镉生理机制中的作用,本研究以苎麻耐性品种‘川苎8号为实验材料,对其进行5、25、50 mg/L的镉处理,7 d后分别测定其生物量、镉含量、抗氧化酶活性、植物螯合肽含量以及相关基因表达量。结果表明5 mg/L镉处理‘川苎8号的株高、根长与生物量受到促进,25、50 mg/L镉处理下‘川苎8号的株高、根长与生物量受到抑制,‘川苎8号主要将镉积累在根部,不同镉处理下转运系数均小于1,25 mg/L镉处理时镉积累量与转运系数均显著高于其他处理;镉胁迫后‘川苎8号地上部和地下部超氧化物歧化酶(SOD)活性显著升高,丙二醛(MAD)活性显著降低,过氧化氢(H2O2)含量显著上升;5、25 mg/L镉处理时地下部植物螯合肽(PCs)与谷胱甘肽(GSH)含量显著低于对照,50 mg/L镉处理时高于对照但未达到显著差异;PCs和GSH在地上部和地下部承担着不同的解毒作用;各浓度处理的地上部BnPCS1相对表达量均与镉含量呈极显著正相关(P<0.01),高浓度(25、50 mg/L)处理的地上部BnGCL1相对表达量与镉含量呈正相关(P<0.01);低浓度(5 mg/L)处理下SOD活性显著高于对照,与各部位镉含量均呈极显著正相关(P<0.01),高浓度镉处理时地下部SOD活性与镉含量呈极显著负相关(P<0.01),地下部PCs含量与镉含量呈极显著正相关(P<0.01)。综合分析说明,‘川苎8号在低浓度镉胁迫时主要通过激活抗氧化酶活性消除细胞中自由基的毒害,高浓度镉胁迫时通过调节抗氧化酶活性和PCs与GSH合成解除镉的毒害。
关键词:苎麻;镉;抗氧化酶;植物螯合肽中图分类号:S563.1 文献标识码:A
Responses of Ramie to Antioxidant Enzymes and Plant Chelating Peptides to Cd Stress
Abstract: In order to explore the role of antioxidant enzymes and plant chelating peptides in the physiological mechanism of ramie tolerance to cadmium, Cd-tolerant ramie variety ‘Chuanzhu 8 was treated with 5, 25, 50 mg/L cadmium, and the biomass, cadmium content, antioxidant enzyme activity, plant chelating peptide content and related gene expression were assayed seven days later. The plant height, root length and biomass treated with 5 mg/L cadmium were promoted, and the plant height, root length and biomass treated with 25, 50 mg/L cadmium were affected. Cadmium was mainly accumulated in the root, the transport coefficient under different cadmium treatment was less than one, and the cadmium accumulation and transport coefficients under 25 mg/L cadmium was significantly higher than that of other treatments. The superoxide dismutase (SOD) activity significantly increased, the, malondialdehyde (MAD) activity significantly decreased in cadmium stress. The hydrogen peroxide (H2O2) content significantly increased, the underground plant chelating peptides (PCs) and glutathione (GSH) content was significantly lower than that of the control under 5 mg/L and 25 mg/L cadmium treatments, and was higher than that of the control under 50 mg/L cadmium, but did not reach a significant difference. PCs and GSH had different detoxification effects in aboveground and underground parts. The relative expression of abovegroundBnPCS1 and cadmium content under various concentration treatments were extremely significantly positively correlated (P<0.01), and the relative expression of abovegroundBnGCL1at a high concentration (25 mg/L and 50 mg/L) was positively correlated with cadmium content (P<0.01). SOD activity under low concentration (5 mg/L) was significantly higher than that of the control, and had the same cadmium content in all parts. There was a very significant positive correlation (P<0.01). The SOD activity and cadmium content in the underground was extremely significantly negatively correlated (P<0.01) when treated with high concentration of cadmium, and the PCs content and the cadmium content in the underground were extremely significantly positively correlated (P<0.01). Comprehensive analysis showed that ‘Chuanzhu 8 mainly used antioxidant enzyme activity to eliminate the toxicity of free radicals in cells under low concentration cadmium stress. Under high concentration cadmium stress, it relieved cadmium by regulating antioxidant enzyme activity and the synthesis of PCs and GSH.08CF8F0D-7EAF-4B64-B23F-6B8E29A5D950
Keywords: ramie; cadmium; antioxidant enzymes; plant chelating peptides
DOI: 10.3969/j.issn.1000-2561.2022.05.017
镉(Cd)是一种对动植物具有剧毒,且毒性持久的非必需元素,严重影响农作物的产量和质量[1]。镉进入植物体后,会替换其他离子吸收转运相关的结合位点,导致新陈代谢紊乱,影响细胞结构[2-3],当土壤受到镉污染后,镉会在生物体内富集,并通过食物链进入人体从而引起慢性中毒[4]。生态环境部2020年5月7日公布的《2019年全国生态环境质量简况》中指出,影响农用地土壤环境质量的主要污染物是重金属,其中镉为首要污染物。
植物经过长期进化演变,进化出了一套复杂的耐镉机制,主要包括细胞壁、抗氧化系统、螯合蛋白、转运蛋白等协同作用,消除由镉引发的O2–·、H2O2过量积累导致的膜脂过氧化反应和细胞膜损坏[5]。当植物面对氧化胁迫时可启动由超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等抗氧化酶组成的自身保护系统,提高清除活性氧自由基(ROS)的能力,其中SOD作为抵抗ROS的第一道防线[6-7],可快速将O2–·转化为H2O2[8-9],降低过氧化伤害,提高植物耐镉性。非巯基蛋白如植物螯合肽(phytochelatin, PCs)等能直接螯合重金属离子参与解毒。PCs是由植物螯合肽合酶(phytochelatin synthase, PCS)催化,以还原型谷胱甘肽(glutathione, GSH)为底物合成[10],PCs中半胱氨酸的巯基(-SH)结合Cd2+形成Cd-PC复合物,并通过液泡膜上的转运蛋白-ABC运输体将其转运至液泡内完成对镉的解毒作用[11-13]。
苎麻(Boehmeria nivea)属荨麻科苎麻属,生长迅速、根系庞大、生物产量高。已有研究证明其对镉、铅、铜等多种重金属具有较好的耐性和积累能力[14-16],是我国南方重金属污染农田替代种植作物。本研究通过盆栽试验,研究镉对苎麻的生长、镉含量、抗氧化酶与植物螯合肽的影响,从生理和分子层面研究镉胁迫下苎麻耐镉机制。
1 材料与方法
1.1 材料
供试品种为耐镉品种‘川苎8号,生化试剂OmniPlant RNA Kit(DNase I)购自康为世纪(北京)生物科技有限公司,EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix、TransStart Green qPCR SuperMix购自全式金(北京)生物技术有限公司,超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢(H2O2)试剂盒购自索莱宝(北京)生物科技有限公司,谷胱甘肽(GSH)、非蛋白巯基(NPT)购自南京建成生物工程研究所。
1.2 方法
1.2.1 试验设计 盆栽试验于2021年3—7月在湖南农业大学苎麻智能温室进行。于苎麻种质资源圃剪取嫩梢,扦插育苗,麻苗均高25~30 cm时,选取高度、长势一致的健康苗定植于以膨胀珍珠岩基质的聚乙烯塑料盆中。每周添加一次1/2 Hoagland全面营养液。培育3周后,在苎麻盆栽中添加镉溶液500 mL。Cd2+供体为镉标准溶液,试验设置0、5、25、50 mg/L 4个Cd2+浓度水平,以不加镉标准液为对照,每个处理重复3次。
1.2.2 测定项目 (1)生物量与镉含量测定。镉处理1周后小心取出整株苧麻,用去离子水洗净尘土与珍珠岩,吸水纸擦干水分,称重记录,一部分经105℃杀青30 min,然后65℃烘干至恒重,研磨、过筛,样品采用HNO3-HClO4法消化。采用SOLAAR M6型原子吸收光谱仪测定重金属镉含量。另一部分按地下部、地上部分别用液氮速冻,于–80℃保存,备用。
(2)生理指标测定。超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、过氧化氢(H2O2)含量采用北京索莱宝生物科技有限公司试剂盒测定,谷胱甘肽(GSH)、非蛋白巯基(NPT)含量采用南京建成生物工程研究所相应的试剂盒测定。植物螯合肽(PCs)含量=非蛋白巯基(NPT)含量-谷胱甘肽(GSH)含量。
(3)BnPCS1与BnGCL1表达分析。苎麻植物螯合肽合成酶基因(BnPCS1)和半胱氨酸连接酶基因(BnGCL1)的引物序列根据苎麻基因组(PHNS00000000.1)中的PCS1和GCL1基因序列设计。引物由擎科生物有限责任公司合成,引物序列见表1。
各处理分别取1 g苎麻组织,提取总RNA,反转录成cDNA作为模板,进行实时荧光定量PCR扩增检测基因的表达量。反应体系为:2×SYBR Green PCR Mix 10 ?L、QF(10 μmol/L)0.5 μL、QR(10 μmol/L)0.5 μL、cDNA 2 ?L和ddH2O 7 ?L。反应条件为:94℃(30 s);94℃(5 s)、61℃(35 s)45个循环。每个样本重复3次。以苎麻肌动蛋白(β-actin)作为内参。采用2-??CT法计算基因的相对表达量。08CF8F0D-7EAF-4B64-B23F-6B8E29A5D950
1.3 数据处理
采用SPSS 24.0和Origin 2019软件对试验数据进行统计分析与作图。采用LSD法分析差异显著性。F检验P≤0.05时为显著差异。
植株地上部重金属累积量=植株地上部重金属含量×植株地上部生物量;植株地下部重金属累积量=植株地下部重金属含量×植株地下部生物量。转运系数=植株地上部镉含量(mg/kg)/植株地下部镉含量(mg/kg)。
2 结果与分析
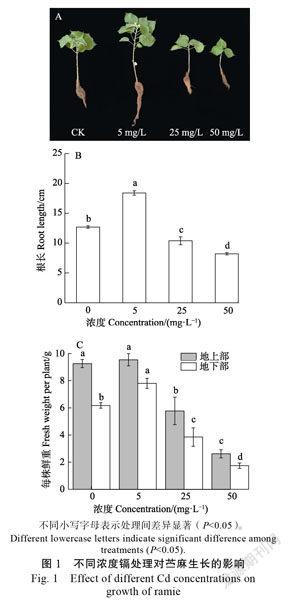
2.1镉胁迫对苎麻生长的影响
镉处理显著影响苎麻的生长发育(图1A),5 mg/L处理促进苎麻根的生长,较对照显著上升44.88%,而25 mg/L和50 mg/L处理较对照显著下降了18.81%和35.43%(图1B)。5 mg/L处理促进苎麻生长发育,地上部比对照上升3.02%,而25 mg/L和50 mg/L处理较对照显著下降45.97%和72.71%;地下部在5 mg/L处理下较对照上升26.43%,25 mg/L和50 mg/L处理较对照显著下降25.19%和70.36%,在5 mg/L处理下苎麻地下部鲜质量的增长幅度大于地上部(图1C)。
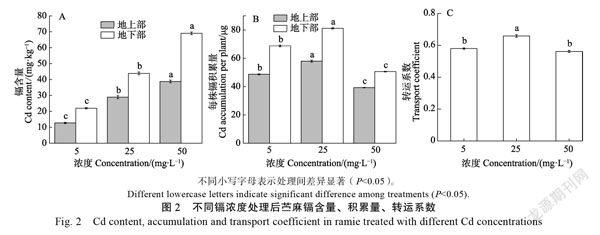
2.2 镉胁迫对苎麻镉含量、镉积累量和转运系数的影响
随着镉处理浓度的上升,苎麻地上部与地下部镉含量显著上升,50 mg/L镉处理的地上部与地下部镉含量达到最高,分别为38.79 mg/kg和69.04 mg/kg,且各处理下地下部含量均高于地上部。25 mg/L和50 mg/L镉处理的地上部镉含量较5 mg/L处理显著上升126.82%和204.24%,地下部镉含量与5 mg/L处理相比显著上升了99.55%和213.96%(图2A)。在25 mg/L处理下‘川苎8号植株内镉积累量达到最高,且显著高于其他处理,5、25、50 mg/L镉处理的每株地上部镉积累量分别为48.69、57.93、39.24 μg,每株地下部积累量分别为68.71、81.13、50.57 μg(图2B)。各个处理的转运系数均小于1(图2C)。
2.3 镉胁迫对苎麻氧化胁迫和抗氧化酶活性的影響
丙二醛(MDA)作为植物细胞脂质过氧化的
最终产物,可作为植物氧化胁迫程度的指标[17]。5、25、50 mg/L镉胁迫下‘川苎8号地上部的MDA含量分别较对照显著下降了14.23%、10.31%和57.31%,5 mg/L镉处理时地下部MDA含量达到最高,较对照显著上升13.99%,后随处理浓度的上升较对照分别降低5.20%和36.69%;50 mg/L镉处理的地上部与地下部MDA含量均为最小值(图3A)。50 mg/L镉处理的地上部H2O2含量达到最高且显著高于其他水平,较对照显著上升30.47%;而25 mg/L镉处理的地下部H2O2含量显著高于其他处理,较对照显著上升34.56%,50 mg/L处理的含量最低,较对照显著下降24.13%,各个处理的地下部H2O2含量显著高于地上部(图3B)。镉胁迫后地上部与地下部超氧化物歧化酶(SOD)活性显著增加,5、25、50 mg/L镉处理下地上部SOD活性较对照分别增加了89.34%、14.75%和113.08%,地下部SOD活性较对照分别增加了320.82%、90.30%和
2.4 镉胁迫对苎麻植物螯合肽(PCs)和谷胱甘肽(GSH)含量的影响
5 mg/L镉处理时‘川苎8号地上部PCs含量较对照下降10.05%,25 mg/L和50 mg/L镉处理较对照分别增加了5.08%和2.06%;5、25、50 mg/L镉处理下地下部PCs含量分别较对照下降了22.25%、13.12%和0.57%(图4A)。5 mg/L镉处理时地上部GSH含量较对照显著增加16.08%,25 mg/L和50 mg/L镉处理时分别较对照下降12.69%和42.71%;在5 mg/L和25 mg/L处理时地下部GSH含量分别较对照显著下降12.39 %和27.75%(图4B)。‘川苎8号地上部PCs和GSH含量均显著高于地下部,植株PCs含量显著高于GSH含量。
2.5镉胁迫对BnPCS1和BnGCL1的相对表达量的影响
植物螯合肽合酶(PCS)是控制植物螯合肽(PCs)合成的关键酶。5 mg/L镉处理时‘川苎8号地上部的BnPCS1相对表达量达到最高,较对照显著增加了30.47%,25 mg/L镉处理时最低,较对照显著降低了37.59%;地下部的BnPCS1相对表达量随镉浓度的增加显著下降,5、25、50 mg/L各处理的表达量分别较对照下降了35.05%、60.95%和71.19%(图5A),各处理的地下部BnPCS1相对表达量均高于地上部。γ-谷氨酸半胱氨酸连接酶(GCL)是谷胱甘肽(GSH)合成途径的限速酶,GCL通常决定细胞GSH水平和GSH的生物合成能力。,5、25、50 mg/L镉处理下‘川苎8号地上部的BnGCL1相对表达量分别较对照减少了53.50%、20.63%和5.79%,地下部的BnGCL1表达量分别较对照减少了56.23%、62.47%和68.14%(图5B)。08CF8F0D-7EAF-4B64-B23F-6B8E29A5D950
2.6 镉胁迫下镉含量与生理指标及相关基因表达量的相关性分析
低浓度(5 mg/L)处理的地上部、地下部SOD活性均与镉含量呈极显著正相关(P<0.01);高浓度(25 mg/L和50 mg/L)下,地上部SOD活性与镉含量呈极显著正相关(P<0.01),地下部SOD活性与镉含量呈极显著负相关(P<0.01)。H2O2与镉含量的相关性和SOD活性一致。各个浓度处理下地上部BnPCS1的相对表达量均与镉含量呈极显著正相关(P<0.01),地下部的BnPCS1相对表达量与镉含量呈显著负相关(P<0.01);在高浓度下地上部的BnGCL1相对表达量与镉含量呈正相关(P<0.01)(图6)。
3 讨论
镉作为植物非必需金属元素,当植物组织镉含量超过5~10 μg/g时,对植物造成毒害作用,影响植株的生长[18],其具体表现为植株矮小、生物量减少等[19-20]。本研究中,5 mg/L镉处理提高了苎麻的株高、根长与生物量,25 mg/L和50 mg/L镉处理下苎麻株高、根长与生物量显著降低,但叶片始终保持绿色。‘川苎8号地下部与地上部镉含量随镉浓度的上升逐漸增加,且地下部镉含
量始终高于地上部镉含量,各浓度处理下转运系数均小于1,这与猕猴桃[21]、葡萄[22]、山定子[23]的分布规律一致,表明‘川苎8号主要通过根部积累镉,根对镉有较强的滞留作用,可限制镉从根系向地上部迁移,减少对地上部光合系统的损伤。
植物在正常条件下能够有效地清除体内的活性氧自由基(ROS)使细胞免受伤害,但在重金属镉毒害胁迫下,植物体内的ROS产生速度超过植物清除ROS的速度,造成ROS在细胞中积累[24],产生丙二醛(MDA)等产物并造成DNA和蛋白质损伤以及细胞脂质过氧化[25]。在本研究中,除地下部MDA活性在5 mg/L处理时出现小幅上升外,其余均低于对照,说明‘川苎8号在镉胁迫下受到的氧化伤害较小,细胞膜的稳定性和功能的完整性没有受到较大损害。本研究中,镉处理下‘川苎8号体内超氧化物歧化酶(SOD)活性均高于对照,低浓度(5 mg/L)处理下SOD活性与镉含量在地上部、地下部位均呈极显著正相关(P<0.01),高浓度下(25 mg/L和50 mg/L),地上部SOD活性与镉含量呈极显著正相关(P<0.01),地下部SOD活性与镉含量呈极显著负相关(P<0.01)。低浓度镉处理时‘川苎8号
通过提高体内SOD活性将有害的O2–·转化为H2O2和O2,能有效清除过量的活性氧,以保持细胞内抗氧化酶系统的平衡,减轻脂质过氧化程度与过氧化胁迫,这也从侧面解释了‘川苎8号体内H2O2含量上升的原因。高浓度镉处理时地下部SOD活性降低,但是植物氧化胁迫程度的指标MDA含量并没有增加,说明除了抗氧化酶,‘川苎8号存在其他的解毒途径防止植株遭受氧化伤害。
除抗氧化酶外,植物应对重金属胁迫的另一个策略是在细胞内合成巯基化合物(GSH和PCs等多肽物质)螯合重金属,减轻游离重金属离子对细胞的毒害。PCs是一类结构特殊的金属巯蛋白,是以GSH为底物的生物合成的酶促产物。GSH作为PCs的前体,由γ-谷氨酸半胱氨酸连接酶(GCL)和谷胱甘肽合成酶(GS)通过ATP催化合成,合成过程中由多种因素调节,主要以GCL的调节为主[26]。孙琴等[27]研究发现小麦根系GSH含量随Cd浓度的增加而上升。ZHAO等[28]发现Pb胁迫下矿区生态型华中盖蹄蕨根和叶中的GSH含量均显著升高。同时有研究认为,GSH和PCs在植物不同部位承担着重金属解毒功能,PCs主要在根部,而GSH则在叶片的解毒上有更显著的作用[29]。另外,近年来研究发现植物根系通过减少植株PCs的合成来减少镉向地上部的运输,从而降低镉对叶片等器官的毒害,增强作物耐镉性能[30]。本研究中,5 mg/L镉处理的地上部和地下部PCs含量下降,50 mg/L镉处理时升高,与李雪玲[31]的研究结果相似,说明高浓度下进入细胞的大量Cd激活了PCs合成酶,进而促进了PCs的合成,也导致底物GSH含量持续减少。
镉处理下刚毛柽柳[32]叶片ThPCS1基因与苜蓿[33]根和茎尖MsPCS1基因表达下调,推测可能与PCS在植株不同部位发挥耐镉作用有关。本研究中,5 mg/L镉处理的地上部BnPCS1基因上调表达,其余处理的相对表达量均下调,在各个浓度处理的地上部BnPCS1基因相对表达量均与镉含量呈极显著正相关(P<0.01),地下部BnPCS1相对表达量与镉含量呈极显著负相关(P<0.01),进一步说明PCs在地上部和地下部承担着不同的解毒作用;高浓度镉处理的地上部BnGCL1相对表达量与镉含量呈极显著正相关(P<0.01),地下部BnGCL1相对表达量与镉含量呈极显著负相关(P<0.01),说明GSH在地上部和地下部的解毒作用也不相同。综合分析得出,‘川苎8号在低浓度镉胁迫时主要通过激活抗氧化酶活性消除细胞中自由基的毒害,高浓度镉胁迫时通过调节抗氧化酶活性和PCs与GSH合成解除镉的毒害。08CF8F0D-7EAF-4B64-B23F-6B8E29A5D950
参考文献
- CASELLES J M, Moral R, ESPINOSA A P, MURCIA M D P. Cadmium accumulation and distribution in cucumber plant[J]. Journal of Plant Nutrition, 2000, 23(2): 243-250.
- GRATAO P L, POLLA A, LEA P J, AZEVEDO R A. Making the life of heavy metal-stressed plants a little easier[J]. Functional Plant Biology, 2005, 32(6): 481-494.
- SEREGIN I V, IVANOV V B. Physiological aspects of cadmium and lead toxic effects on higher plants[J]. Russian Journal of Plant Physiology, 2001, 48: 523-544.
- VALVERDE M, FORTOUL T I, BARRIGA F D, MEJIA J, CASTILLO E R D. Induction of genotoxicity by cadmium chloride inhalation in several organs of CD-1 mice[J]. Mutagenesis, 2000, 15(2): 109-114.
- HALLIWELL B. Reactive species and antioxidants. Redox biology is a fundamental theme of aerobic life[J]. Plant Physiology, 2006, 141(2): 312-322.
- GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930.
- AHAMMED G J, RUAN Y P, ZHUO J, XIAX J, SHI K, ZHOU Y H, YU J Q. Brassinosteroid alleviates polychlorinated biphenyls-induced oxidative stress by enhancing antioxidant enzymes activity in tomato[J]. Chemosphere, 2013, 90(11): 2645-2653.
- 刘俊祥, 魏树强, 翟飞飞, 李 伟, 周晓星, 孙振元. Cd2+胁迫下多年生黑麦草的生长与生理响应[J]. 核农学报, 2015, 29(3): 587-594.LIU J X, WEI S Q, ZHAI F F, LI W, ZHOU X X, SUN Z Y. Growth and physiology response of perennial ryegrass to Cd2+ stress[J]. Journal of Nuclear Agricultural Sciences, 2015, 29(3): 587-594. (in Chinese)
- 杨 萍, 周旭东, 莫 俊, 罗世巧, 校现周, 仇 键. 叶面喷施不同浓度稀土对橡胶树树叶抗氧化能力的影响[J]. 热带作物学报, 2021, 42(1): 110-115.YANG P, ZHOU X D, MO J, LUO S Q, XIAO X Z, QIU J. Effects of foliar application of different concentrations of rare earth on antioxidant capacity of rubber tree[J]. Chinese Journal of Tropical Crops, 2021, 42(1): 110-115. (in Chinese)
- GRILL E, LOFFLER S, WINNACKER E L, ZENK M H. Phytochelatins, the heavy-metal-binding peptides of plants, are synthesized from glutathione by a specific gamma-glutamylcysteine dipeptidyl transpeptidase (phytochelatin synthase)[J]. Proceedings of the National Academy of Sciences, 1989, 86(18): 6838-6842.
- HIRATA K, TSUJI N, MIYAMOTO K. Biosynthetic regulation of phytochelatins, heavy metal-binding peptides[J]. Journal of Bioscience and Bioengineering. 2005, 100(6): 593-599.
- MEHRA R K, KODATI V R, ABDULLAH R. Chain length-dependent Pb(II)-coordination in phytochelatins[J]. Biochemical and Biophysical Research Communications, 1995, 215(2): 730-736.
- TOPPI L, GABBRIELLI R. Response to cadmium in higher plants[J]. Environmental and Experimental Botany, 1999, 41(2): 105-130.
- YANG B, ZHOU M, SHE W S, LAN C Y, YE Z H, QIU R L, JIE Y C, CUI G X, WONG M H. Constitutional tolerance to heavy metals of a fiber crop, ramie (Boehmeria nivea), and its potential usage[J]. Environmental Pollution, 2010, 158(2): 551-558.
- SHE W, CUI G X, LI X L, SU X H, JIE Y C,YANG R F. Characterization of cadmium concentration and translocation among ramie cultivars as affected by zinc and iron deficiency[J]. Acta Physiologiae Plantarum, 2018, 40(6): 104.
- 雷 梅, 岳庆玲, 陈同斌, 黄泽春, 廖晓勇, 刘颖茹, 郑国砥, 常庆瑞. 湖南柿竹园矿区土壤重金属含量及植物吸收特征[J]. 生态学报, 2005(5): 1146-1151.LEI M, YUE Q L, CHEN T B, HUANG Z C, LIAO X Y, LIU Y R, ZHENG G D, CHANG Q R. Heavy metal concentrations in soils and plants around Shizhuyuan mining area of Hunan Province[J]. Acta Ecologica Sinica, 2005(5): 1146-1151. (in Chinese)
- 陳少裕. 膜脂过氧化对植物细胞的伤害[J]. 植物生理学通讯, 1991(2): 84-90.CHEN S Y. Injury of membrane lipid peroxidation to plant cell[J]. Plant Physiology Communications, 1991(2): 84-90. (in Chinese)
- WHITE P J, BROWN P H. Plant nutrition for sustainable development and global health[J]. Annals of Botany, 2010, 105(7): 1073-80.
- SHI G, CAI Q. Cadmium tolerance and accumulation in eight potential energy crops[J]. Biotechnology Advances, 2009, 27(5): 555-561.
- 黄耿磊, 黄冬芬, 刘国道, 郇恒福, 虞道耿. 镉胁迫对3个品种圭亚那柱花草镉积累和矿质养分吸收的影响[J]. 热带作物学报, 2011, 32(4): 598-602.HUANG G L, HUANG D F, LIU G D, HUAN H F, YU D G. Effects of cadmium stress on cadmium accumulation and mineral nutrients uptake in three varieties of Stylosanthes guianensis[J]. Chinese Journal of Tropical Crops, 2011, 32(4): 598-602. (in Chinese)
- 卜范文, 汤佳乐, 杨 玉, 王仁才, 程小梅, 林文力, 徐 海. 湖南省猕猴桃果园土壤镉含量及镉吸收规律研究[J]. 江西农业大学学报, 2017, 39(3): 468-475.BU F W, TANG J L, YANG Y, WANG R C, CHENG X M, LIN W L, XU H. A study of soil cadmium content and its absorption law in kiwifruit orchards in Hunan province[J]. Acta Agriculturae Universitatis Jiangxiensis, 2017, 39(3): 468-475. (in Chinese)
- 李小红, 陶建敏, 陈剑东, 胡 锋, 李辉信. 镉胁迫对不同砧穗组合葡萄植株镉吸收规律和果实品质的影响[J]. 生态环境学报, 2010, 19(5): 1082-1086.LI X H, TAO J M, CHEN J D, HU F, LI H X. Uptake of cadmium in grapevine with different scion-rootstock combinations and their fruit quality analysis under cadmium stress[J]. Ecology and Environmental Sciences, 2010, 19(5): 1082-1086. (in Chinese)
- 何佳丽, 周江涛, 吕德国. 镉胁迫对山定子幼苗生长、镉积累及活性氧代谢的影响[J].北方园艺, 2019(16): 53-61.HE J L, ZHOU J T, LV D G. Effect of cadmium on growth. Cd accumulation and active oxygen metabolism of Malus baccata borkh. seedings[J]. Northern Horticulture, 2019(16): 53-61. (in Chinese)
- FARMER E E, MUELLER M J. ROS-mediated lipid peroxidation and RES-activated signaling[J]. Annual Review of Plant Biology, 2013, 64: 429-50.
- JANERO D R. Malondialdehyde and thiobarbituric acid-reactivity as diagnostic indices of lipid peroxidation and peroxidative tissue injury[J]. Free Radical Biology and Medicine, 1990, 9(6): 515-540.
- WACHTER A, RAUSH T. Regulation of glutathione (GSH) synthesis in plant: Novel insight from Arabidopisis[J]. The Federal Agricultural Research, 2005, 283: 149-155.
- 孙 琴, 王 超. 土壤外源Cd和Pb复合污染对小麦(Triticum aestivum L.)根系植物络合素和谷胱甘肽合成的影响[J]. 生态环境, 2008, 17(5): 1833-1838.SUN Q, WANG C. Phytochelatins and glutathione synthesis in roots of wheat (Triticum aestivum L.) under combined pollution of Cd and Pb: a pot study[J]. Ecology and Environmental Sciences, 2008, 17(5): 1833-1838. (in Chinese)
- ZHAO L, LI T, YU H, CHEN G, ZHANG X, ZHENG Z, LI J. Changes in chemical forms, subcellular distribution, and thiol compounds involved in Pb accumulation and detoxification in Athyrium wardii (Hook.)[J]. Environmental Science and Pollution Research International, 2015, 22(16): 12676-12688.
- GOMEZ N E, DUCH E S, PEREZ O Z, SANTAMARIA J M. Glutathione plays a role in protecting leaves of Salvinia minima from Pb2+ damage associated with changes in the expression of SmGS genes and increased activity of GS[J]. Environmental and Experimental Botany, 2011, 75(13): 188-194.
- 王学华, 戴 力. 作物根系镉滞留作用及其生理生化机制[J]. 中国农业科学, 2016, 49(22): 4323-4341.WANG X H, DAI L. Immobilization effect and its physiology and biochemical mechanism of the cadmium in crop roots[J]. Scientia Agricultura Sinica, 2016, 49(22): 4323-4341. (in Chinese)
- 李雪玲. 不同品种苎麻对镉的吸收差异及生理生化特征[D]. 长沙: 湖南农业大学, 2017.LI X L. Studies on the cadmium absorption and physiological and biochemical characteristics of different ramie varieties[D]. Changsha: Hunan Agricultural University, 2017. (in Chinese)
- 王培龙, 杨 妮, 张傲然, 唐努尔·塞力克, 李 爽, 高彩球. 刚毛柽柳ThPCS1基因克隆与镉胁迫应答分析[J]. 南京林业大学学报(自然科学版), 2021, 45(3): 71-78.WANG P L, YANG N, ZHANG A R, SAILIKE T, LI S, TANG C Q. Cloning ThPCS1 gene of Tamarix hispida to improve cadmium tolerance[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2021, 45(3): 71-78. (in Chinese)
- DAS U, RAHMAN M A, ELA E J, LEE KW, KABIR A H. Sulfur triggers glutathione and phytochelatin accumulation causing excess Cd bound to the cell wall of roots in alleviating Cd-toxicity in alfalfa[J]. Chemosphere, 2021, 262: 128361.
