5-HT2B受体拮抗剂通过调控ERK通路干预大鼠垂体瘤纤维化的作用机制
2022-06-01王明国饶克成乔卿均
王明国,饶克成,乔卿均,高 飞
垂体瘤是起源于腺垂体、神经垂体及胚胎期颅咽管残余鳞状上皮的肿瘤,在颅内良性肿瘤中较为常见,占10%~12%,病人主要表现为头痛、恶心、呕吐、视力减退等[1-2]。临床上,大部分垂体瘤病人采用手术治疗可以治愈,且不影响自然寿命,少部分病人经手术无法治愈的原因在于垂体瘤纤维化程度较高,病灶质地坚韧,无法彻底切除。有研究表明,垂体腺瘤质地与纤维化程度密切相关[3]。纤维化是指机体组织、器官纤维结缔组织过度形成的病理过程,其中,成纤维细胞可参与合成大量细胞外基质(extracellular matrix,ECM),其主要成分为胶原蛋白,可促进组织、器官纤维化进程[4]。正常情况下,ECM产生和分解处于平衡状态,而病理情况下,ECM含量异常升高,从而导致组织器官纤维化,引起实质功能下降[5]。有研究表明,5-羟色胺(5-hydroxytryptamine,5-HT)2B受体可以诱导成纤维细胞增殖,促进纤维化发生,对5-HT2B受体信号进行抑制,可以减轻纤维化程度,从而达到治疗目的[6-7]。本实验通过建立垂体瘤大鼠模型,并采用不同方式作用于5-HT2B受体,明确对垂体瘤纤维化的影响,为临床治疗提供参考。
1 材料与方法
1.1 实验动物 60只7周龄无特定病原体(SPF)级健康SD雌性大鼠(中山大学实验动物中心),体质量(180±20)g,生产许可证号:SCXK(粤)2016-0029,适应性饲养1周。
1.2 实验试剂及仪器 5-HT2B受体激动剂(美国APExBIO Technology公司生产,BW723C86),5-HT2B受体拮抗剂(美国Gene Operation公司生产,SB204741),兔抗大鼠转化生长因子-β1(transforming growth factor-β1,TGF-β1)一抗(美国Bioworld Technology公司),兔抗大鼠结缔组织生长因子(connective tissue growth factor,CTGF)、一抗(武汉博士德生物工程公司),兔抗大鼠细胞外调蛋白激酶1/2(extracellular regulated protein kinases,ERK1/2)、磷酸化ERK1/2(p-ERK1/2)一抗(北京博奥森生物技术有限公司),辣根过氧化物酶标记的羊抗兔二抗(上海碧云天生物技术有限公司),超声诊断仪(徐州贝尔斯电子科技有限公司),DYS-40显微镜(购自上海点应光学仪器有限公司)。
1.3 方法
1.3.1 实验动物分组及建模 选取45只大鼠,以雌激素建立垂体瘤模型[8]:大鼠皮下埋置10 mg雌激素微量缓释泵,诱导垂体瘤模型,8周后,通过彩超观察大鼠体内垂体瘤形成情况,若无明显肿瘤形成,则更换缓释泵继续干预4周,第12周经彩超观察均建模成功。将建模成功大鼠分为模型组、5-HT2B受体拮抗剂组、5-HT2B受体激动剂组,各15只,剩余15只大鼠为对照组,皮下埋置10 mg生理盐水微量缓释泵。
1.3.2 干预方法 建模成功后24 h,5-HT2B受体拮抗剂组、5-HT2B受体激动剂组大鼠分别用2 mg/kg SB204741、2 mg/kg BW723C86腹腔注射,对照组及模型组腹腔注射等量生理盐水,每天2次,共14 d,期间大鼠自由进食、饮水,干预结束后,无大鼠死亡。
1.3.3 测量垂体肿瘤最大直径、体积及体质量 末次干预结束后2 h,腹腔注射2%戊巴比妥麻醉大鼠,颈部备皮消毒,作颈正中切口。经钝性分离,暴露胸骨舌骨肌,由其外缘分离肌肉层至找到枕骨嵴,分离枕蝶缝合,调节钻颅针长度,于枕骨嵴及枕蝶缝合交点处垂直钻孔,待骨板钻通,取出骨板,挑破垂体脑膜,用连接1/8马力吸引器的玻璃管吸出垂体。测量肿瘤最大直径,并通过肿瘤最大径(d1)、垂直方向最小径(d2)计算各组垂体瘤体积,并对垂体称重。垂体瘤体积V=π/2×d1×(d2)2。
1.3.4 苏木精-伊红(HE)染色 测量结束后,将各组大鼠1/2垂体组织于-80 ℃保存。剩余部分置于4%的甲醛中固定72 h,乙醇脱水,二甲苯透明,浸蜡包埋并切片,厚度4 μm。苏木素染色4 min,1%盐酸乙醇分化20 s,1%氨水返蓝30 s,伊红染色90 s,乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察垂体组织病理变化。
1.3.5 Masson染色 取垂体组织切片,二甲苯脱蜡,乙醇冲洗,滴加Weigert铁苏木素染色10 min,水洗后用1%盐酸乙醇分化10 s,丽春红酸性复红液染色10 min,蒸馏水冲洗,1%磷钼酸水溶液处理5 min,苯胺蓝复染5 min,1%冰醋酸处理1 min,水洗,乙醇脱水,二甲苯透明,中性树胶封片,显微镜下观察垂体组织胶原分布情况。
1.3.6 逆转录-聚合酶链式反应(RT-PCR)检测 取冻存垂体组织200 mg,Trizol法提取总RNA,反转录cDNA,后进行聚合酶链式反应(PCR)扩增。PCR体系:2×Mix 6 μL,cDNA 2 μL,正向、反向引物各1 μL,超纯水15 μL,共25 μL。扩增条件:95 ℃预变性3 min,95 ℃变性30 s,55 ℃退火1 min,72 ℃延伸45 s,循环数35个,60 ℃终延伸10 min。利用相对定量2-△△Ct法评估各个目的基因mRNA表达水平。引物序列见表1。

表1 引物序列
1.3.7 蛋白免疫印迹法(Western Blot)检测 取垂体组织200 mg,加入RIPA裂解液,离心后取上层清液,进行蛋白定量。上样,进行凝胶电泳。电泳结束后,转膜,加入5%脱脂奶粉室温封闭1 h,分别加入TGF-β1、CTGF、ERK1/2、p-ERK1/2一抗(1∶500),4 ℃环境下孵育过夜,洗膜,加入相应的二抗(1∶3 000),室温孵育2 h,洗膜,加入ECL化学反应液,曝光后显影,测定蛋白条带灰度值,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,目的蛋白/内参蛋白条带比值为目的蛋白相对表达量。
2 结 果
2.1 各组垂体瘤直径、体积及垂体质量比较 各组大鼠垂体瘤最大直径、体积及垂体质量组间比较,差异均有统计学意义(P<0.05)。与模型组比较,5-HT2B受体拮抗剂组垂体瘤最大直径、体积及垂体质量均下降(P<0.05),5-HT2B受体激动剂组垂体瘤最大直径、体积及垂体质量均升高(P<0.05);与5-HT2B受体拮抗剂组比较,5-HT2B受体激动剂组垂体瘤最大直径、体积及垂体质量均升高(P<0.05)。详见表2。
表2 各组垂体瘤最大直径、体积及垂体质量比较(±s)
2.2 各组垂体组织病理变化 HE染色结果显示,对照组垂体细胞数目较多,多为圆形,排列整齐有序,血窦丰富,无炎性细胞浸润;模型组大鼠垂体细胞有瘤样改变,细胞数量明显增多,呈圆形或多角形,胞核大小不一,血窦数量明显减少,细胞间质增生明显,可见毛细血管增生,有炎性细胞浸润;5-HT2B受体拮抗剂组大鼠垂体细胞有瘤样改变,细胞数量较少,偶有间质增生现象,炎性反应较轻;5-HT2B受体激动剂组大鼠垂体细胞数量大量增多,核大且核仁明显,血窦数量明显减少,细胞间质增生现象严重,大量炎性细胞浸润。见图1。
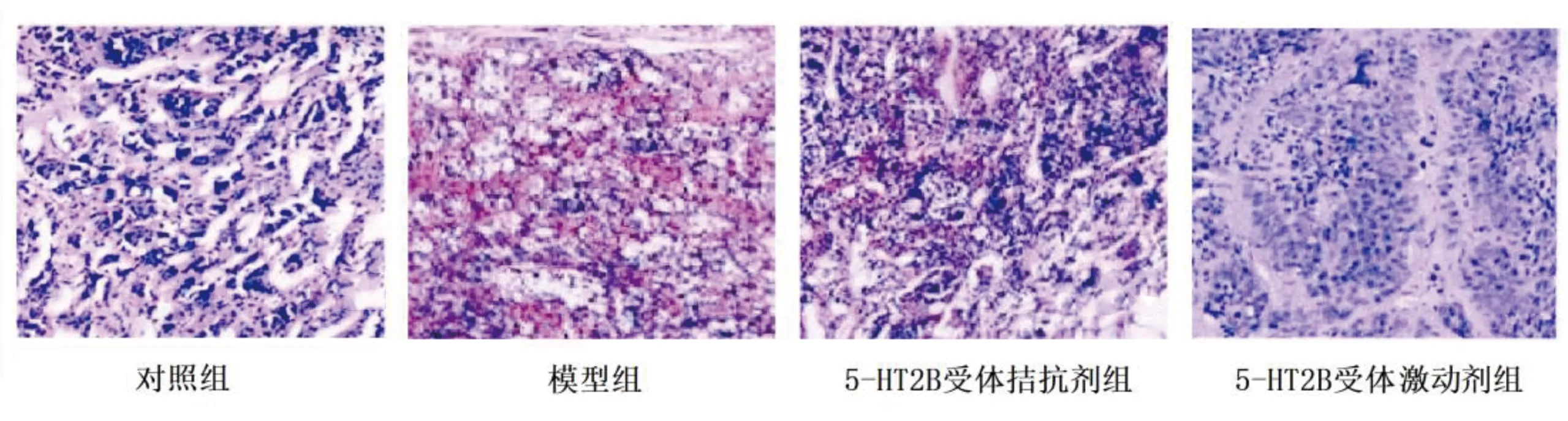
图1 各组垂体组织病理变化HE染色图(×400)
2.3 各种垂体组织胶原分布情况 Masson染色结果显示,对照组垂体细胞较多,分布均匀,无胶原产生;模型组可见不连续胶原纤维,分布密集,并可见结节;5-HT2B受体拮抗剂组偶有稀疏、散在分布胶原,无连续胶原纤维,结节较少;5-HT2B受体激动剂组,胶原纤维较多且连续,呈片状,结节较多。详见图2。
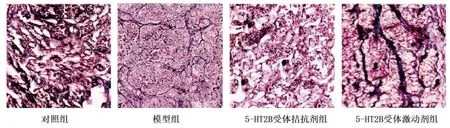
图2 各组垂体组织胶原分布Masson染色图(×400)
2.4 各组TGF-β1、CTGF、ERK1/2 mRNA相对表达情况比较 各组大鼠垂体组织中TGF-β1、CTGF mRNA相对表达量组间比较,差异均有统计学意义(P<0.05)。与对照组比较,模型组、5-HT2B受体拮抗剂组及5-HT2B受体激动剂组TGF-β1、CTGF mRNA相对表达量均升高(P<0.05);与模型组比较,5-HT2B受体拮抗剂组TGF-β1、CTGF mRNA相对表达量均降低,5-HT2B受体激动剂组TGF-β1、CTGF mRNA相对表达量均升高(P<0.05);与5-HT2B受体拮抗剂组比较,5-HT2B受体激动剂组TGF-β1、CTGF mRNA相对表达量均升高(P<0.05)。对照组、模型组、5-HT2B受体拮抗剂组及5-HT2B受体激动剂组ERK1/2 mRNA相对表达量组间比较,差异均无统计学意义(P>0.05)。详见表3。
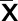
表3 各组垂体组织TGF-β1、CTGF、ERK1/2 mRNA相对表达情况比较(±s)
2.5 各组TGF-β1、CTGF、ERK1/2、p-ERK1/2蛋白相对表达情况比较 各组大鼠垂体组织中TGF-β1、CTGF、p-ERK1/2蛋白相对表达量组间比较,差异均有统计学意义(P<0.05)。与对照组比较,模型组、5-HT2B受体拮抗剂组及5-HT2B受体激动剂组TGF-β1、CTGF、p-ERK1/2蛋白相对表达量均升高(P<0.05);与模型组比较,5-HT2B受体拮抗剂组TGF-β1、CTGF、p-ERK1/2蛋白相对表达量均降低(P<0.05),5-HT2B受体激动剂组TGF-β1、CTGF、ERK1/2、p-ERK1/2均升高(P<0.05);与5-HT2B受体拮抗剂组比较,5-HT2B受体激动剂组TGF-β1、CTGF、p-ERK1/2蛋白相对表达量均升高(P<0.05)。对照组、模型组、5-HT2B受体拮抗剂组及5-HT2B受体激动剂组ERK1/2蛋白相对表达量组间比较,差异均无统计学意义(P>0.05)。详见表4、图3。
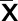
表4 各组垂体组织中TGF-β1、CTGF、ERK1/2、p-ERK1/2蛋白相对表达量比较(±s)
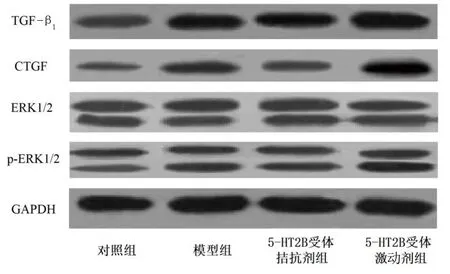
图3 各组垂体组织中TGF-β1、CTGF、ERK1/2、p-ERK1/2蛋白表达条带图
3 讨 论
据相关资料统计,各类疾病致死的病人中,大约45%都与组织器官纤维化有关[9]。纤维化是病理性过程,可发生在包括心脏、肺脏、胰脏、神经系统等在内的多个器官内,是多种慢性疾病及肿瘤的标志,不但使组织、器官功能下降,还可能因器官结构破坏、功能衰竭引发死亡[10-11]。5-HT是一种促纤维化生长因子,可促进成纤维细胞、成骨细胞、神经细胞等多种细胞生长,其生物学功能主要通过不同类型受体及亚型实现,5-HT2B受体与神经系统病理生理过程关系密切[12]。有研究表明,5-HT2B受体拮抗剂可通过抑制相关通路,起到抗增殖作用,从而减轻肺纤维化程度[13]。本实验通过对5-HT2B受体进行干预,为抑制垂体瘤纤维化提供新型治疗方案。
当机体损伤较大或反复出现超出细胞自身再生能力时,间质结缔组织大量增生会对缺损区域进行修复,以维持组织器官相对完整性。胶原过度沉积是垂体瘤纤维化的显著特征,减少胶原沉积可一定程度抑制瘤体纤维化,抑制肿瘤增长。5-HT2B受体位于动物神经细胞及其他类型细胞膜上,介导血清素作为内源性配体,参与神经传导物质的传递,其可通过激活分裂-纤维化途径,参与垂体及垂体腺瘤纤维化的形成。有研究表明,当5-HT2B受体作用被抑制,成纤维细胞分化能力降低,组织纤维化进程受到抑制[14]。Janssen等[15]研究显示,SB204741作为5-HT2B受体拮抗剂的一种,可减少胶原蛋白沉积,抑制右心室纤维化,通过慢性治疗可以阻止因压力超负荷诱导引起的心脏功能衰竭的发生。本研究分别采用5-HT2B受体激动剂BW723C86和5-HT2B受体拮抗剂SB204741干预成模大鼠,结果显示,与模型组比较,5-HT2B受体拮抗剂组垂体瘤最长直径、体积及垂体质量均降低,5-HT2B受体激动剂组均升高;同时胶原沉积以对照组最少,5-HT2B受体拮抗剂组次之,5-HT2B受体激动剂组最高,表明5-HT2B受体拮抗剂可以减少胶原沉积,抑制垂体瘤增长,与既往研究结果相符。
细胞外调蛋白激酶(ERK)与肿瘤侵袭、转移过程有关,通过下调ERK相关信号通路,可降低间皮瘤纤维化程度[16-17]。TGF-β1参与组织损伤修复,当损伤因素持续存在时,使ECM异常沉积,造成组织器官功能障碍[18]。此外,TGF-β1还可通过诱导CTGF表达,促进ERK磷酸化,诱导成纤维细胞增殖,从而促进纤维化病变的发生。有研究表明,通过影响ERK信号传导过程,可抑制TGF-β1诱导的上皮-间质转化,减弱肺纤维化程度[19]。Hori等[20]研究显示,5-HT2B受体在缺乏血管和神经元的软骨组织中表达,可在软骨发育和再生过程中发挥功能,通过5-HT2B受体激动剂处理可增加ERK1/2的磷酸化,从而加快纤维化进程。而5-HT2B受体拮抗剂则通过阻断TGF-β1介导的ERK途径,抑制成纤维细胞的促纤维化,从而影响硬皮病的发生、发展过程[7]。本研究结果显示,与模型组比较,5-HT2B受体拮抗剂组大鼠垂体组织中TGF-β1、CTGF mRNA及TGF-β1、CTGF、p-ERK1/2蛋白表达降低,5-HT2B受体激动剂组均升高,表明5-HT2B受体拮抗剂可减少TGF-β1、CTGF表达,从而抑制ERK通路磷酸化活化,影响ERK信号传导过程,从而减轻垂体纤维化程度。
综上所述,5-HT2B受体拮抗剂可减轻垂体瘤大鼠垂体组织纤维化程度,抑制肿瘤增长,可能与抑制ERK相关通路有关,为临床垂体瘤治疗提供参考。
