世界食物供应中亚油酸含量高对人体健康的影响
2022-06-01AndrewSINCLAIR
Andrew J. SINCLAIR
(莫纳什大学 营养、膳食与食品系,维多利亚州 诺丁山 3168,澳大利亚)
70年来,中国的食物供应发生了巨大变化。这一点可以在中国任何一个拥有大量西式超市、西式快餐店的主要城市所展示的食品种类中得以体现。食物供应的变化引入了许多高度加工的食品,这些食品中富含脂肪和单糖,通常热量高,但缺乏全(谷物)食物中丰富的维生素、矿物质和膳食纤维[1]。
过去60年来,中国国民营养素摄入量最显着的变化是碳水化合物的减少和总脂肪摄入量的增加。脂肪摄入量从1952年的7.6%(能量百分数)增加到2011年的32.0%(4.2倍),而碳水化合物对饮食的贡献从1952年的83.0%(能量百分数)下降到 2011年的 54.3%[2-3]。宏量营养素的巨大变化引起了人们的关注,许多人质疑它们是否在过去30年中导致了中国超重、肥胖和Ⅱ型糖尿病发病率的增加[2-3]。在这种情况下,2019年Wan Y等的一项随机对照研究显示,碳水化合物和低脂肪的饮食有利于降低过度增重和腰围增加的风险,有助于血脂控制[4]。
在中国,植物油消费量的增长导致脂肪摄入量的增加。自1997年以来,植物油占饮食脂肪含量的 39.4%~44.8%[5]。由于很多植物油富含亚油酸(LA),LA的摄入量随着食物中植物油的摄入增长而增加。已公开的数据显示,1997年至2011年期间,LA是中国饮食中的主要多不饱和脂肪酸(Polyunsaturated Fatty acids, PUFA),其中约65%来自植物油。据2017年Shen X等的报道,2011年男性和女性的 LA 摄入量分别为 19.8 g/d和17.2 g/d[5]。
正如不少文献也报道,很多国家与中国的情况相似,居民膳食中亚油酸摄入很高[6]。针对此情况,本文重点讨论和解析在世界各国范围内食物供应中亚油酸含量高对人类健康的影响。
1 亚油酸(LA)在体内的作用
LA是一种必需脂肪酸(Essential Fatty Acid,EFA),由Burr和Burr于1929年在大鼠研究中发现[7]。饮食中喂食缺乏脂肪的大鼠生长缓慢,出现鳞状皮肤(爪子和尾巴),尾巴坏死,头皮屑,皮肤水分流失增加,不育并死亡[7]。通过在饮食中添加少量含有LA的植物油可以治愈这些症状。20世纪50年代,EFA缺乏症是在婴儿湿疹的临床中发现的,用含有少量LA和花生四烯酸(AA)的猪油进行治疗[8]。20世纪 60年代末和 70年代,在全肠外营养的儿童和成人中发现 EFA缺乏症[9-10]。人类对必需脂肪酸的最低需求量预估为2%(能量百分数)[8]。
随着20世纪50年代末气相色谱的出现,分析脂肪酸比以前使用的光谱法更容易。Holman R.T.的研究小组在1998年发表的研究成果证实[9],饮食中的多不饱和脂肪酸(PUFA)对动物的脂质构成有很大影响。喂食大鼠增加 LA剂量与组织中LA和AA水平的增加有关,膳食中的α -亚麻酸(ALA)与长链代谢物(如二十碳五烯酸EPA,二十二碳五烯酸DPA,二十二碳六烯酸DHA)的增加有关,他们报道了LA和ALA在代谢最终产物(分别为AA和DHA)方面的竞争。Brenner R.R.研究团队和 Actis Dato S.M.研究团队提出了 LA到AA的首选代谢途径,随后建立了LA的delta 6去饱和(FADS2酶)到18:3n-6,然后延伸到20:3n-6(Elongase 5),然后 delta 5去饱和到 20:4n-6(AA)(FADS1酶)[11-12](详见图1)。这些结论需要随着近年来对FADS基因簇SNP在合成长链(LC)n-6和n-3 PUFA中遗传变异重要性认识的深入而得到丰富[13]。
如图1所示,亚油酸(LA)存在于许多食物中。一旦被消化、吸收并在体内运输,大部分的LA通过β-氧化代谢产生能量。其余的 LA大部分存在于组织脂类中,如甘油三酯、胆固醇酯和磷脂。脂肪组织是以甘油三酯的形式储 LA的主要物质。一些亚油酸在肝脏等组织中通过去饱和链延伸途径代谢为花生四烯酸(20:4 n-6, AA)。AA还可以从肝脏运输到其他组织,主要存在于膜磷脂中。LA和AA是特殊脂质介质的前体,称为二十烷类和相关化合物;它们是在各种组织中产生的。

图1 亚油酸从食物到组织的代谢过程图Fig.1 Metabolic processing of linoleic acid (LA) from food to tissues
LA是除大脑和视网膜外大多数组织中的主要多不饱和脂肪酸[14-15](表 1)。LA摄入量的增加几乎是线性增加组织的LA水平,而AA水平达到稳定[16]。在大脑和视网膜中,主要的 PUFA是C20和C22 PUFA,如AA和DHA[17]。众所周知,在 LA积聚在膜磷脂之前,它会在大脑中迅速被β-氧化[18]。由于在细胞膜磷脂中发现了 EFA及其代谢物,最初的观点是它们在体内的主要作用与细胞膜的“流动性”有关。这可能是 PUFA的主要功能之一功能。
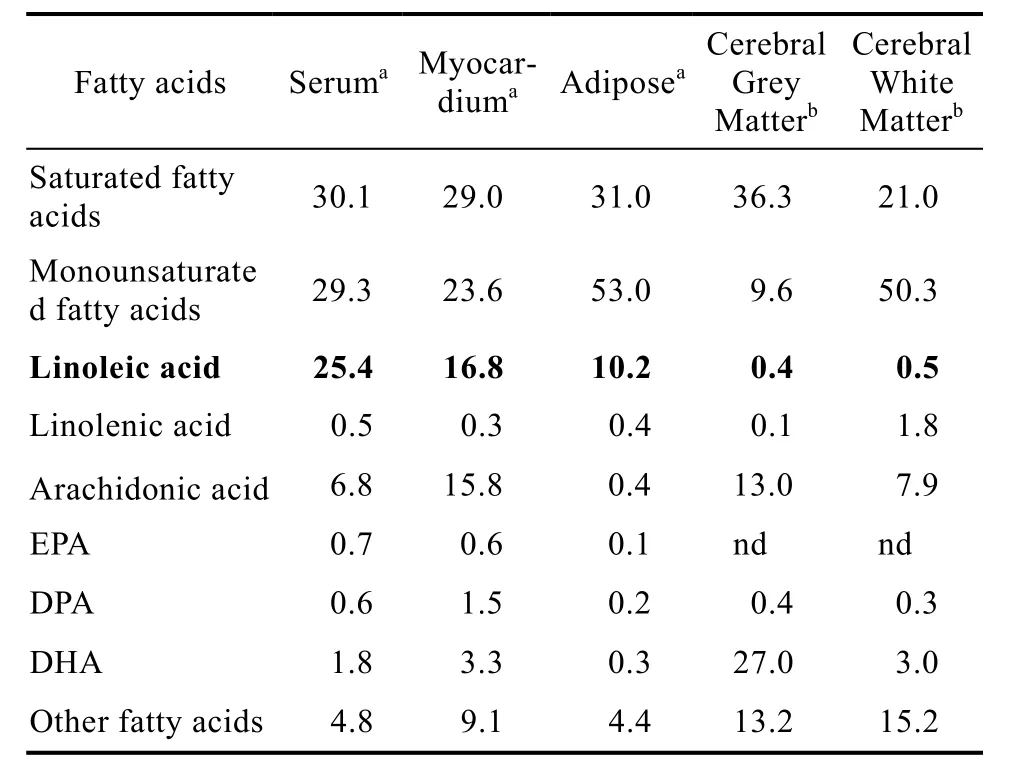
表1 人体组织中脂肪酸组成(占总脂肪酸的百分比)Table 1 Fatty acid proportions in human tissues(% of total fatty acids)
1.1 含氧衍生物的前体
20世纪60年代早期,人们认识到AA是代谢含氧衍生物前列腺素的底物[19]。从那时起,从AA中提取的一系列化合物被鉴定出来,包括通过环氧合酶、脂氧合酶或细胞色素P450,这类化合物现在被称为二十烷类化合物和相关化合物[20]或专用脂质介质[21]。二十烷类化合物在正常和病理生理学中发挥广泛的作用,包括在炎症中。还有一些众所周知的功能,如,通过血栓素 A2(TXA2)引起血小板聚集,涉及前列环素(PGI2)的血管收缩,炎症(PGE2,LTB4)和抗炎脂素(LXA4)[20-21]。最近,很明显 LA 本身可以被15-脂氧合酶代谢成羟基脂肪酸代谢物,如 9-和13-HODE和9-和13-oxoHODE[22-23],具有一系列生物学特性(图1)。专门的促分解脂质介质由长链n-3 PUFA形成,例如EPA、DPA和DHA,包括消散素、马雷素和保护素。这些化合物参与炎症的消除[21]。
1.2 降低血浆胆固醇水平
20世纪50年代和60年代,美国的食品工业对 LA产生了相当大的兴趣,当时人们发现富含LA的植物油可以降低血液中的胆固醇水平[24],而富含饱和脂肪的食物会提高胆固醇水平[25]。这一发现与含有PUFA的涂抹酱和人造黄油的生产有关,人造黄油可以取代富含饱和脂肪的黄油。一个不幸的结果是,人造黄油脂肪的生产涉及到植物油的部分氢化,以产生具有合适熔点的脂肪。这一过程产生的反式脂肪酸后来被证实为对健康有害[25-26]。由于中国大多数人的饮食并不富含饱和脂肪[5],与许多西方国家的饮食不同,LA在中国降低血浆胆固醇的相关性尚不确定。
1.3 在皮肤和伤口愈合中的作用
皮肤是防止水分流失以及防止热、机械和物理损伤的主要屏障。此外,皮肤减少紫外线辐射的有害影响,是一个免疫器官,参与从阳光中合成维生素 D。表皮脂质中富含神经酰胺,神经酰胺是一种鞘脂,而神经酰胺中 LA的含量较高。这些神经酰胺在防止表皮外失水方面起着重要作用[27]。在EFA缺乏的大鼠中,LA被油酸(一种非必需脂肪酸)取代,而油酸在这一功能上不能充分替代LA。
Ziboh及其同事 2000年发表的研究结果表明,脂氧合酶在皮肤中对LA和AA的代谢十分活跃[22]。AA通过15-脂氧合酶转化为15-HETE,LA通过15-脂氧合酶转化为13-HODE。这些单羟基脂肪酸被纳入膜 PL中,特别是磷脂酰肌醇,在诱导炎症的刺激下,导致含有13-HODE的甘油二酰基,他们报道这与抗炎/抗增殖作用有关[22]。近年来研究表明,皮肤的失水屏障需要亚油酸盐和两种表皮脂氧合酶:12R脂氧合酶和表皮脂氧合酶3。在涉及LA、脂氧合酶和神经酰胺酯酶的复杂反应中,神经酰胺与蛋白质共价结合以维持表皮屏障功能[28]。
2 高摄入LA的影响是什么?
我们需要比膳食供给更多的 LA吗?在治疗皮肤损伤的基础上,在预防 EFA缺乏方面,LA的最低要求为2%(能量百分数)[8],这相当于在2 000 kcal/d的食物摄入量中大约4 g/d。Hibbeln J.R.等报道,来自26个国家的LA摄入量范围从菲律宾的 0.90%(能量百分数)到美国的 8.91%(能量百分数)不等[6]。根据Shen等[5]报道的中国男性和女性的LA摄入量,2011年LA摄入量在 7.5%到 7.8%(能量百分数)之间。因此,与许多其他国家一样,与2%(能量百分数)的最低要求相比,中国的 LA摄入量要高得多。世界上不仅有很多人LA摄入量高,而且ALA摄入量低,DHA很少或没有[6]。2011年中国男性n-3 PUFA的摄入量为:ALA 2.0 g/d,EPA+DHA 26.9 mg/d,女性为ALA 1.7 g/d,EPA+DHA 24.3 mg/d[5]。
据我们所知,没有明显 LA 过量的迹象,因此,要回答是否有影响的问题,有必要在生理和分子水平上进行探究。
2.1 对组织脂肪酸水平的影响
增加膳食中 LA有三个主要作用。首先,组织中LA水平上升;其次,AA水平有所上升,但上升幅度小于LA;第三,长链n-3 PUFA的比例有所下降[9,16,30],如图2所示,由于LA和ALA争夺FADS2酶,组织n-3 PUFA水平下降(图1)[11-12]。最近,有研究表明,增加膳食中 LA会提升组织中LA的水平,随之LA和AA衍生的特殊脂质介质水平的也会增加,并且 n-3衍生脂质介质水平会降低[30-31]。
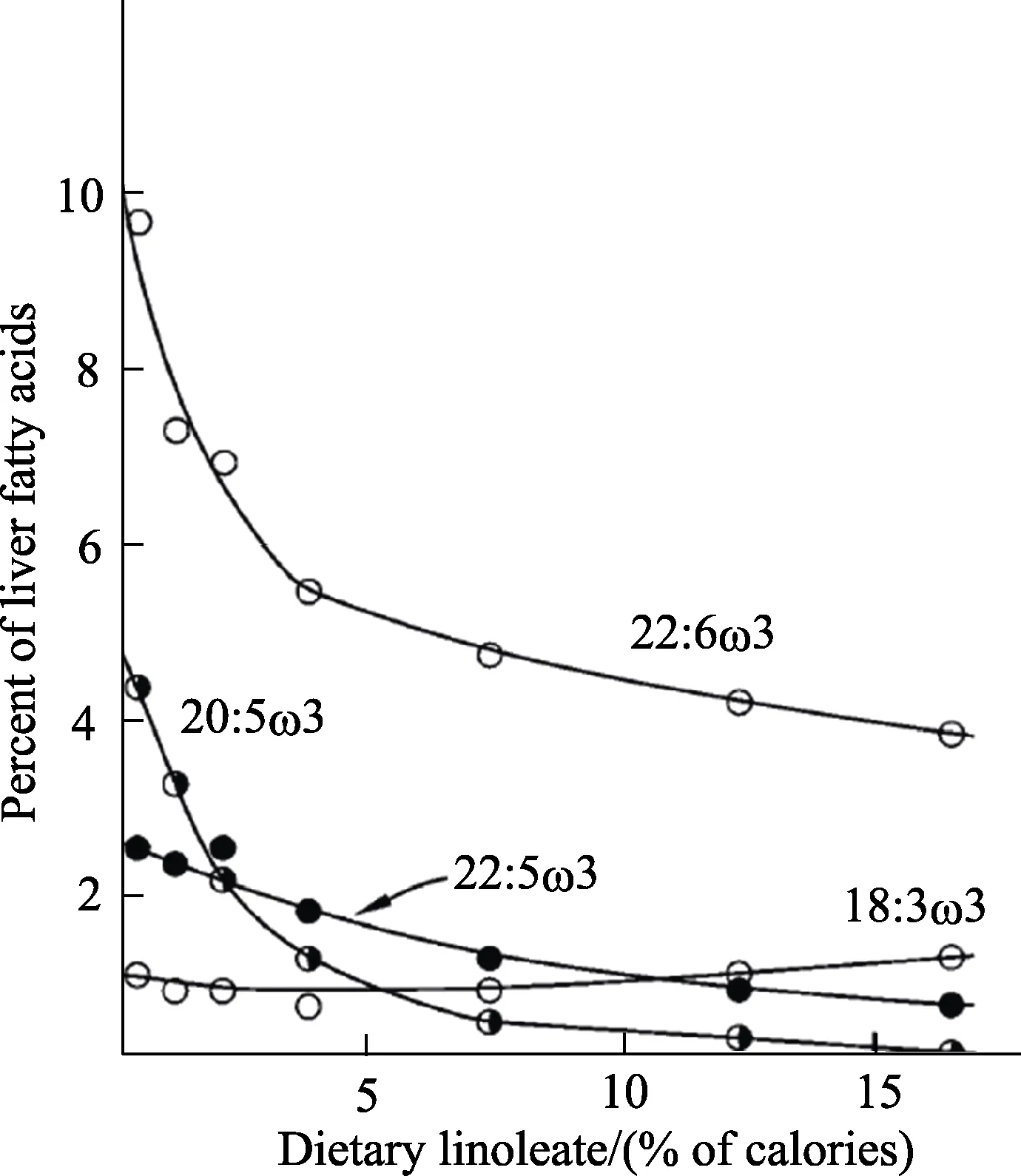
图2 增加亚油酸水平对α-亚麻酸代谢产物(18:3n-3,膳食中能量百分数为1%)影响肝脏脂肪酸组成的抑制作用[9]。Fig.2 Effect of increasing levels of linoleic acid on the suppression of metabolites of alpha-linolenic acid (18:3n-3,present in diet at 1 en%) on liver fatty acid proportions[9]
在以下部分中,将考虑 LA 和代谢物增加以及长链n-3 PUFA和代谢物减少的影响。
2.2 包括慢性头痛在内的疼痛
2.2.1 慢性关节炎
慢性关节炎常常伴随剧烈疼痛。在二十世纪90年代,研究人员推测,这可能部分是由于饮食中LA含量高,长链n-3 PUFA含量低,导致AA和EPA组织水平失衡,从而导致导致AA对LTB4(促炎症介质)的过度代谢[32]。因此,许多试验研究了使用高剂量富含n-3 PUFA的鱼油,以尽量减少来自n-6 PUFA的促炎介质的影响,并增加能够解决炎症的n-3介质的产生。Abdullrazaq M等2017年发表的综述中,阐述对1 143例患者的研究汇总分析,发现18项研究中有10项报告称,使用长链n-3 PUFA 3-6 g/d后疼痛显著减轻[32]。James等综述了可能的作用机制[34],包括EPA产生LTB5(非促炎症),从而减少了基于AA减少LTB4和EPA增加LTB5的炎症性二十碳类化合物库。此外,鱼油能够减少炎症的肽介质(TNFa和 IL-1B)。此外,EPA、DPA和 DHA是具有促进分解作用的介质前体,包括消散素、马雷素和保护素[21]。
2.2.2 慢性头痛
另一个取得重大进展的研究领域与慢性头痛有关。这种类型的疼痛被定义为每月持续4 h或持续15 d或以上的头痛,持续至少3个月,已经影响数百万美国人[35]。这项工作开始于这样一个假设,即富含 LA的现代西方饮食形成了在检测疼痛刺激的介质(来自LA和AA)与抑制疼痛的介质(来自n-3 PUFA,如EPA和DHA)之间产生了失衡。在一项随机、单盲、平行组临床营养干预试验中,67名慢性头痛患者被分配到高 n-3 PUFA、低n-6 PUFA膳食(H3L6)或低n-6 PUFA膳食(L6))干预12周[35]。研究人员为受试者提供了研究所需的大部分食物,并在整个研究过程中向他们提供咨询。H3L6组PUFA的中位摄入量为1 482 mg/d EPA+DHA和2.5%LA(能量百分数),而L6组为76 mg/d EPA+DHA和2.4% LA(能量百分数)。 这些摄入量与 H3L6组中EPA+DHA水平的增加和红细胞中 LA水平的降低有关,而在L6组中LA水平降低。研究发现,与对照组相比,H3L6组在头痛小时/天、严重头痛天数和与头痛相关的生活质量方面有显著的临床改善。H3L6组显示了来自EPA和DHA的抗伤害性介质(18-HEPE和17-HDHA)的显著增加,并且具有假定的伤害感受特性的 LA 和 AA 的羟基衍生物减少。
在第二项研究中,Ramsden C.E.及其研究团队 2021年发表的研究成果,在一项三臂平行随机、改良双盲对照试验中,研究了类似上述饮食干预是否可以减少偏头痛患者(2/3 患有慢性偏头痛)的头痛。试验饮食改为高 n-3和普通 LA(H3)、高n-3和低LA(H3L6)以及对照组(典型的美国饮食低n-3和普通LA)[36]。受试者被分配到上述三种饮食中的一种。16周时,H3和H3L6组 n-3 PUFA的中位摄入量分别从低于 50 mg/2 000 kcal增加到 1 484和1 341 mg/2 000 kcal。LA的中位摄入量在H3组为7.1%,在H3L6组为3.2%。对照组n-3摄入量为80 mg/2 000 kcal,LA为6.8%(能量百分数)[37]。两种干预饮食都显著降低了头痛的频率和严重程度,表明 H3L6组较H3组更有益处。有趣的是,这两种干预措施都减少了头痛相关药物的使用。红细胞脂肪酸如预期发生变化,两组 EPA、DHA均显著升高,H3L6组LA、AA均降低。两种干预饮食都增加了循环中的抗伤害性生物活性介质(包括 17-HDHA),这表明伤害性状态降低[36]。
大鼠研究表明,饮食中 LA剂量的增加依赖性地增加了与特发性疼痛相关的各种组织中 LA和AA的比例,并以剂量依赖性方式增加了某些组织中的氧化LA代谢物(促伤害性脂质衍生物)。此外,这些增加的LA饮食始终与组织中减少n-3 EPA和DHA及其n-3单环氧化物(推定的抗伤害性介质)有关[30]。Ramsden C.E.等2016年发表的研究为进一步研究减少膳食 LA治疗特发性疼痛提供了基础。
Ramsden等在2017年发表的研究中[38],利用系统方法将膳食亚油酸与氧化亚油酸代谢产物联系起来,这些代谢产物可能与疼痛和瘙痒有关。首先,他们发现循环 11-羟基-12,13-反式环氧-(9Z)-十八烯酸与临床疼痛减轻相关。其次,他们发现银屑病患者皮肤中的 9-酮基-12,13-反式环氧-(10E)-十八烯酸增加了 30倍。这些新发现提供了亚油酸代谢产物与疼痛和瘙痒之间的联系。
关于关节炎和头痛的研究重点强调了这些疾病与世界各地许多富含LA且n-3 PUFA缺乏的膳食的关联[6]。这种情况导致LA和AA向促炎症脂质介质过度代谢。研究表明,关节炎和慢性头痛的减轻可以通过单独大幅增加膳食长链 n-3 PUFA或同时减少LA和增加长链n-3 PUFA来改善。读者可以参考Chávez-Castillo M等2021年的一篇关于与疼痛相关的介质的综述,该综述强调了促炎症消退脂质介质[39]。
2.3 脂肪肝
非酒精性脂肪性肝病(NAFLD)的患病率正在迅速增加,与肥胖症和糖尿病的患病率平行,全世界增长范围从25%到45%[40]。NAFLD 的特点是肝脏脂肪变性和炎症,但没有过量饮酒,涵盖了从单纯性脂肪变性到非酒精性脂肪性肝炎、纤维化和肝硬化的一系列慢性肝病[41-42]。Guo X.F.等2018年发表的一项荟萃分析报告称,长链n-3 PUFA通过改善脂质代谢和抑制炎症可缓解NAFLD[43]。
据Feldstein A.等报道,LA及其氧化产物与NAFLD和酒精性脂肪肝有关;非酒精性脂肪性肝炎(一种严重的NAFLD)中LA的氧化产物(9-和13-HODEs和9-和13-oxoODEs)水平升高[44],该研究发现,LA氧化产物与炎症、纤维化和脂肪变性等肝脏病理标志物之间存在显着相关性。
在这项研究后,研究注意力转向富含 LA的饮食是否可能导致 NAFLD[45]。特别是,膳食中存在的氧化亚油酸代谢物(OXLAM)是否可能是一个促成因素。这些OXLAMS是由于富含LA的植物油的热应力而引发的[45]。在这项研究中,给小鼠喂食富含 OXLAMS的饮食,但它们没有发现肝脏脂肪水平增加,但研究称脂肪酸氧化和脂质过氧化增加与氧化应激增加、线粒体功能障碍和肝细胞死亡增加有关。Warner D.R.研究小组2017年发表的进一步研究表明,小鼠的高LA饮食与 OXLAMS(9-HODE)水平升高有关,这导致酒精对小鼠乙醇诱导的肝损伤的影响恶化[46]。
2.4 对神经和视网膜功能的影响
2.4.1 在试验动物上的研究
红花油、花生油和玉米油中LA含量高,ALA含量低,[LA]∶[ALA]>50∶1。用含有这些油作为唯一脂质来源的饮食喂养动物会导致 n-3 PUFA缺乏,并进而导致组织中长链n-3 PUFA(尤其是DHA)的显著缺乏,特别是在大脑和视网膜中[47]。许多研究的结果一致显示,饮食中n-3的缺乏会导致学习、应对压力、行为改变以及视觉功能、听觉功能和嗅觉功能的反应发生变化。这些变化可归因于 DHA所在的神经细胞膜中缺乏DHA。Sinclair2019年[47]总结了这些研究的结果并提出神经DHA缺乏的主要损害是:
“膜脂的柔韧性/压缩性影响整体膜蛋白(受体、电压门控离子通道和酶)的最佳功能。结果,这导致了对第二信使系统的影响,并随后由于来自起始受体的“弱化”信号而影响了神经递质浓度。由于有超过800亿个神经元,并且神经元之间的突触连接要多出许多倍,因此预计由于膜蛋白特性改变而导致的信号“效率”损失非常小,会导致大脑和视觉功能发生有意义的变化。也可能导致神经传递受损的下游效应之一可能部分归因于次优的脑能量代谢(葡萄糖进入大脑),欧米茄3缺乏症显着降低。因此得出结论,DHA是最佳神经元功能的必需脂肪酸。”[47]
还有什么可以发现的吗? 答案是肯定的。最近的数据强调了富含LA和低ALA的饮食如何可能导致AA对PGE2和其他介质的神经代谢增强。Begg等[48]报道老年大鼠下丘脑中磷脂酶 A2、环氧合酶和PGE合酶的mRNA水平显著升高,下丘脑中PGE2、提示下丘脑膜脂肪酸失衡引起炎症反应(AA和其他n-6 PUFA增加,DHA降低)。n-3缺乏是由富含LA和极低水平ALA的膳食引起的。在这项工作之后,研究人员对 n-3缺乏或对照饮食的小鼠进行了Y-迷宫测试,以检验其对学习的影响,该测试涉及空间识别记忆[49]。与对照组(+ALA饮食)相比,n-3缺陷小鼠在Y-迷宫试验中新异臂进入显著减少。 特别有趣的是,可以通过用含有 ALA 的饮食或通过在饮用水中添加COX抑制剂(萘普生,0.07 mg/mL)来喂养第3代缺陷小鼠来恢复新异臂进入。这些数据表明,认知障碍不仅仅是大脑中缺乏 DHA的结果,还涉及到 AA-环氧合酶通路的中介产物。目前尚不清楚COX抑制剂是否会导致n-3 PUFA缺乏动物神经功能的其他方面的恢复。
2.4.2 这种情况会发生在人类身上吗?
全世界许多人的LA摄入量高,ALA摄入量低,而DHA很少或没有[6]。食物中的DHA基本上只主要来自鱼类和其它海洋食品,或者有能力消费含 DHA的补充剂。许多人以素食为主,越来越多的西方人选择成为素食主义者[50]。此外,干旱、饥荒和战争完全破坏了食物供应,在这些情况下,人们无法根据食物的营养成分选择食物。然而,一个不变的事实是,LA 在全世界大多数食物中都含量丰富。
2.4.2.1 新生儿脑脂肪酸 两项研究表明,与母乳喂养的婴儿(含有DHA)相比,高LA-低ALA婴儿配方奶粉喂养的婴儿大脑皮层中 DHA比例降低[51-52]。然而,如今,大多数婴儿配方奶粉都含有DHA,所以在这种情况下,大脑和视网膜的DHA水平应该得到充分支持。
2.4.2.2 婴儿断奶食品 如果婴儿从出生时就喂食低ALA食物,然后断奶时再吃同样低ALA和低DHA的食物,则低ALA和DHA的饮食可能会影响大脑和视网膜 DHA水平。很少有断奶食品被报道含有足够的 DHA含量[53-54];因此,婴儿将依赖于膳食中充足的ALA、脂肪组织中充足的 DHA以及含有 DHA的食物(鱼类和海洋食品),这些食物在不同的文化环境中可能有,也可能没有。
2.4.2.3 纯素食者和素食者 纯素食者和素食者的饮食中通常缺乏DHA,因为这种PUFA存在于鱼、鸡蛋和一些肉类中。此外,纯素和素食饮食通常有较高的[LA]∶[ALA]比率(>16∶1)。Burns-Whitmore B等2019年发表的一篇综述详细介绍了纯素食饮食和组织中的脂肪酸水平[50]。 这篇综述的结论之一是,素食者应该增加ALA的摄入量,减少LA的摄入量,以达到膳食[LA]∶[ALA]为 4∶1[50]。
2.4.2.4 低收入国家、饥荒和难民 低收入国家的人们无法获得ALA或DHA水平都足够的食物供应,例如在世界旱地农业区的人们。虽然有两份关于当前这些地区母乳成分的报告表明,LA水平相对较高而 DHA水平较低[55-57],但是对婴儿n-3状况的研究很少。Stephenson K等2021年发表的一项研究从马拉维治疗严重急性营养不良即食治疗食物(RUTF)发现,即RUTF含有DHA和亚油酸水平很低((LA)∶1.5∶1(ALA))与标准相比即食治疗食物食物(LA)∶(ALA)的11.6∶1,可用于6个月导致改善认知能力,其结果有显著效果[58]。难民在获取食物方面面临很大的不确定性,他们几乎没有机会根据ALA或DHA相关的营养含量来选择食物。
3 结论
在世界范围内,目前 LA的摄入量远远超过了最低要求。此外,大多数国家的长链n-3 PUFA摄入量较低。这两个因素导致组织中n-6 PUFA和n-3 PUFA的不平衡。由于这些PUFA是促炎和抗炎脂质介质的前体,所以,这些介质的不平衡就会引起炎症。此外,这些脂质介质是前体伤害性和抗伤害性介质的前体。新的证据表明,疼痛相关介质的这种失衡,包括源自LA的新型OXLAMS,可能会导致关节炎和慢性头痛。本文还对 n-6和n-3多不饱和脂肪酸在非酒精性脂肪肝和神经功能中的失衡进行了综述。当前世界膳食系统造成膳食LA与n-3 PUFA的不平衡,这也可能是导致亚健康状态的原因之一。
