机器人辅助腹腔镜下保留肾单位手术治疗肾门肿瘤的经验体会(附14例报告)
2022-06-01邝金陈光丁兵鲁雄兵张信基
邝金 陈光 丁兵 鲁雄兵 张信基
肾门肿瘤的定义为一类紧靠中央肾门结构(血管及集合系统)的肾肿瘤[1]。此类肿瘤实施保留肾单位手术较为困难,术中出现出血而转为根治性肾切除术及术后发生尿漏的可能性增加[2]。目前,达芬奇机器人手术系统因具有三维立体视野及精确、灵活的可操作性而被广泛应用于泌尿外科手术领域。借助机器人平台,术者可以进行更为精准的切割和灵活的缝合,从而完成肾门肿瘤保留肾单位手术[3]。本院自2018年10月至2019年10月已成功实施14例肾门肿瘤机器人腹腔镜下保留肾单位手术,现报告如下,同时,对该术式治疗肾门肿瘤的临床可行性及手术技巧进行分析。
对象与方法
一、一般资料
本组患者共14例,其中男9例,女5例。年龄40~65岁,平均52.5岁。除1例患者因腰痛入院,其余患者均由体检发现。肿瘤最大直径为2.1~5.6 cm,平均3.3 cm,左右侧各7例。术前R.E.N.A.L.评分为6.0~10.0分,平均7.5分。术前患者均行双肾薄层CT平扫+增强扫描及腹部CTA了解肾动脉走形、分支情况以及肿瘤与集合系统的关系。术前患肾GFR为32~54 ml/(min·1.73 m2),平均为43.6 ml/(min·1.73 m2)。其余术前检查均正常,无手术禁忌,合并高血压3例、糖尿病2例。
二、手术方法
1.手术入路及通道建立:手术均采用达芬奇Xi系统完成。本文以1例右侧肾门肿瘤(图1)经腹腔途径为例,并进行详细阐述。取健侧斜70°卧位,升高腰桥。于脐上一横指旁正中线处做一约12 mm切口,作为观察孔(A点、3号臂)。以Veress法建立气腹,如患者有腹部手术既往史,则可采用哈森法建立气腹,维持气腹压力为12 mmHg。以A点为中心,距离6 cm,于头侧(B点、4号臂)及足侧(C点、2号臂)分别做8 mm切口,直视下置入机器人Trocar。于C点足侧6 cm处置入另一8 mm机器人Trocar(D点、1号臂)。取脐上2 cm处(E点)置入12 mm Trocar,作为助手辅助孔(图2)。调整镜头角度,连接器械。4号臂连接单极弯剪;2号臂可根据术者操作习惯连接马里兰双极钳或有孔双极钳;1号臂连接有孔双极钳。
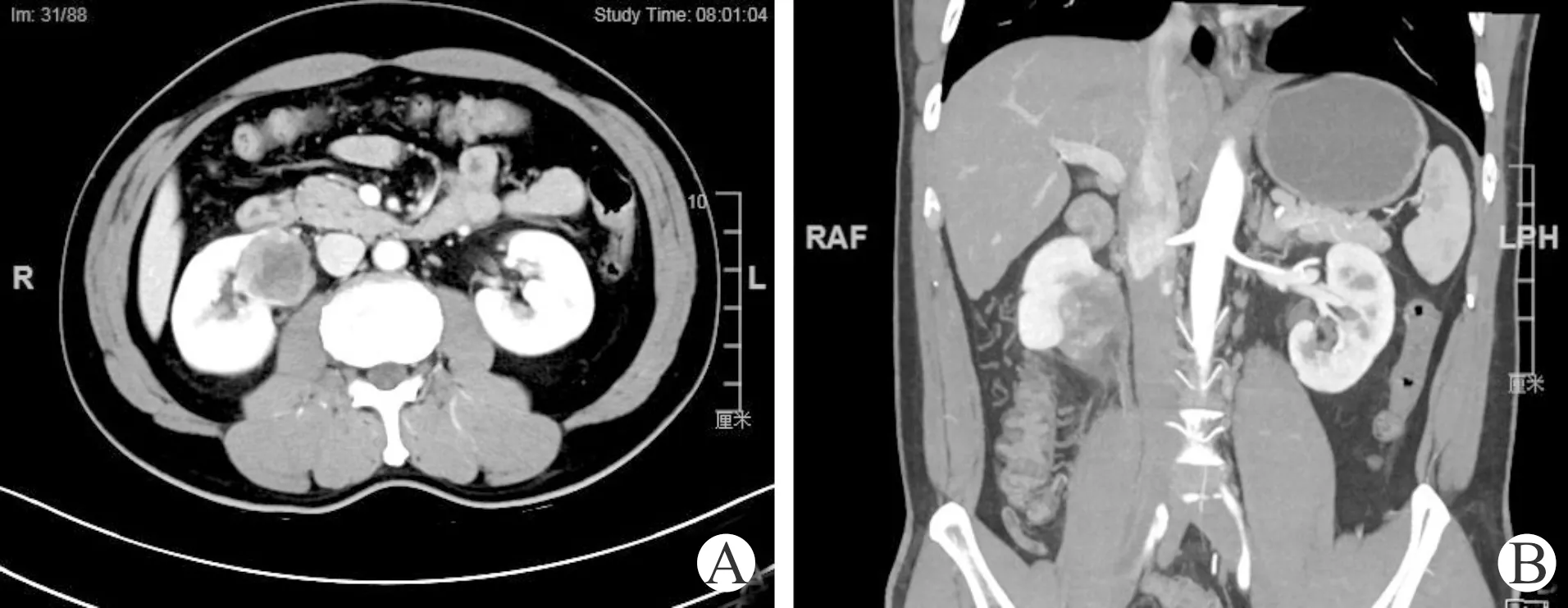
A:肿瘤位于肾门前唇;B:输尿管紧邻肿瘤
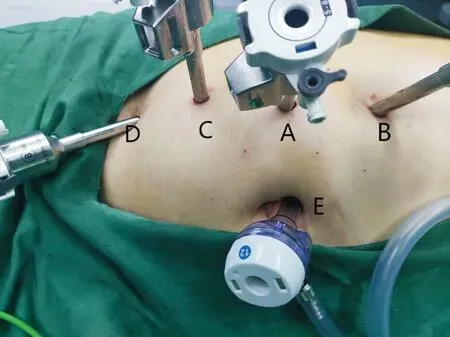
图2 套管摆放位置
2.肾门结构暴露:沿结肠旁沟游离结肠,将结肠翻转至内侧。纵行打开Gerota筋膜后显露肾蒂,游离肾静脉。在肾静脉后方仔细游离肾动脉腹侧,结合术前双肾CT平扫+增强扫描及腹部CTA影像寻找有无异位肾动脉及提早分支,用吊带标记肾动脉。根据术中情况,对肾脏上下极进行游离,使肾脏可进行一定程度翻转,有利于肾门及肿瘤边界的暴露。沿输尿管由下自上仔细游离至肾门处,使肾门结构充分暴露(图3A)。
3.肾窦间隙的“解剖”:分离肾门处脂肪,显露肾静脉、动脉及输尿管解剖位置关系。沿肾静脉主干,对肾窦内结构进行分离。应用有孔双极钳(1号臂)作为牵拉臂,牵拉或托举瘤体,显露肿瘤位于肾窦内的边界,并将血管与肿瘤基底分开(图3B)。
4.切除与缝合:准确识别肿瘤与周围肾实质边界,用单极弯剪预先标记肿瘤切缘。阻断肾动脉,沿预先标记线切除肿瘤(图3C、3D)。切至肿瘤与血管、集合系统接触区域时,采用“锐钝结合”切除肿瘤,避免大血管损伤及肿瘤假包膜的破裂。第一层采用可吸收线缝合深层的肾实质及残端的小血管(图3E),使两侧创缘向中央靠近。第一层缝毕后,检查无明显活动性出血后,松开阻断夹。采用倒刺线+hem-o-lock夹免打结技术对创缘进行第二层“裙边式”缝合(图3F)。靠近肾门血管一侧方向进针,向肾皮质表面一侧出针。缝合完毕后,取出标本,使用薇桥线缝合腹膜,留置术区引流管。缝合关闭切口,结束手术。
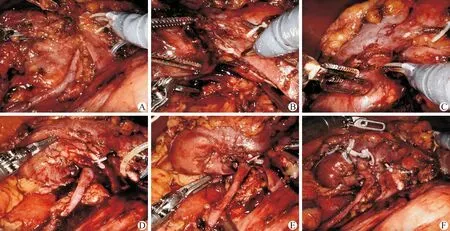
A:肾门的“暴露”,可见肿瘤紧靠输尿管;B:沿肾静脉主干分离肾窦内间隙,充分暴露肿瘤的内侧边界;C:切除起始点,即肿瘤与周围正常肾组织交界最薄处;D:肿瘤完整切除后的巨大创面;E:第一层缝合深层的肾实质及残端的小血管,使两侧创缘向中央靠近;F:对创面两侧创缘进行“裙边式”缝合
结 果
14例手术均顺利完成,无术中输血或中转为其他术式病例。平均手术时间为118(90~200)min,平均肾动脉阻断时间为25(17~41)min,平均术中出血量为90(56~200)ml。术后平均肾周引流管留置时间为3.9(3~6)d,平均住院时间为5.1(4~9)d,14例患者均未出现泌尿系统相关并发症(血尿及尿漏)。病理回报:12例恶性肿瘤切缘均为阴性,其中肾透明细胞癌9例、乳头状肾细胞癌3例;2例为良性血管平滑肌脂肪瘤。术后6个月复查患肾GFR平均为32.3(25~49)ml/(min·1.73 m2),14例均未出现复发及转移。
讨 论
随着外科手术器械的发展以及微创技术的成熟,保留肾单位手术已成为局限性肾癌治疗的“金标准”[4]。肾部分切除术具有与根治性切除术相同的瘤控效果且可保留更多的肾单位,从而使患者远期生存获益[5]。然而,是否选择肾部分切除术要结合详细的术前评估及术者经验进行综合判断。长期以来,因肾门部位肿瘤相对复杂的解剖位置,主刀医师对肾门肿瘤患者实施肾部分切除术时需面临以下几个技术难点与挑战:①在切除肿瘤过程中,术中损伤血管及集合系统而造成围手术期出血及术后尿漏的风险增加[6]。②肿瘤边界的完整暴露较外生性肿瘤更为困难,切除过程中因边界不清导致肿瘤残留,致使切缘阳性风险增加。Shim等[7]的研究表明,肾门部位为肾部分切除术后复发的影响因素。③相较于外生性肿瘤,肾门区域肿瘤的切除及缝合难度较高,从而导致热缺血时间相对较长[8]。
目前,达芬奇机器人手术系统因具有三维立体视野及精确、灵活的可操作性而被广泛应用于泌尿外科手术领域[9]。与传统腹腔镜下肾部分切除术(laparoscopic partial nephrectomy, LPN)相比,机器人辅助腹腔镜下保留肾单位手术在肾门肿瘤的完整暴露、精准切除及创面缝合方面均有明显优势[10]。本研究结合我院手术病例资料及文献复习,对肾门肿瘤行机器人辅助腹腔镜下保留肾单位手术的经验总结如下。
一、结合R.E.N.A.L.评分进行精确术前评估
对于肾门肿瘤保留肾单位手术,全面、精准的术前评估是手术成功实施的基础。术前应完善双肾薄层CT+增强及腹部CTA检查,了解肿瘤位置、大小、与集合系统毗邻关系以及有无肾动脉变异情况出现。R.E.N.A.L.评分系统作为目前广泛应用的肾脏评分系统,具有使用方便、可重复性强,可代表肿瘤解剖学复杂程度的特点[11-12]。在双肾增强CT影像的基础上联合R.E.N.A.L.评分可以对肾门肿瘤解剖复杂程度进行结构化、定量化的术前评估。术者可根据R.E.N.A.L.评分高低对具体手术方式进行选择,对术中热缺血时间及术中、术后并发症做出预测[13-14]。对于评分较低的低等复杂组肾门肿瘤(R.E.N.A.L.评分4~6分),可结合患者经济条件选择传统LPN或机器人辅助腹腔镜下保留肾单位手术。本研究中,14例患者术前R.E.N.A.L.评分平均为7.5分,机器人辅助腹腔镜下保留肾单位手术均顺利进行。其中1例肿瘤相对较大(最大径为5.6 cm),患者术前R.E.N.A.L.评分为10分(高等复杂组),其动脉阻断时间(41 min)及出血量(200 ml)均明显高于平均值。对于此类肿瘤直径过大或完全内生性的高等复杂组肾门肿瘤(R.E.N.A.L.评分10~12分),应结合术者经验谨慎选择肾部分切除术。术前应预先制定切除、缝合方案,避免肾动脉阻断时间过长。预估术中集合系统损伤可能性较大时,术前可经尿道向患侧放置一根输尿管导管。若术中切除肿瘤后难以判断集合系统是否受损时,可通过导管注入美蓝,观察创面有无颜色变化来判断集合系统受损情况,以便指导后续创面缝合。必要时,可在术前留置双J管,以避免术后严重血尿及尿漏的发生。
二、手术入路的选择
随着国内外中心对肾门肿瘤行机器人辅助腹腔镜下保留肾单位手术的逐渐开展,目前主要的手术入路为经腹腔及经后腹腔途径[1,15]。术者应综合患者肿瘤位置、大小及自身腔镜手术经验进行评估,从而选择最优的手术入路。经腹腔途径术野开阔,操作空间大,周围解剖标志清晰,有利于肾门肿瘤的直接暴露。对位于腹侧、前唇及直径较大的肾门肿瘤,应优先考虑经腹腔途径,但术中有损伤周围脏器如肝脏、脾脏及肠管的风险。对于背侧或肾门后唇肿瘤,则优先考虑经后腹腔入路。经后腹腔的优势在于肠道受干扰较小,患者术后通气时间更早[16]。对于术者而言,由于肾动静脉的解剖位置关系,经后腹腔途径可直接对肾动脉进行分离。但经后腹腔途径术中操作空间较小,对于肥胖或肾周脂肪皂化的患者,在分离腹膜外脂肪及肾周脂肪时相对困难且耗时。
三、肾窦间隙的“解剖”
肾门为肾窦的开口,血管、输尿管均经此进入肾脏。肾窦则为肾实质围绕形成的腔隙,其内有血管、肾盂、神经等结构。对于肾门肿瘤而言,其内侧边界位于肾窦内,对此处行切除极易损伤肾窦内血管及集合系统。高宇等[17]研究表明,通过对肾窦间隙的解剖,可将贴近肿瘤的血管进行分离,避免血管损伤,进而安全完成肾门肿瘤的保留肾单位手术。术中应先充分暴露肾门(图3A),如经后腹膜途径,可将肾脏先进行翻转。仔细游离肾门周围及肾窦内脂肪组织,明确肾静脉、动脉及输尿管解剖位置关系。此时可顺着肾血管主干,对肾窦内结构进行分离。利用机器人的第三机械臂作为牵拉臂,牵拉或托举瘤体,可顺利显露肿瘤位于肾窦间隙的“内部边界”(图3B)。当游离至肾窦间隙深处,此时可见肾段动脉的分支。结合术前薄层CT及CTA影像,可以找到供应肿瘤的动脉并进行夹闭与离断。
四、肿瘤的切除及特殊缝合策略的应用
肿瘤的完整切除和创面缝合既是手术的关键步骤,也是手术操作难点所在。在对肾窦间隙进行精细“解剖”后,仔细辨别肿瘤与肾实质的边界。在阻断动脉前,可用电剪标记预估切缘。选择肿瘤与周围正常肾组织交界最薄处作为切除起始点(图3C),采用“锐钝结合”方式对肿瘤进行切除。切除靠近肾门血管一侧,尽量使用钝性剥离方式将血管分支剥离肿瘤假包膜表面。肿瘤切除后的缝合应结合创面情况采用不同的缝合策略。对于巨大创面,可采用分层缝合法。第一层采用可吸收线缝合深层的肾实质及残端的小血管(图3E),使两侧创缘向中央靠近,降低第二层缝合张力。第二层缝合采用可吸收倒刺线+hem-o-lock夹进行连续缝合(图3F),此类缝合方式可缩短热缺血时间[18]。当创面巨大而导致分层缝合时间过长时,可在完成第一层缝合后,松开血管阻断夹,减少热缺血时间。若创面不规则,难以使两侧创缘对合时,可灵活应用C字缝合、V形缝合等缝合技术。此外,还需注意的是缝合过程应从靠近肾门血管一侧进针,向肾皮质表面一侧出针,进针不易过深,避免缝扎分支动脉及集合系统。当术中因切除肿瘤出现肾静脉主干或较大属支破损时,可先用hem-o-lock夹进行夹闭。若破损处较大而难以夹闭时,可用proline缝线进行缝合。
总之,机器人辅助腹腔镜下保留肾单位手术治疗肾门肿瘤是一种安全、可行的手术方式。应用新一代的机器人手术系统,术前采用R.E.N.A.L.评分精确评估,术中仔细“解剖”肾窦内间隙,选择合适的切除及缝合策略,可实现肾门肿瘤肾部分切除术的“三连胜”目标。
