circATRNL1与circPDE4B在前列腺癌组织中的表达及临床意义
2022-06-01张春雷杨琦康亚芬徐东波孟冬冬常德辉
张春雷 杨琦 康亚芬 徐东波 孟冬冬 常德辉
前列腺癌是欧美国家男性恶性肿瘤中发病率最高的肿瘤[1],即便是在亚洲地区,其发病率也逐年上升[2],因此,探索其发病机制及潜在的肿瘤分子标志物显得越来越重要。近年来,环状RNA(circular RNAs, circRNAs)在疾病发生、发展中的作用逐渐被发掘,尤其是在肿瘤疾病的研究中,范围几乎涵盖了各个系统的恶性肿瘤。为了进一步探索circRNAs在前列腺癌疾病进程中发挥的作用,我们通过从前列腺癌患者癌及癌旁组织的高通量测序结果中筛选出的circRNAs来探索其在前列腺癌疾病中的研究价值。
材料与方法
一、组织测序方法
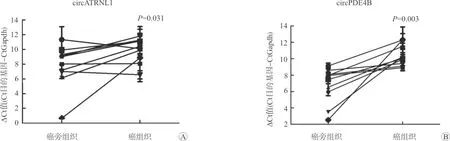
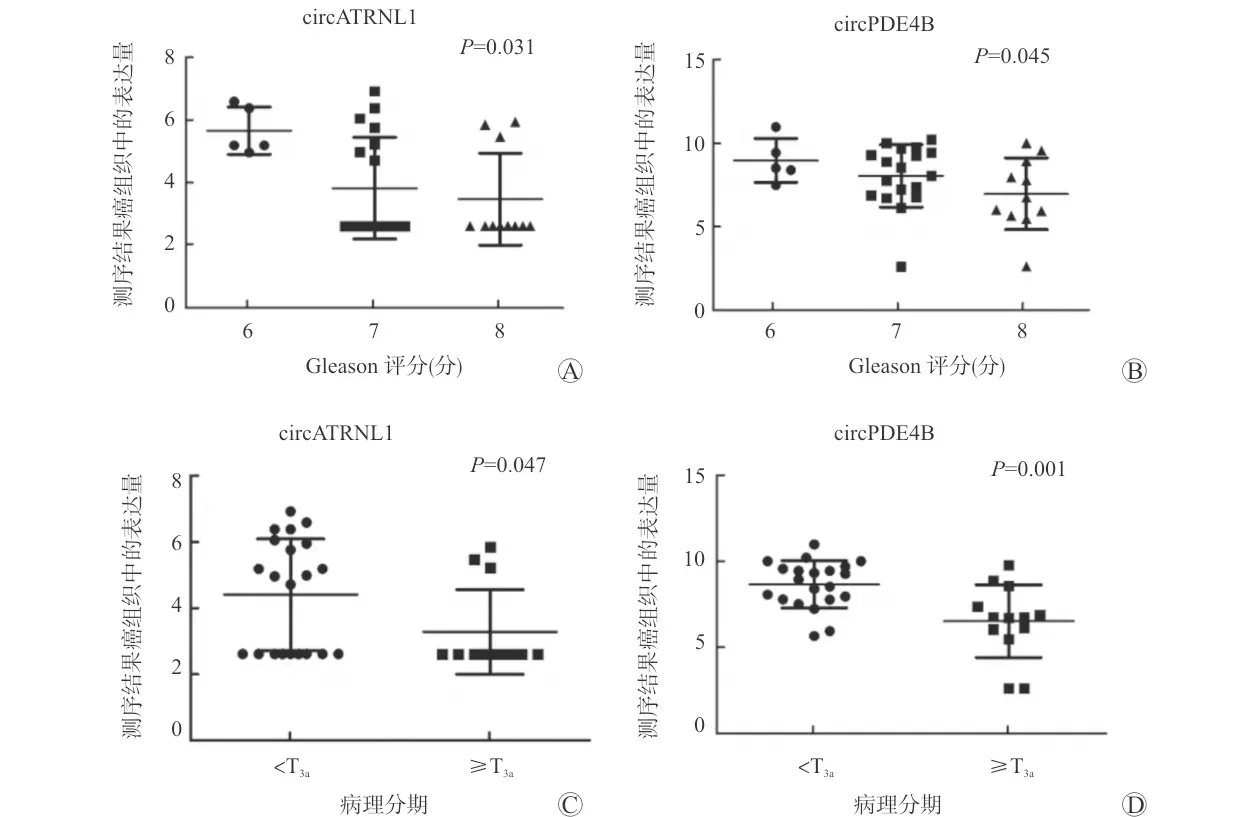
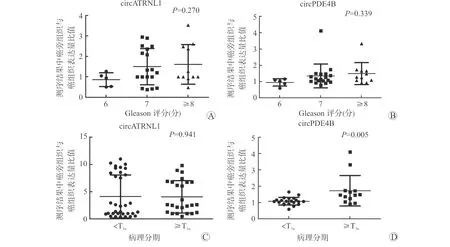
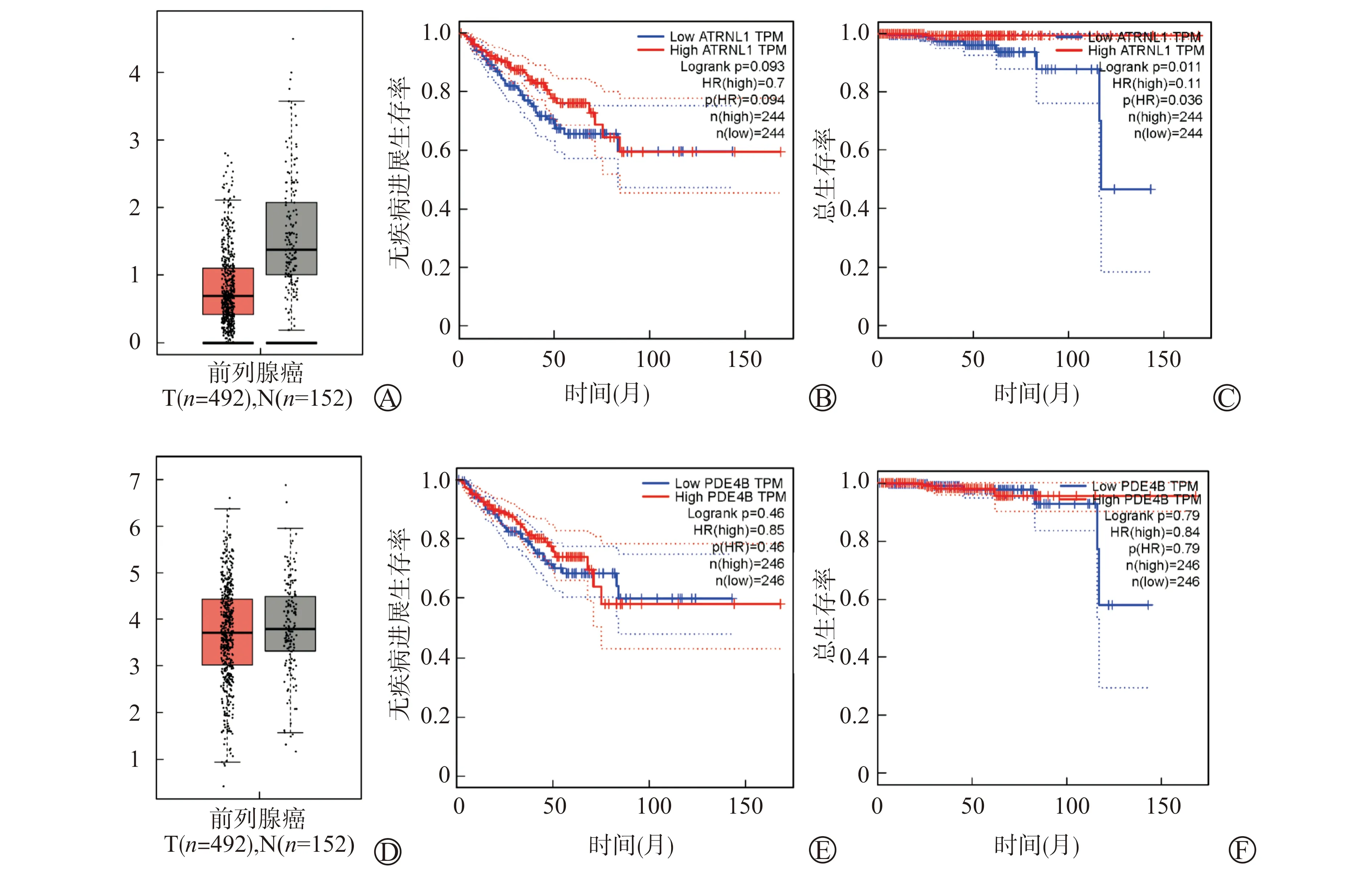
对选取的34例前列腺癌患者的癌及癌旁组织样本进行高通量测序,采用edgeR统计学方法确定两组样本之间差异表达的circRNAs,差异表达的标准为错误发现率(false discovery rate, FDR)<0.05、P<0.05、|log2|>1。患者平均年龄(68.9±6.7)岁,PSA (28.8±37.6)ng/ml,肿瘤分期 二、组织RNA提取 选取10例癌及癌旁组织样本进行RNA提取,将组织在液氮中磨碎,每50~100 mg组织加入1 ml Trizol(Trizol,Life Technologies,美国),匀浆处理后采用Trizol法常规提取RNA。 三、RNA反转录 按照RNA反转录试剂盒(PrimeScript®RT Master Mix试剂,Takara,中国)中推荐的剂量配制反应体系,放至PCR仪,按照37 ℃ 15 min、85 ℃ 5 s条件进行反转录。 四、RT-qPCR 按照RT-qPCR试剂盒(SYBR®Premix Ex TaqTM试剂,Takara,中国)中推荐的剂量配制反应体系并放入仪器中,采用两步法RT-qPCR的默认设定程序进行检测,每个样品重复检测3次。表达量用ΔCt值表示,该值越高说明其表达量越低。引物如下:circATRNL1(F:AGCATTGCCAGGGAACAA;R:GGATAGCCTTCAATGAGCCA);circPDE4B(F:CAGAGTGAAAGGGCAAGGAC;R:CATCACCGTCATCACACTCC);Gapdh(F:AAGA-AGGTGGTGAAGCAGG;R:GTCAAAGGTGGAGGAGTGG)。 五、数据库应用 使用KOBAS 3.0在线分析软件对亲本基因进行基因本体(Gene Ontology, GO)及京都基因和基因组数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG)分析,提取癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库中前列腺癌标本及临床信息进行亲本基因预后分析,使用circbank网站进行circRNA与miRNA结合预测,并应用mirPath对这些miRNAs进行GO及KEGG分析,通过circinteractome网站预测circRNAs是否与蛋白质存在结合位点,利用ORF Finder网站预测是否拥有开放阅读框(open reading frame, ORF)及IRESite网站预测是否具有内在的核糖体进入结合位点(internal ribosome entry site, IRES)。 六、统计学方法 采用SPSS 21.0软件分析数据,计量资料采用均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析,图片采用GraphPad Prism 5进行绘制,P<0.05为差异有统计学意义。 一、circATRNL1与circPDE4B的选择及验证 通过对34例前列腺癌患者的癌及癌旁组织样本进行circRNAs的高通量测序,选取相对于癌旁组织在癌组织中显著下调且排名前20的circRNAs。选取10例病理确诊为前列腺癌患者的癌及癌旁组织进行RNA提取,对反向引物扩增片段进行Sanger测序以及利用RT-qPCR在癌及癌旁组织中验证circRNAs的表达量。筛选出了既满足Sanger测序结果正确、又满足在癌组织中显著下调的2个circRNAs:circATRNL1(hsa_circ_0020094)与circPDE4B(hsa_circ_0008433)作为研究对象,两者均收录在circBase数据库中,基因序列、Sanger测序结果见图1。circATRNL1及circPDE4B在癌组织中的表达量显著低于癌旁组织(P<0.05),见图2,证明测序结果的可靠性。 A:circRNAs序列;B:反向引物扩增片段Sanger测序 A:circATRNL1在癌及癌旁组织中的表达量;B:circPDE4B在癌及癌旁组织中的表达量 二、不同Gleason评分和病理分期癌组织中circATRNL1与circPDE4B的表达差异 为了探索circATRNL1与circPDE4B在癌组织中的表达量与前列腺癌的恶性程度是否有关,按照Gleason评分分为6、7及≥8分3组和病理分期 A:测序结果中circATRNL1在不同Gleason评分分组癌组织中的表达量;B:测序结果中circPDE4B在不同Gleason评分分组癌组织中的表达量;C:测序结果中circATRNL1在不同病理分期分组癌组织中的表达量;D:测序结果中circPDE4B在不同病理分期分组癌组织中的表达量 三、不同Gleason评分和病理分期癌旁组织与癌组织中表达量的比值差异 为了排除不同组织间表达差异的影响,同时探索circATRNL1、circPDE4B各自在癌旁组织和癌组织中表达量的差异是否与疾病的恶性程度有关,按照Gleason评分、病理分期分别对两种circRNAs各自在癌旁组织及癌组织中表达量的比值进行分析,结果表明,在病理分期较高的组别中,癌旁组织与癌组织中circPDE4B表达量的比值较高(P<0.05),余差异无统计学意义(P>0.05),见图4。 A:测序结果中circATRNL1在不同Gleason评分分组中癌旁组织与癌组织中表达量的比值;B:测序结果中circPDE4B在不同Gleason评分分组中癌旁组织与癌组织中表达量的比值;C:测序结果中circATRNL1在不同病理分期分组中癌旁组织与癌组织中表达量的比值;D:测序结果中circPDE4B在不同病理分期分组中癌旁组织与癌组织中表达量的比值 四、circATRNL1、circPDE4B亲本基因的功能分析及预后分析 为探索circATRNL1与circPDE4B对前列腺癌疾病进展的影响,进一步对二者亲本基因的功能、在前列腺癌及对照组织中表达的差异以及预后效能进行了分析。GO分析表明,ATRNL1参与调节细胞迁移等细胞功能,PDE4B参与cAMP分解代谢过程、细胞对药物的反应等,KEGG分析表明,PDE4B参与cAMP、代谢等信号通路,ATRNL1无相关KEGG信号通路分析,详见表1。TCGA数据库结果分析表明,虽然在癌组织中ATRNL1与PDE4B均表现出了与对应circRNAs相同表达下降的趋势,但无统计学差异(P>0.05),在预后分析中,ATRNL1的低表达预示着较差的总生存期(overall survival, OS)(P<0.05),但其表达与无疾病进展生存期(disease free survival, DFS)无关(P>0.05),结果显示PDE4B的表达与前列腺癌患者的OS及DFS无关(P>0.05),见图5。 表1 亲本基因ATRNL1及PDE4B的GO分析及KEGG分析 A:ATRNL1在前列腺癌肿瘤组织(T)及正常组织(N)中表达量的对比;B、C:ATRNL1对前列腺癌患者DFS及OS的预测分析;D:PDE4B在前列腺癌肿瘤组织(T)及正常组织(N)中表达量的对比;E、F:PDE4B对前列腺癌患者DFS及OS的预测分析 五、circATRNL1、circPDE4B可能参与的作用机制 为探索circATRNL1与circPDE4B可能参与的作用机制,从与miRNAs结合预测、与蛋白质结合预测及转录翻译蛋白潜能预测等3个方面进行分析。从circbank数据库得知,与circATRNL1存在结合位点的miRNAs共92个,与circPDE4B存在结合位点的miRNAs共35个,表2中每组列举了预测分值较高且在疾病进展中发挥重要作用的10个miRNAs。通过mirPath对每组靶miRNAs进行GO分析及KEGG分析,结果表明这些miRNAs参与许多重要生物细胞功能及信号通路,在GO分析中,两者共有的比较重要的为细胞周期、凋亡过程、胰岛素受体信号通路、细胞对缺氧的反应等,其中circATRNL1特有的为AR信号通路、Ras蛋白信号转导等,circPDE4B特有的为MAPPK活性激活等。在KEGG分析中,两者共有比较重要的为细胞周期、p53、FoxO、Hippo信号通路等,并包括许多癌症相关信号通路,包括前列腺癌、膀胱癌、结直肠癌、非小细胞肺癌、脑胶质瘤等,其中circPDE4B比较特殊的为脂肪酸代谢及合成等。通过circinteractome网站预测circATRNL1与AFU1、HuR、TDP43存在结合位点,未预测到circPDE4B与蛋白质存在结合位点。ORF Finder网站及IRESite网站预测circATRNL1与circPDE4B存在的ORF和IRES,结果表明circATRNL1存在12个ORF,52个IRES,circPDE4B存在2个ORF和53个IRES。 表2 circbank网站预测circRNAs与miRNAs结合情况 近年的研究表明circRNAs在前列腺癌的发生、发展中具有重要作用。比如下调的circRNA-Foxo3可以促进前列腺癌的进展,并促使对多西他赛化学耐药性的形成[3],circRNA-UCK2通过作为miRNA-767-5p海绵增加TET1的表达,进而抑制前列腺癌细胞的增殖和侵袭能力[4],外泌体中circ_0044516促进前列腺癌细胞的增殖和转移,并可能作为前列腺癌潜在的生物分子标志物[5]。为了进一步探索circRNAs在前列腺癌中所发挥的作用,以及作为肿瘤标志物的潜在价值,我们对34例前列腺癌患者的癌及癌旁组织样本进行circRNAs的高通量测序,在肿瘤组织中,相比较高表达的circRNA,低表达的circRNA往往在疾病的发病及进展中发挥更加重要的作用[6],因此我们选择测序结果中在前列腺癌组织中低表达的前20个circRNAs进行RT-qPCR验证及Sanger测序,筛选出了circATRNL1与circPDE4B作为研究对象。一项关于circRNA对口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)放疗效果影响的研究表明,上调的circATRNL1通过抑制诱导细胞凋亡和细胞周期停滞来增强OSCC对放疗的敏感性,放疗后其表达水平降低[7]。进一步研究表明,circATRNL1可以充当miR-23a-3p的海绵,从而促进抑癌基因PTEN的表达,增强OSCC对放疗的敏感性[7]。另一项研究表明,在视网膜病变的模型中,下调的circPDE4B促进缺氧诱导因子-1α(hypoxia inducible factor-1α, HIF-1α)和血管内皮生长因子A上调,其作用机制研究证明了circPDE4B通过靶向作用于miR-181c从而促进HIF-1α降解来抑制视网膜病理性血管生成[8],HIF-1α及血管内皮生长因子A均是肿瘤疾病进展的关键作用因子,因此circATRNL1与circPDE4B是否也通过调节肿瘤相关蛋白的表达来调控前列腺癌疾病的进展值得深思。 为了探索circATRNL1与circPDE4B在癌组织中的表达含量与前列腺癌的恶性程度是否有关,按照Gleason评分、病理分期分别对测序结果中癌组织的circATRNL1与circPDE4B表达量进行了分析,结果表明,Gleason评分或者病理分期越高,癌组织中circATRNL1与circPDE4B的表达量越低,说明两种circRNAs的低表达与前列腺癌的恶性程度有关。为了排除不同组织间表达差异的影响,同时探索circATRNL1、circPDE4B各自在癌旁组织和癌组织中表达量的差异是否与疾病的恶性程度有关,按照Gleason评分、病理分期分别对两种circRNAs各自在癌旁组织及癌组织中表达量的比值进行分析,结果表明,circPDE4B在病理分期较高的组别中,癌旁组织与癌组织中表达量的比值显著升高。以上结果预示着低表达的circATRNL1与circPDE4B可能与前列腺癌疾病进展及恶性程度有关。 circRNAs的功能通常与宿主基因存在一定的相关性,我们进一步对circATRNL1与circPDE4B亲本基因的功能、在前列腺癌组织及癌旁组织中表达差异以及预后效能进行了分析。ATRNL1与PDE4B参与多种重要细胞生物功能,包括参与代谢通路、对药物的反应等,并且低表达的ATRNL1预示着前列腺癌患者的不良预后,而有相关报道表明PDE4B下调激活蛋白激酶A,进而促进前列腺癌的进展[9]。因此,这两种circRNAs是否通过调节亲本基因的表达来发挥这些作用进而促进前列腺癌的进展也是值得进一步探索的。 当然,circRNAs的表达与功能也并非一定与其线性转录本相似,甚至只有少数的circRNAs差异表达变化是与其线性转录本同步的[6,10],因此,我们针对circRNAs本身进行了机制探索。目前,circRNAs在肿瘤发生、发展中的作用机制主要集中在circRNA-miRNA-mRNA,下调的circRNAs可能通过释放更多的miRNA发挥抑制或促肿瘤作用。为了探索这种关系,我们利用circbank网站预测与circATRNL1和circPDE4B存在结合位点的miRNAs情况,结果表明多种miRNAs分别与两种circRNAs存在结合位点,其中包括与前列腺癌疾病进展密切相关的miRNAs。如Zhang等[11]发现,长链非编码RNA FENDRR通过竞争性结合miR-18a-5p可降低前列腺癌的恶性程度,Maeno等[12]发现在雄激素剥夺的条件下,miR-582-5p的上调可调节前列腺癌细胞的增殖。两种下调的circRNAs是否通过释放这些miRNAs促进肿瘤的进展有待进一步探索。同时我们对各自的靶miRNAs进行了GO分析及KEGG分析,结果显示这些靶miRNAs参与多种肿瘤进展相关的细胞功能及信号通路,包括细胞周期、凋亡、胰岛素受体、p53、FoxO、Hippo信号通路等等,其中AR信号通路在前列腺癌疾病进展中发挥至关重要的作用,AR的多种突变体参与去势抵抗性前列腺癌进程[13]。另外,我们还发现circPDE4B参与脂肪酸代谢信号通路,而脂肪酸代谢是影响前列腺癌治疗的关键因子[14-15]。 除了作为miRNAs海绵,circRNAs仍然具有翻译蛋白、影响基因的剪接转录、与蛋白质结合调节蛋白质功能等作用机制,我们对此也进行了初步探索。在预测与蛋白质结合时,仅发现circATRNL1与RNA结合蛋白存在结合位点,其中HuR与circRNAs关系最为密切。研究表明circPABPN1与HuR的相互作用可降低其亲本基因PABPN1转录本的翻译效率[16], circAGO2通过作用于HuR,激活被HuR抑制的AGO2-miRNA复合物的功能并促进前列腺癌等肿瘤疾病的进展[17]。拥有ORF及内IRES是预测RNA能否翻译蛋白的重要因素,在分析过程中我们发现两者均具有ORF及大量的IRES,因此是否通过翻译蛋白发挥作用也是值得深入研究的。 本研究根据癌组织中circATRNL1和circPDE4B表达情况预估其与前列腺癌发生、发展的关系,应用生物信息学技术对可能参与的作用机制进行了分析,其确切作用及分子调控机制有待进一步分子生物学实验证明。circRNAs具有高度的稳定性及组织表达特异性等特征,是作为肿瘤分子标志物的良好选择,circATRNL1与circPDE4B有望作为前列腺癌的诊断或预后指标,但仍需更多血液样本的检测,其能否作为治疗的靶点也需进一步探索。结 果


讨 论
