基于JAK/STAT信号通路研究纳米氧化钛致卵巢损伤的分子机制*
2022-06-01高国栋马增力余兴火钟师黄林凤
文/高国栋,马增力,余兴火,钟师,黄林凤
前期研究者研究了纳米氧化钛颗粒暴露致卵巢损伤和基因表达谱的改变,并且对纳米氧化钛暴露导致卵巢损伤的机制做了初步研究。在前期的研究基础上我们需要从JAK/STAT信号通路进一步研究纳米氧化钛暴露致小鼠卵巢损伤的机制。现列举SPF级ICR小鼠96只进行分组讨论。具体报告如下:
1 资料及方法
1.1 一般资料
采购上海西普尔必凯实验动物有限公司的SPF级ICR小鼠96只,其随机分为两组,包括0、2. 5、5、10mg/kg纳米化钛实验组和0、2. 5、5、10mg/kg纳米氧化钛+JAK阻断剂实验组。前组小鼠周龄为(7.52±0.26)周,后组小鼠周龄为(7.56±0.25)周;前组小鼠体重为(32.25±2.55)g,后组小鼠体重为(32.25±2.55)g,上述两组小鼠的组间差距无统计学意义(P>0.05),具有可比性。具体内容如表1。

表1 一般资料比较[±s]
1.2 方法
将重点基于JAK/STAT信号通路研究纳米氧化钛暴露致小鼠卵巢损伤的机制。比较分析JAK抑制剂处理小鼠与未用抑制剂处理小鼠在5mg/L纳米氧化钛暴露90d后小鼠血清生殖性激素AMH以及JAK/STAT信号通路SOCS3基因表达水平。同时,雌性小鼠于5毫克/千克的纳米氧化钛胃内连续给药90d,分析其卵巢炎症发生率。
1.3 统计学方法

2 结果
2.1 小鼠卵巢中功能JAK/STAT信号通路基因表达水平
在纳米氧化钛(5nm)灌胃处理90d后,纳米氧化钛在卵巢聚集,导致卵巢萎缩、元素分布失衡、性激素紊乱、生殖功能障碍,雌性小鼠的生育力和怀孕率下降。微阵列分析显示:与纳米化钛实验组相比,纳米氧化钛处理的小鼠卵巢中功能JAK/STAT信号通路基因表达水平显著改变。具体情况见下图1。
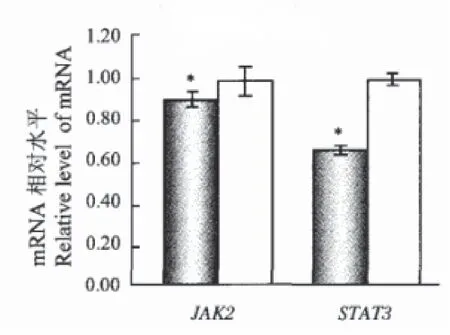
图1 小鼠卵巢中功能JAK/STAT信号通路基因表达水平
2.2 纳米氧化钛(5nm)在小鼠卵巢中的作用
为了更好地了解纳米氧化钛(5nm)如何在小鼠卵巢中的作用,雌性小鼠于5毫克/千克的纳米氧化钛胃内连续给药90d,结果显示纳米氧化钛暴露可导致卵巢指数下降、卵泡闭锁,卵巢生殖功能障碍,卵巢炎症反应发生。其中,纳米化钛实验组小鼠发生卵巢炎症率高于纳米氧化钛+JAK阻断剂实验组,组间差异具有统计学意义(P<0.05),具体情况见下表2:
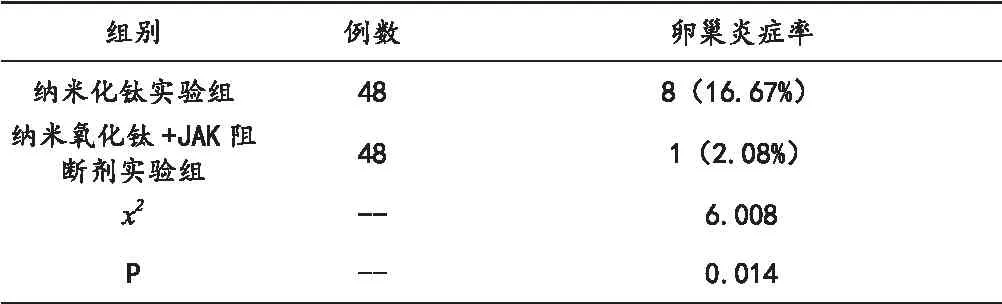
表2 两组小鼠发生卵巢炎症率比较[n,%]
2.3 纳米氧化钛(5nm)导致小鼠血液AMH下降
纳米氧化钛(5nm)暴露90d后引起小鼠血液AMH下降,暴露30d、60d、90d后卵巢组织AMH水平呈不同程度下降,暴露90d后AMH下降尤其明显,组间差异具有统计学意义(P<0.05),表明纳米氧化钛暴露造成小鼠卵巢储备功能下降。将其强表达设置为3,正常表达设置为2,低表达设置为1。具体情况见表3。

表3 纳米氧化钛对于小鼠AMH含量变化比较[±s]
2.4 纳米氧化钛(5nm)导致小鼠卵巢SOCS3下降
纳米氧化钛(5nm)暴露30、60、90d后导致卵巢组织SOCS3蛋白浓度降低,暴露90d后SOCS3下降明显组间差异具有统计学意义(P<0.05)。具体情况见表4。

表4 纳米氧化钛对于小鼠SOCS3mRNA相对定量变化比较[±s]
3 讨论
JAK-STAT信号传导通路在动物中高度保守。JAK-STAT的名称是由两个基因组成:激酶Janus(Janus kinase)和转录因子STAT(signal transducer and activator of transcription),它们共同参与细胞对各类细胞因子和生长因子的应答作用。应答类型涉及细胞增殖、分化、迁移、凋亡和细胞存活等。对于多细胞动物来说,细胞之间的有效沟通对于发育、组织和生物体的体内平衡以及宿主防御至关重要。进化为这个问题提供了许多解决方案,但其中JAK-STAT途径是结构上最简单的范例之一。JAK-STAT是一个非常简单的通路,以极少的中间步骤将胞外信号从跨膜受体传递到细胞核。最初,科学家是在干扰素信号传导途径中发现该通路,后续则发现多种细胞因子、集落刺激因子和激素都可以通过JAK-STAT通路传递信号。
随着纳米材料的广泛应用,纳米氧化钛潜在卫生安全越来越受到人们的高度关注。纳米氧化钛颗粒的直径小于100nm。纳米氧化钛颗粒具有很大的表面积和表面原子数,表面积和表面张力随着粒径的下降急剧增加。纳米氧化钛由于其独特的小尺寸效应、表面效应、量子尺寸效应及宏观量子隧道效应等导致纳米微粒的热、磁、光、敏感特性以及表面稳定性等不同于常规粒子。纳米氧化钛颗粒可通过皮肤、消化道和呼吸道等与包括产业工人在内的人体直接接触,各种数量级的纳米氧化钛直接或者随产品以各种不同的途径进入体内某些特定的部位富集,并产生内在毒性效应,其生物毒理学已引起科学界的极大关注。近年来的研究,不仅证实口服纳米氧化钛颗粒可以造成生物毒性,而且对纳米氧化钛引起动物肝、肺、肾、脑、脾等的损伤进行了研究,并且阐明了相应的损伤机制。高国栋在文献中阐述,纳米氧化钛染毒大鼠睾丸组织发生明显的病理学改变,纳米氧化钛对雄性大鼠有生殖毒性效应,并且纳米氧化钛的生殖毒性效应明显强于纳米氧化硅。纳米二氧化钛可以抑制睾丸支持细胞TM4的活性,诱导细胞凋亡。但是纳米氧化钛对动物卵巢毒性的研究鲜有报道。
卵巢的生殖功能主要是合成并且分泌性激素和产生卵子并且排卵。抗缪勒氏管激素(AMH)比尿促卵泡素(FSH)、黄体生成素(LH)、雌二醇(E2)等更早地反映原始卵泡池中卵泡数量,更早期、准确反映卵巢功能状态,并且AMH不受下丘脑-垂体-卵巢轴的调控,在月经周期中水平恒定,无周期性变化,可在月经周期中任一d抽血检测。此文献提出基于JAK/STAT信号通路研究纳米氧化钛暴露致小鼠卵巢生殖毒性的机制,并且利用JAK抑制剂进一步研究纳米氧化钛暴露后导致卵巢损伤的机制,从而进一步理解纳米氧化钛颗粒暴露后导致卵巢生殖毒性的分子机制,为预防纳米氧化钛颗粒暴露后卵巢毒性提供实验依据。在纳米氧化钛(5nm)灌胃处理90d后,纳米氧化钛在卵巢聚集,导致卵巢萎缩、元素分布失衡、性激素紊乱、生殖功能障碍,雌性小鼠的生育力和怀孕率下降。雌性小鼠于2.5、5和10毫克/千克的纳米氧化钛胃内连续给药90d,结果显示纳米氧化钛暴露可导致卵巢指数下降、卵泡闭锁,卵巢生殖功能障碍,卵巢炎症反应发生。纳米氧化钛(5nm)暴露90d后引起小鼠血液AMH下降,暴露30d、60d、90d后卵巢组织AMH水平呈不同程度下降,暴露90d后AMH下降尤其明显,组间差异具有统计学意义(P<0.05),表明纳米氧化钛暴露造成小鼠卵巢储备功能下降。纳米氧化钛(5nm)暴露30、60、90d后导致卵巢组织SOCS3蛋白浓度降低,暴露90d后SOCS3下降明显组间差异具有统计学意义(P<0.05)。
综上所述,文章通过分析纳米氧化钛暴露后卵巢组织中J AK/STAT信号通路研究、纳米氧化钛暴露后对卵巢 JAK/STAT信号通路的改变、JAK抑制剂分析纳米氧化钛对卵巢损伤以及体外研究实验,显示纳米氧化钛暴露可导致卵巢指数下降、卵泡闭锁,卵巢生殖功能障碍,卵巢炎症反应发生,证明基于JAK/STAT信号通路由于纳米氧化钛引起卵巢损伤,阐明J AK/STAT信号通路在纳米氧化钛对卵巢损伤中机制及作用。
