鸡星状病毒、禽肾炎病毒和鸡传染性支气管炎病毒多重PCR检测方法的建立
2022-05-31栾庆东尹燕博王建琳
栾庆东 , 曹 旭 , 尹燕博 , 王建琳
(青岛农业大学动物医学院 , 山东 青岛 266109)
家禽尿酸盐沉积是由于体内嘌呤代谢异常而导致尿酸生成过多,或肾脏功能障碍而导致尿酸排出障碍造成体内尿酸水平过高,以尿酸盐的形式在体内沉积,分为内脏型痛风和关节型痛风[1]。据报道,家禽尿酸盐沉积在世界范围内存在,是导致家禽死亡的重要因素之一[2]。引起鸡尿酸盐沉积的原因有多种,包括病原微生物感染、饲养管理和营养性因素等,其中病毒感染主要包括鸡肾型传染性支气管炎病毒(Infectious bronchitis virus,IBV)[2]、禽肾炎病毒(Avian nephritis virus,ANV)[3]和鸡星状病毒(Chicken astrovirus,CAstV)[4]。
肾型IBV是鸡传染性支气管炎的主要类型之一,为γ冠状病毒,具有强烈的嗜肾性,该病毒感染后改变了多种代谢途径而导致肾脏损伤,临床以肾脏肿大、苍白,肾小管和输尿管内尿酸盐沉积为主要病理特征[5],是多年来影响我国养鸡业的重要疾病。ANV最初被认为是一种小核糖核酸病毒,2000年Imada等根据其核苷酸序列特征将之归为星状病毒,该病毒感染成年鸡后无明显临床症状,感染雏鸡引起生长发育缓慢和肾脏损伤,临床患鸡出现腹泻、间质性肾炎和尿酸沉积等特征[6]。CAstV最初被归为是肠道样流感病毒,与临床鸡的矮小—发育迟缓综合征、生长抑制等相关,鸡星状病毒感染肉鸡后出现明显的体重增长缓慢、肠道损伤和肾脏损伤等现象[7-10],且部分毒株感染后出现明显的尿酸盐沉积[4,10]。近年来,不断有研究报道我国存在鸡星状病毒感染[11-13]。
鉴于IBV、ANV和CAstV是引起鸡尿酸盐沉积的主要病毒,且在我国鸡群中广泛存在,本研究拟建立这3种病毒的多重PCR检测方法,以期为临床家禽尿酸盐沉积的诊断及这3种病毒感染的监控提供方法,为这3种病毒感染引起疾病的流行病学研究及综合防控提供基础。
1 材料与方法
1.1 病毒 鸡星状病毒(CAstV)、禽肾炎病毒(ANV)、鸡传染性支气管炎病毒(IBV)、J亚型禽白血病病毒(Avian leueosis virus subgroup J,ALV-J)、鸡马立克式病毒(Marek′s disease virus,MDV)、血清4型禽腺病毒-I群(Fowl adenovirus virus 4,FAdV-4)和减蛋综合征病毒(Egg drop syndrome virus,EDSV)均为本实验室鉴定保存毒株。
1.2 试剂和载体 DNAiso、RNAiso Plus、pMD18-T、M-MLV反转录试剂盒、2×Mix,均购自宝生物工程(大连)有限公司;TIANprep Mini Plasmid Kit、大肠杆菌感受态细胞DH5α,均购自天根生化科技(北京)有限公司;Gel Extraction Micro Kit,购自康为世纪生物科技有限公司。
1.3 方法
1.3.1 病毒核酸的提取与反转录 按照DNAiso和RNAiso Plus说明书提取FAdV-4、MDV、EDSV的DNA和CAstV、ANV、IBV和ALV-J的RNA,RNA按照M-MLV反转录试剂盒说明书反转录为cDNA,将DNA和cDNA保存在-80 ℃冰箱备用。
1.3.2 引物设计与合成 根据GenBank中登录的CAstV的ORF-1b基因、ANV的ORF-1b基因和IBV的N基因分别设计了3对特异性引物(表1),引物由北京睿博兴科生物技术有限公司合成。

表1 CAstV、ANV和IBV检测用引物序列
1.3.3 标准质粒的制备 将保存的病毒cDNA进行PCR扩增,每种病毒的反应体系均为25 μL:2×TaqMix 12.5 μL,模板1 μL,正向引物和反向引物各1 μL,用8.5 μL蒸馏水补足体系至25 μL。PCR扩增程序:第1阶段95 ℃ 5 min;第2阶段30个循环,94 ℃ 30 s,CAstV 55 ℃(IBV 57 ℃,ANV 50 ℃) 30 s,72 ℃ 1 min 30 s;第3阶段72 ℃ 10 min。通过1.5%琼脂糖凝胶电泳鉴定PCR产物。通过胶回收试剂盒回收目的片段,然后将各个目的片段连接到pMD18-T载体上,转化后挑取单克隆,通过PCR验证后阳性质粒送测序,测序正确的产物提取质粒。测序由北京睿博兴科生物技术有限公司完成。
1.3.4 PCR扩增反应的条件优化 取CAstV、ANV 和IBV 的cDNA,在建立单项PCR反应条件基础上,建立多重PCR检测方法,优化多重PCR的退火温度,以确定最佳反应条件。PCR扩增产物经1.5%的琼脂糖凝胶电泳鉴定。
1.3.5 多重PCR的特异性、敏感性和重复性试验 应用优化后的多重PCR分别对FAdV-4、EDSV、MDV和ALV-J进行特异性检验。提取CAstV、ANV 和IBV的标准质粒后测定其浓度并计算拷贝数,将标准质粒进行10倍倍比稀释进行多种PCR敏感性的检测,从而确定多重PCR检测方法的最小检测限度。以构建的标准质粒为模板,采用建立的多重PCR检测方法,检测第3周和第5周放置的模板,从而验证所建立方法的可靠性和重复性。
1.3.6 临床病料的检测 随机采集临床尿酸盐沉积鸡的肝脏、肾脏等脏器,加入5倍量生理盐水后匀浆。置于-80 ℃冰箱反复冻融3次,7 500 r/min离心取上清液,提取核酸。用单项PCR和本试验建立的多重PCR方法进行检测。
2 结果
2.1 单项PCR方法的建立 单项PCR的反应体系:2×TaqMix 12.5 μL、正向引物(10 mmol/L)和反向引物(10 mmol/L)各1 μL、模板 2 μL、ddH2O 8.5 μL;扩增程序:95 ℃ 5 min;94 ℃ 30 s,CAstV55 ℃(IBV 57 ℃,ANV 50 ℃)30 s,72 ℃ 1 min 30 s,30个循环;72 ℃ 10 min。扩增产物经1.5%琼脂糖凝胶电泳鉴定,CAstV、ANV和IBV 均能扩增出预计条带,大小分别为350 bp、794 bp和1 600 bp(图1),经测序结果均正确。

图1 CAstV的ORF-1b基因、ANV的ORF-1b基因和IBV的N基因的PCR扩增结果
2.2 多重PCR检测方法的建立 通过设置梯度退火温度来确定多重PCR检测方法的最佳退火温度条件,最终确定多重PCR检测方法的最佳扩增程序:95 ℃ 5 min;94 ℃ 30 s,53.1 ℃ 30 s,72 ℃ 1 min 30 s,30个循环;72 ℃ 10 min(图2)。
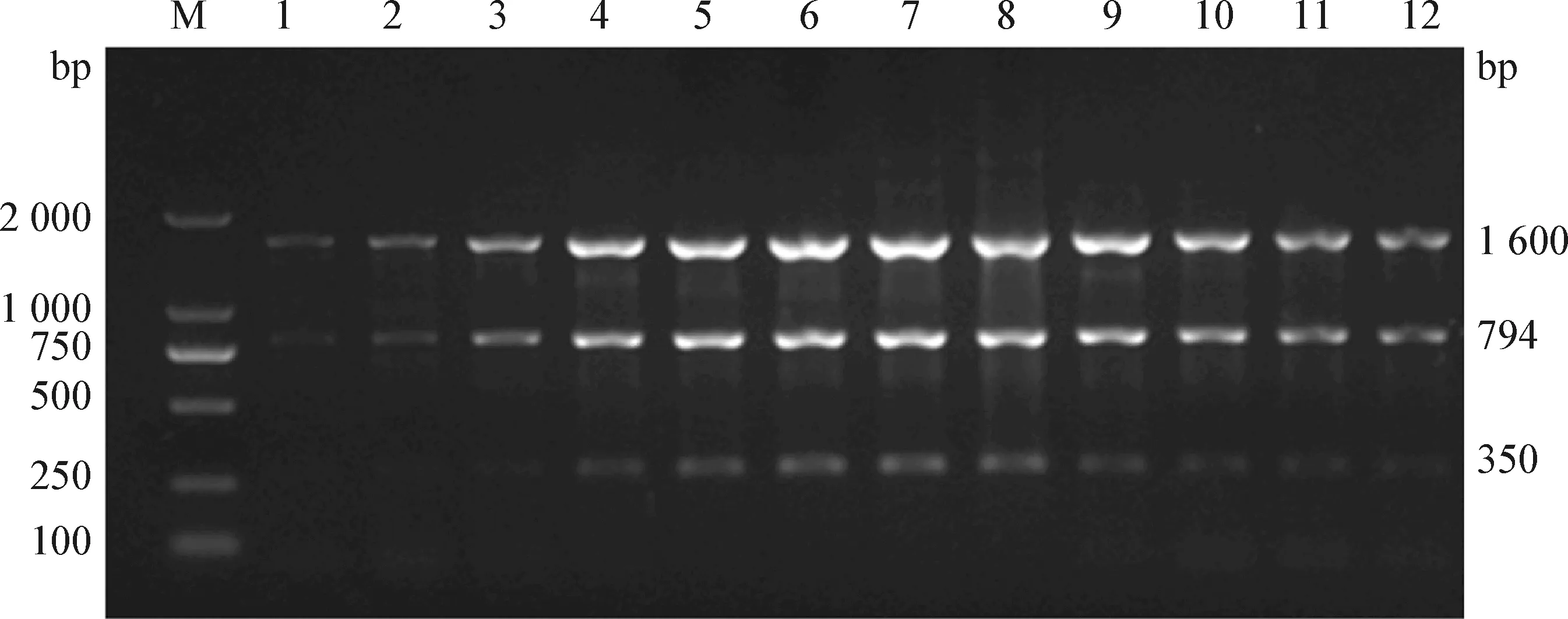
图2 CAstV、ANV和IBV多重PCR检测方法优化退火温度
2.3 特异性检测 取实验室保存的毒株FAdV-4、EDSV、MDV的DNA和ANV、CAstV、IBV、ALV-J的RNA,RNA反转录为cDNA,按照已确认的多重PCR检测方法的反应条件进行扩增。其中CAstV、ANV和IBV均可扩增出与预期一致的条带,而FAdV、EDSV、MDV和ALV-J均无特异性条带(图3)。

图3 CAstV、ANV和IBV多重PCR检测方法的特异性
2.4 敏感性检测 用TIANprep Mini Plasmid Kit试剂盒提取标准质粒,检测标准质粒的浓度为CAstV 222 ng/μL、ANV 241 ng/μL和IBV 276 ng/μL,经公式换算得出拷贝数为CAstV 6.68×1010copies/μL、ANV 6.30×1010copies/μL和IBV 5.87×1010copies/μL。 将质粒10倍倍比稀释后,经多重PCR检测方法的检测得出最低检测限为CAstV 1.33×105copies/μL、ANV 2.10×102copies/μL和IBV 1.96×102copies/μL(图4)。

图4 CAstV、ANV和IBV多重PCR检测方法的敏感性试验
2.5 重复性试验 为验证所建立方法的可靠性和稳定性,以建立的标准质粒为模板,在第3周和第5周2个不同时间段使用不同PCR仪器进行检测,第3周和第5周的检测结果如图5、图6所示,CAstV的最低检测限仍为1.33×105copies/μL,ANV的最低检测限为2.10×103copies/μL,IBV的最低检测限为1.96×103copies/μL。结果表明建立的方法具有可靠性和稳定性。

图5 第3周重复性试验
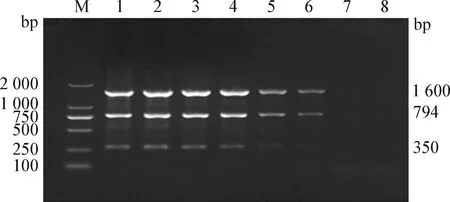
图6 第5周重复性试验
2.6 临床病料检测 采集临床痛风病料20份,核酸经反转录后,同时采用单项PCR检测方法和本试验建立的多重PCR检测方法进行检测,2种检测方法结果完全一致,IBV阳性率为15%,ANV阳性率为5%,CAstV阳性率为5%(图7)。
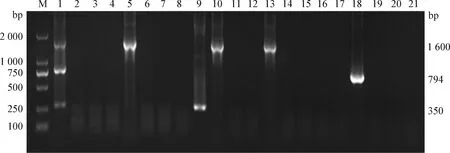
图7 CAstV、ANV和IBV多重PCR检测方法对临床病料的检测结果
3 讨论
家禽痛风是家禽常见的重要疾病之一,世界各地均有报道,大部分家禽痛风是群体发病且死亡率较高,有时可高达30%[14]。尿酸由肝脏产生,是鸟类氮代谢的最终产物,主要通过肾脏排出体外,当肾脏排出障碍,如输尿管阻塞、肾脏损伤等,将导致高尿酸血症,尿酸盐将沉积于心脏、肝脏、肠系膜和气囊表面等,严重病例可在脾脏和其他器官内沉积,内脏尿酸盐的沉积可导致家禽死亡[15]。引起家禽痛风的原因比较复杂,诊断确定病因采取相应措施是有效控制家禽痛风的关键。近年来,临床陆续检出CAstV和ANV感染,且研究表明这2种病毒的感染可引起家禽尿酸盐沉积[4,10,16-17],引起我国学者的关注。对我国不同省份鸡群样品进行CAstV感染的血清学检测结果表明,CAstV感染在我国鸡群非常普遍;病原学检测结果表明我国鸡群中CAstV和ANV广泛存在,且二者常常共同感染[11,18]。
传统的病毒检测方法包括病毒分离及电镜观察、琼脂凝胶扩散、血凝抑制和酶联免疫吸附试验等血清学检测方法,这些方法存在费时费力、试验周期长或需要相应的抗体等不足,故分子生物学检测方法在病原的检测,尤其是病毒检测方面得到了广泛地应用[19]。故本试验针对引起鸡尿酸盐沉积的3种病毒建立多重PCR检测方法。
IBV基因编码4种结构蛋白,分别为纤突糖蛋白(Spike protein,S)、核衣壳蛋白(Nucleocapsid protein,N)、膜蛋白(Membrane protein,M)和小囊膜蛋白(Envelope protein,E),IBV的N蛋白是位于膜内部的结构蛋白,是IBV诱导免疫应答的主要结构蛋白,具有高度保守性[20]。CAstV和ANV均属于禽星状病毒属[21],包括两端的非编码区、Poly(A)尾和ORF-1a、ORF-1b、ORF-2三个开放阅读框,其中ORF-1a和ORF-1b编码非结构蛋白,ORF-2编码衣壳蛋白,ORF-1b是整个基因组中非常保守的基因,常作为靶基因来检测病毒[22-23]。本试验分别以IBV的N基因、CAstV和ANV的ORF-1b基因设计引物,经反转录后扩增相应的基因,其条带分别为1 600 bp、350 bp和794 bp,扩增条带大小可明显区分3种病毒;且建立的多重PCR方法仅能检测相应的IBV、CAstV和ANV,其他常见病毒如FAdV-4、EDSV、MDV和LV-J经检测均无条带,表明该多重PCR方法具有良好的特异性。建立的多重PCR方法经条件优化,3种病毒的最低检测限分别为CAstV 1.33×105copies/μL、ANV 2.10×103copies/μL、IBV 1.96×103copies/μL,具有较高的敏感性。用建立的多重PCR方法对临床鸡尿酸盐沉积病例进行检测,其检测结果与单项PCR检测结果一致,具有较好的稳定性。
本试验针对临床引起鸡尿酸盐沉积的IBV、CAstV和ANV,建立检测这3种病毒的多重PCR方法,能同时检测并区分这3种病毒,特异性强、敏感性高、稳定性好,可为临床这3种病毒的检测、鸡尿酸盐沉积的诊断及流行病学调查等提供有力的技术支持。
