3,4-二羟基苯乙酮调控JNK/Nrf2信号通路减轻ox-LDL诱导的内皮细胞损伤的作用研究*
2022-05-31曹黛虹王韵涵张代娟刘江月
曹黛虹, 王韵涵, 张代娟, 刘江月
(潍坊医学院病理生理教研室,山东 潍坊 261053)
动脉粥样硬化(atherosclerosis,AS)是一种由多种危险因素引起的发病机制复杂的慢性血管疾病,是心脑血管疾病死亡的主要原因[1]。目前认为,血管内皮损伤是AS 主要发病机制之一。研究表明,内皮细胞损伤是AS 发生的始动环节,氧化型低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)可刺激内皮细胞,导致氧化应激和炎症反应,是致内皮细胞损伤的关键因子[2]。因此,减轻或抑制ox-LDL 诱导的内皮细胞损伤对AS的防治具有重大意义。
核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant responsive element,ARE)信号通路被认为是重要的内源性抗氧化应激通路,在机体抗AS 形成的过程中发挥重要作用。c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)家族的一员,可被多种应激信号激活,识别抗氧化调控因子Nrf2 并激活Nrf2/ARE 信号通路[3]。研究表明,Nrf2 受到上游调节激酶,如Akt 或MAPKs 的调节,小檗碱可激活Akt和MAPKs信号,诱导Nrf2介导的抗氧化酶NAD(P)H醌 脱 氢 酶1[NAD(P)H quinone dehydrogenase 1,NQO1]的表达[4];黄连碱激活Akt 和JNK/Nrf2/NQO1通路减轻AAPH 诱导的氧化应激[5]。3,4-二羟基苯乙酮(3,4-dihydroxyacetophnone,3,4-DHAP)是从秃毛冬青叶中提取的有效单体成分,具有抗炎、抗氧化、扩张冠脉等多种药理活性[6-8]。前期研究结果显示,3,4-DHAP 能够抑制NF-κB 核转位减轻脂多糖诱导巨噬细胞炎症反应,抑制ApoE-/-小鼠AS 斑块的形成。本研究拟进一步观察3,4-DHAP 对ox-LDL 诱导的EA.hy926 细胞损伤的影响,并从JNK/Nrf2 信号通路角度探讨其可能的作用机制。
材料和方法
1 材料与仪器
1.1 细胞株 源自ATCC 的人脐静脉内皮细胞株EA.hy926购于上海拜力生物科技有限公司。
1.2 药物与试剂 3,4-DHAP(纯度99.9%;TCI);一氧化氮(nitric oxide,NO)和内皮素1(endothelin-1,ET-1)试剂盒,以及活性氧(reactive oxygen species,ROS)和超氧化物歧化酶(superoxide dismuctase,SOD)试剂盒(南京建成生物工程研究所);MTT试剂盒、TUNEL 检测试剂盒、Western blot 相关试剂及RT-qPCR 试剂盒(碧云天生物技术研究所);Nrf2、JNK、p-JNK 和血红素加氧酶1(hemo oxygenase-1,HO-1)抗体(武汉博士德生物工程有限公司)。
1.3 主要仪器 DYCN-25D 型电泳仪(北京市六一仪器厂);激光共聚焦显微镜(Olympus);752 型紫外分光光度计(上海精密仪器有限公司);T100 型梯度PCR仪、转膜仪和凝胶成像分析仪(Bio-Rad)
2 方法
2.1 实验分组及干预方法 根据文献[4-6]确定ox-LDL 及3,4-DHAP 的剂量并建立ox-LDL 诱导的EA.hy926 细胞氧化应激模型。将生长良好的EA.hy926细胞随机分为空白对照(control,CON)组、3,4-DHAP(0.1 mmol/L)对照(3,4-DHAP control,3,4-DHAP-C)组、ox-LDL(100 mg/L)组、ox-LDL+低剂量(0.01 mmol/L)3,4-DHAP(low-dose 3,4-DHAP,3,4-DHAP-L)组和ox-LDL+高剂量(0.1 mmol/L)3,4-DHAP(high-dose 3,4-DHAP,3,4-DHAP-H)组。3,4-DHAP-C 组、ox-LDL+3,4-DHAP-L 组和ox-LDL+3,4-DHAP-H 组分别加入不同浓度3,4-DHAP 孵育24 h后,弃培养液;ox-LDL 组、ox-LDL+3,4-DHAP-L 组和ox-LDL+3,4-DHAP-H 组再加入终浓度100 mg/L 的ox-LDL培养24 h,进行后续实验。
2.2 ROS 生成检测 处理后的细胞加入无血清培养基稀释的DCFH-DA(1∶1 000),37 ℃孵育30 min。488 nm激光激发,激光共聚焦显微镜观察。
2.3 SOD、NO 和ET-1 水平的检测 收集培养液上清,采用黄嘌呤氧化酶法测定SOD 活力,硝酸还原酶法测定NO 浓度,ELISA 法测定ET-1水平。操作步骤严格按照试剂盒说明书进行。
2.4 CCK-8 法检测细胞活力 加入CCK-8 反应液,继续培养4 h 后,用酶标仪450 nm 测定吸光度(A)。细胞活力(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
2.5 TUNEL法检测细胞凋亡情况 4%多聚甲醛固定细胞30 min,按照TUNEL检测试剂盒说明书操作,染色结束后将细胞置于倒置荧光显微镜下观察拍照计数。细胞凋亡率(%)=(凋亡的细胞数/细胞总数)×100%。
2.6 RT-qPCR 检测Nrf2 和HO-1 mRNA 表达 收集细胞提取总RNA,按试剂盒操作说明合成cDNA,以GAPDH 为内参照,进行PCR 扩增,设计的引物序列见表1。
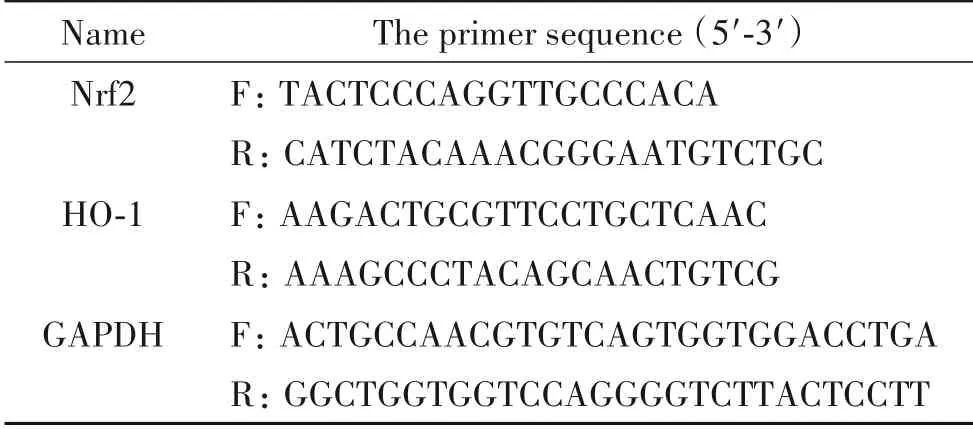
表1 RT-qPCR引物序列Table 1. The sequences of the primers for RT-qPCR
2.7 Western blot 检测JNK、p-JNK、Nrf2 和HO-1 蛋白水平 收集细胞分别提取总蛋白及核蛋白,SDSPAGE 分离蛋白后转膜,5%脱脂奶粉封闭1 h后加Ⅰ抗(1∶500),4 ℃孵育过夜,TBST 振荡洗涤3 次后,Ⅱ抗37 ℃孵育1 h,TBST 振荡洗涤4 次后,ECL 发光显色,凝胶成像系统扫描分析。
3 统计学处理
采用SPSS 18.0软件分析。计量资料以均数±标准差(mean±SD)表示。多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
结果
1 3,4-DHAP 对ox-LDL 诱 导 的EA. hy926 细 胞ROS生成及SOD活性的影响
与CON 组比较,3,4-DHAP-C 组ROS 无显著变化(P>0.05),SOD 活性略有升高,但差异无统计学意义(P>0.05),ox-LDL 组、ox-LDL+3,4-DHAP-H 组和ox-LDL+3,4-DHAP-L 组ROS 生成均显著增加,而SOD 活性均显著下降(P<0.05);与ox-LDL 组比较,ox-LDL+3,4-DHAP-H 组 和ox-LDL+3,4-DHAP-L 组ROS 生成均显著降低,而SOD 活性显著升高;与ox-LDL+3,4-DHAP-L 组比较,ox-LDL+3,4-DHAP-H 组ROS生成显著降低,而SOD活性显著升高(P<0.05),见图1。
2 3,4-DHAP 对ox-LDL 诱 导 的EA. hy926 细 胞NO和ET-1的影响
与CON 组比较,3,4-DHAP-C 组NO 和ET-1 水平均无显著变化(P>0.05),ox-LDL 组、ox-LDL+3,4-DHAP-H 组和ox-LDL+3,4-DHAP-L 组NO 生成均显著减少,而ET-1 生成显著增加(P<0.05);与ox-LDL组比较,ox-LDL+3,4-DHAP-H 和ox-LDL+3,4-DHAPL 组NO 生成均显著增加,而ET-1 生成显著减少(P<0.05);与ox-LDL+3,4-DHAP-L 组比较,ox-LDL+3,4-DHAP-H 组NO 生成显著增加,而ET-1生成显著减少(P<0.05),见图2。
3 3,4-DHAP 对ox-LDL 诱导的EA. hy926 细胞活力和凋亡的影响
与CON组比较,3,4-DHAP-C组细胞活力和凋亡情况均无显著变化(P>0.05),ox-LDL 组、ox-LDL+3,4-DHAP-H 组和ox-LDL+3,4-DHAP-L 组细胞活力均显著降低(P<0.05),凋亡率显著升高(P<0.05);与ox-LDL 组比较,ox-LDL+3,4-DHAP-H 组和ox-LDL+3,4-DHAP-L组细胞活力均显著增强(P<0.05),凋亡率显著降低(P<0.05);与ox-LDL+3,4-DHAP-L 组比较,ox-LDL+3,4-DHAP-H 组细胞活力显著增强(P<0.05),凋亡率显著降低(P<0.05),见图3。
4 3,4-DHAP 对ox-LDL 诱 导 的EA. hy926 细 胞Nrf2和HO-1 mRNA表达的影响
与CON 组比较,3,4-DHAP-C 组Nrf2 和HO-1 的mRNA 表达略有升高,但差异均无统计学意义(P>0.05),ox-LDL 组、ox-LDL+3,4-DHAP-H 组 和ox-LDL+3,4-DHAP-L 组Nrf2 和HO-1 的mRNA 表达均显著减少(P<0.05);与ox-LDL 组比较,ox-LDL+3,4-DHAP-H 和ox-LDL+3,4-DHAP-L 组Nrf2 和HO-1 的mRNA 表达均显著增高(P<0.05);与ox-LDL+3,4-DHAP-L组比较,ox-LDL+3,4-DHAP-H 组Nrf2和HO-1的mRNA表达均显著增高(P<0.05),见图4。
5 3,4-DHAP 对ox-LDL 诱 导 的EA. hy926 细 胞JNK、p-JNK、HO-1和Nrf2蛋白水平的影响
与CON 组比较,3,4-DHAP-C 组Nrf2 和HO-1 蛋白表达及p-JNK/JNK 比值略有升高,但差异均无统计学意义,且Nrf2 核蛋白无显著变化(P>0.05),ox-LDL 组、ox-LDL+3,4-DHAP-H 组 和ox-LDL+3,4-DHAP-L 组Nrf2 和HO-1 蛋白表达、p-JNK/JNK 比值及Nrf2 核蛋白表达均显著降低(P<0.05);与ox-LDL组比较,ox-LDL+3,4-DHAP-H 和ox-LDL+3,4-DHAPL 组Nrf2 和HO-1 蛋白表达、p-JNK/JNK 比值及Nrf2核蛋白表达均显著增高(P<0.05);与ox-LDL+3,4-DHAP-L组比较,ox-LDL+3,4-DHAP-H 组Nrf2和HO-1 蛋白表达、p-JNK/JNK 比值及Nrf2 核蛋白表达均显著增高(P<0.05),见图5。
讨论
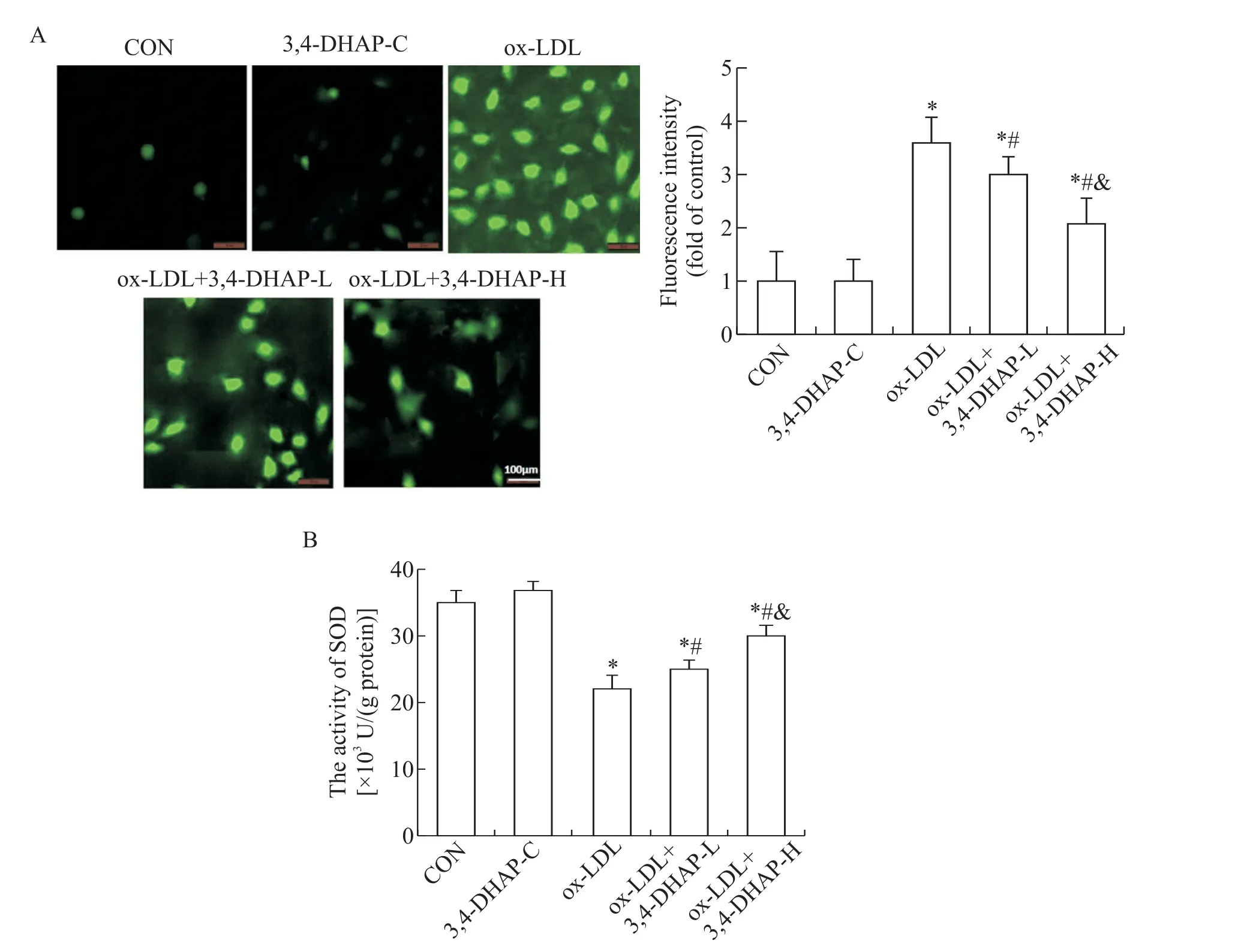
Figure 1. The effect of 3,4-DHAP on ROS generation(A)and SOD activity(B)in ox-LDL-treated EA. hy926 cells(scale bar=100 μm). The results showed that the generation of ROS was significantly decreased and the activity of SOD was significantly increased in ox-LDL+3,4-DHAP-H group. Mean±SD. n=6.*P<0.05 vs CON group;#P<0.05 vs ox-LDL group;&P<0.05 vs ox-LDL+3,4-DHAP-L group.图1 3,4-DHAP对ox-LDL诱导的EA.hy926细胞ROS生成及SOD活性的影响
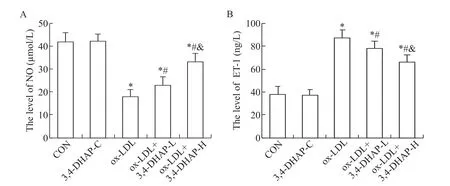
Figure 2. The effect of 3,4-DHAP on NO(A)and ET-1(B)production in ox-LDL-treated EA. hy926 cells. Mean±SD. n=6.*P<0.05 vs CON group;#P<0.05 vs ox-LDL group;&P<0.05 vs ox-LDL+3,4-DHAP-L group.图2 3,4-DHAP对ox-LDL处理的EA.hy926细胞NO和ET-1生成的影响
氧化应激致内皮细胞损伤是AS 的主要发病机制之一[9]。ox-LDL 与血凝素样ox-LDL 受体1 结合,促进ROS 大量生成,启动内皮细胞损伤和功能障碍的过程[10],参与AS 的发生。ox-LDL 诱导的内皮细胞损伤是AS 发生的始动因素之一。因此,减轻或阻断ox-LDL 诱导的内皮细胞损伤将是预防和治疗AS 的有效途径之一。本研究结果进一步证实了ox-LDL可通过诱导氧化应激引起内皮细胞损伤。近年来学者们对3,4-DHAP 在心血管疾病中的应用进行了大量的研究,3,4-DHAP 可能通过AMP 活化蛋白激酶途径改善AS 时的病理性脂质代谢,预防和延缓AS的发生[11-12]。3,4-DHAP 还通过上调内皮型NO 合成酶-NO 信号通路,减轻氧化应激和炎症反应,纠正血管内皮功能失调[7,13]。这些研究提示,3,4-DHAP 是一种耐受性良好的天然化合物,具有良好的药理作用,可通过多靶点预防AS 的发生发展,为开发抗AS候选药物提供了实验依据。笔者一直致力于3,4-DHAP 抗AS 的研究[14-15],本次以ox-LDL 诱导的EA.hy926 细胞为对象,观察到3,4-DHAP 可通过抑制ROS 的生成,使细胞活力增强,凋亡明显减少,增加了NO 的合成,降低了ET-1 的产生,从而减轻ox-LDL诱导的内皮细胞损伤,证实了3,4-DHAP的抗氧化应激作用,并对抗氧化应激机制进行初步探索。
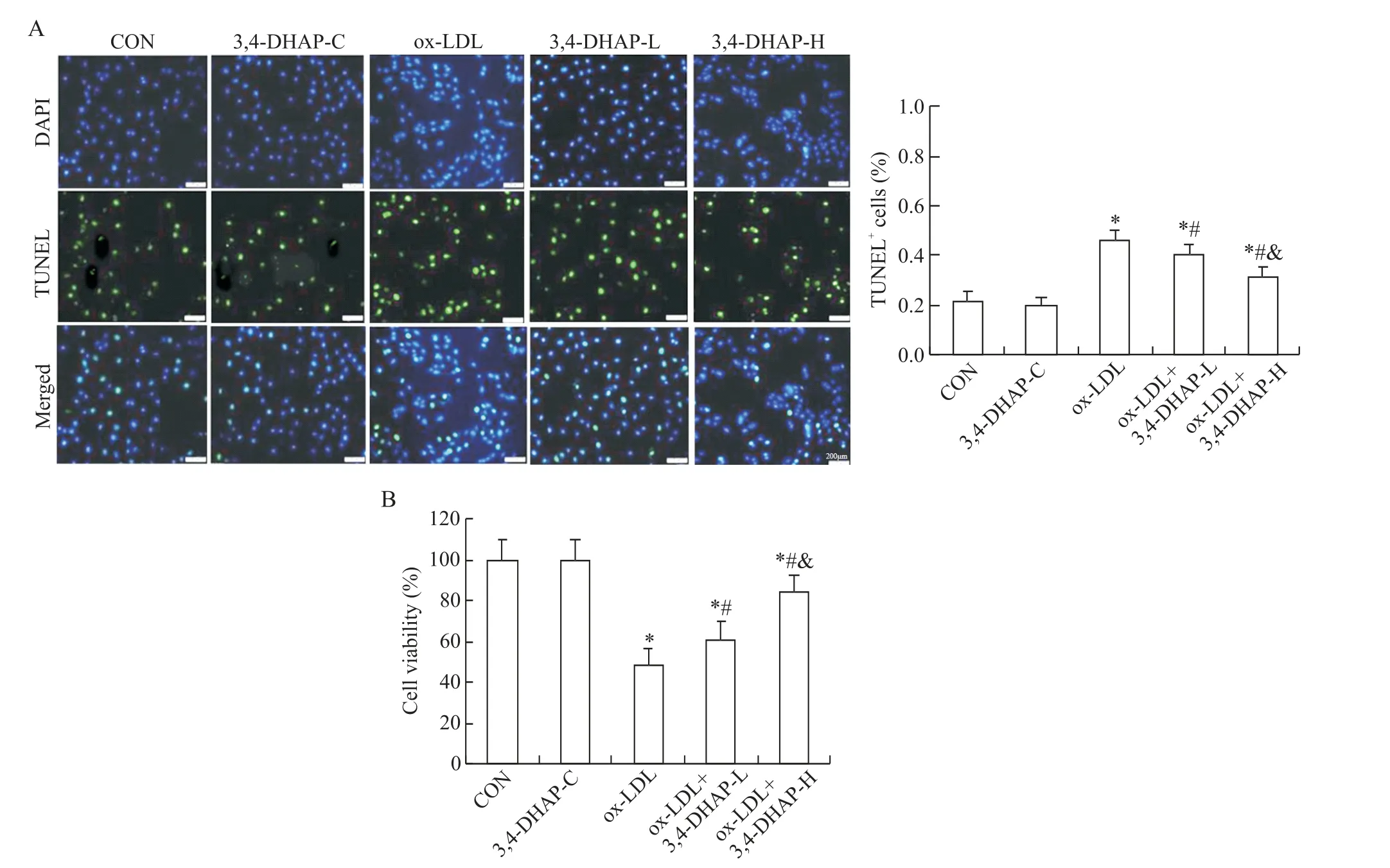
Figure 3. The effect of 3,4-DHAP on the apoptosis(A)and viability(B)of EA. hy926 cells induced by ox-LDL(scale bar=200 μm). Mean±SD. n=6.*P<0.05 vs CON group;#P<0.05 vs ox-LDL group;&P<0.05 vs ox-LDL+3,4-DHAP-L group.图3 3,4-DHAP对ox-LDL诱导EA.hy926细胞凋亡和活力的影响

Figure 4. The effect of 3,4-DHAP on Nrf2(A)and HO-1(B)mRNA expression in EA.hy926 cells induced by ox-LDL. Mean±SD.n=6.*P<0.05 vs CON group;#P<0.05 vs ox-LDL group;&P<0.05 vs ox-LDL+3,4-DHAP-L group.图4 3,4-DHAP对ox-LDL处理的EA.hy926细胞中Nrf2和HO-1 mRNA表达的影响
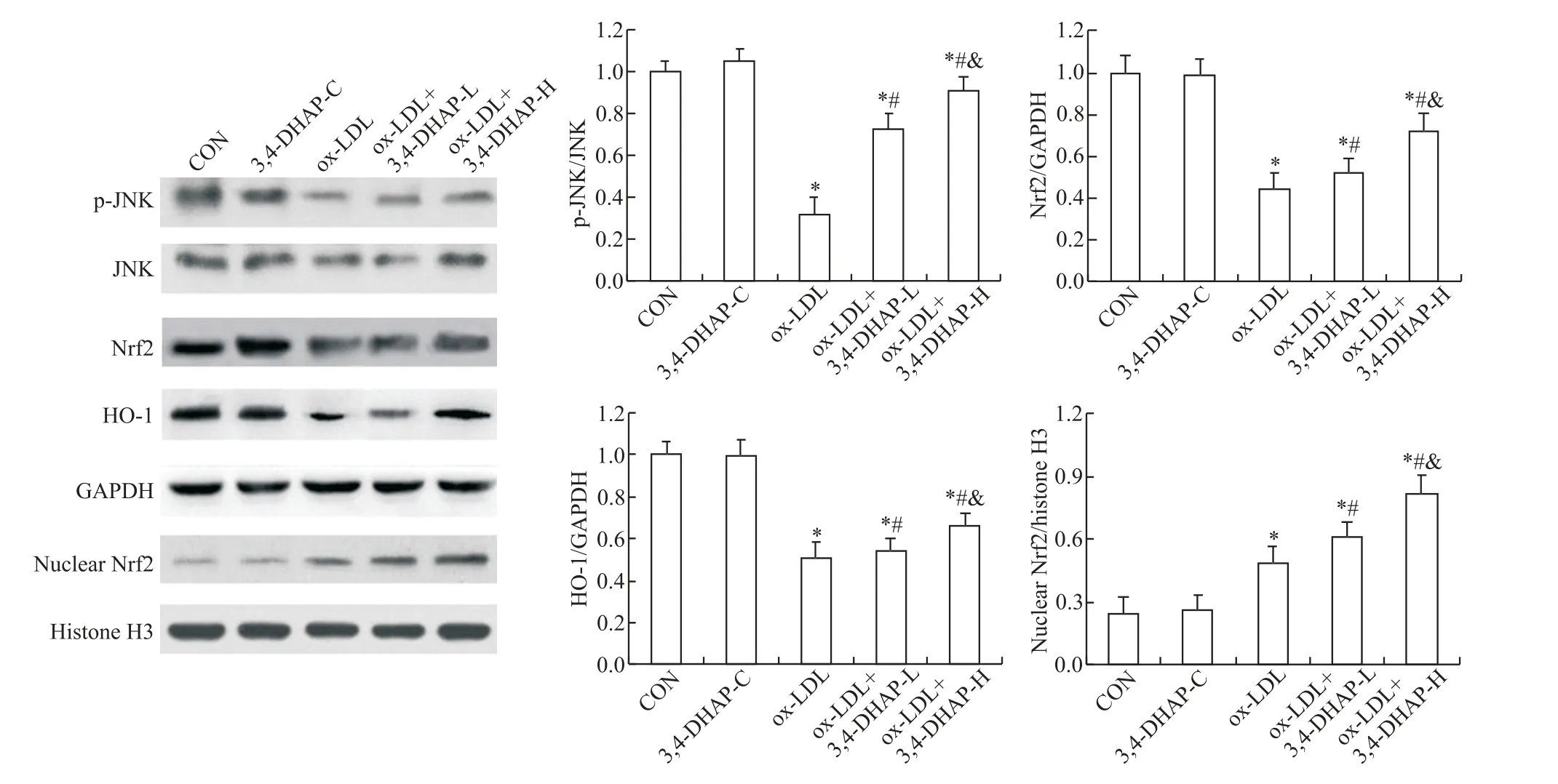
Figure 5. The effect of 3,4-DHAP on the protein levels of JNK,p-JNK,Nrf2,HO-1 and nuclear Nrf2 in EA.hy926 cells induced by ox-LDL. Mean±SD. n=6.*P<0.05 vs CON group;#P<0.05 vs ox-LDL group;&P<0.05 vs ox-LDL+3,4-DHAP-L group.图5 3,4-DHAP对ox-LDL诱导EA.hy926细胞JNK、p-JNK、Nrf2、HO-1及核内Nrf2蛋白水平的影响
在AS 发生发展的过程中,ROS 过量生成,抗氧化酶SOD、γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)等表达不足,氧化/抗氧化系统失调,从而引起氧化应激反应,造成内皮细胞损伤[16]。ROS 导致血管内皮细胞损伤是2 型糖尿病(type 2 diabetes mellitus,T2DM)大血管并发症发生的始动环节[17]。Nrf2 信号通路,是目前认为最重要的内源性抗氧化途径,是自我保护的重要转录因子。研究表明,激活Nrf2 可减轻T2DM 时Nrf2 失调致氧化应激介导的血管内皮损伤[17]。JNK是MAPKs家族的一员,Runchel 等[18]认为JNK 在保护细胞方面有两面性:短暂的低水平的ROS 不能持续激活JNK,此时激活的JNK 可促进Nrf2 磷酸化和核转移[19],激活Nrf2/ARE 信号通路[20],发挥抗炎、抗氧化及抗细胞凋亡等作用,表现出保护细胞的作用;而持续的高水平的活性氧持续激活JNK,此时激活的JNK 促进细胞凋亡。Rosaria 等[21]研究显示,原儿茶酸通过激活JNK/Nrf2 信号通路抑制ox-LDL 诱导的巨噬细胞凋亡。Feng 等[22]研究显示,柚皮苷通过激活JNK/Nrf2信号通路促进HO-1 表达,从而减轻高糖诱导的内皮细胞损伤。本研究也观察到,3,4-DHAP 可上调EA.hy926 细胞p-JNK/JNK 比值,促进Nrf2 核内移,上调HO-1 mRNA 及蛋白的表达,增强SOD 活性,抑制ROS生成,表明3,4-DHAP可能通过激活JNK/Nrf2信号通路,抑制氧化应激反应。
综上所述,3,4-DHAP 能够有效减轻ox-LDL 诱导的EA. hy926 细胞损伤,其机制可能与激活JNK/Nrf2 信号通路,抑制氧化应激反应有关。该研究结果为3,4-DHAP抗AS的开发应用提供可靠的实验依据。但ox-LDL 诱导的氧化应激与内皮细胞损伤的关系,以及其他通路在3,4-DHAP保护内皮细胞中的作用尚不明确,有待于今后的进一步研究。
