山羊乳腺上皮细胞氧化损伤模型的建立
2022-05-31张元锌王闫宇云艳虹陈俊朴石惠宇王学梅
张元锌,王闫宇,云艳虹,陈俊朴,石惠宇,王学梅
(海南大学动物科技学院,海口 570228)
母山羊产前15 d到产后15 d这段特殊时期为围产期,在围产期由于机体经历了剧烈的生理变化,能量需求较大,但在围产前期瘤胃易受到胎儿压迫,使得采食获得的营养成分减少,因此机体多处于能量负平衡状态[1]。在负平衡状态下,体内会出现营养物质代谢不足、皮质甾类激素大量释放的现象[2],此时机体需大量利用体脂进行供能[3],产生的非酯化脂肪酸会进入乳腺组织,调节产生大量活性氧(reactive oxygen species,ROS),造成乳腺出现氧化损伤甚至免疫抑制[4],从而引发乳腺炎[5]。同时乳腺细胞作为乳脂和乳蛋白合成分泌的重要场所,对维持其内部的氧化-抗氧化稳态具有重要的意义。因此,平稳的度过围产期减少氧化应激的发生,有利于减少乳腺受到的损伤,提高母羊哺乳能力以及下个泌乳周期的生产性能和繁殖性能[6]。过氧化氢(H2O2)凭借其强氧化性且极易透过细胞膜诱发一系列反应攻击细胞[7],被广泛应用于诱导氧化损伤[8]。以H2O2为诱导剂建立细胞体外氧化损伤模型的研究已有很多,但是鲜见关于建立山羊乳腺上皮细胞(GMEC)氧化损伤模型的研究。因此,通过GMEC建立体外的山羊氧化应激模型,有利于了解其氧化应激的发生机制并寻找应对的措施。
目前,国内外学者普遍选择在饲料中添加某些抗氧化剂来维持山羊机体氧化稳态,如丁酸钠、亚硒酸钠、烟酰胺、花青素等。Chang等[9]研究发现,高精料饲粮中补充丁酸钠能够缓解高精料饲粮造成的奶山羊乳腺氧化应激,减少乳腺细胞的凋亡。孙婧陶等[10]研究发现,0.5 μg/mL亚硒酸钠可以有效减少H2O2对延边奶山羊乳腺上皮细胞的损伤。尹清艳[11]和何家俊[12]对围产期奶山羊的研究均发现,饲料中添加烟酰胺有效降低了机体乳腺氧化产物的累积,提高了乳品质以及乳汁的抗氧化能力,改善了羔羊的免疫功能,从而提高羔羊存活率,其中花青素作为一种水溶性天然色素,因其安全性高、清除自由基能力强的特点[13],近年来被学者广泛研究。Xie等[14]研究表明,茄属植物花青素可通过抑制胱天蛋白酶3(Caspase-3)的表达,减弱阿散酸对鸡成纤维细胞的氧化应激。海南地区特有的含丰富花青素的紫大薯对缓解三硝基苯磺酸(TNBS)诱导的小鼠结肠炎效果良好[15]。然而紫大薯花青素能否保护围产期山羊的乳腺组织,以及减少氧化应激对乳腺细胞造成的损伤及其发挥作用的机制尚不清楚,亟需建立乳腺细胞氧化损伤的细胞模型进行深入的研究。因此,本试验以H2O2作为氧化损伤模型诱导剂,以GMEC为试验对象,依据细胞存活率、培养液及细胞中ROS含量、乳酸脱氢酶(lactate dehydrogenase,LDH)活性及抗氧化标志物的活性、含量的变化,探索最佳的H2O2处理浓度与时间,建立可靠的细胞氧化损伤模型,为今后在细胞层面探究紫大薯花青素对氧化损伤的保护机制提供模型条件,也为将来在饲料中添加海南紫大薯保护围产期山羊乳腺组织提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 GMEC购自北京北纳创联生物技术研究院。
1.1.2 主要试剂 胎牛血清(FBS)购自HyClone公司;0.25%胰蛋白酶、DMEM/F12培养基、青霉素-链霉素混合溶液(100×双抗)均购自Gibco公司;CCK-8购自Biosharp公司;表皮生长因子(EGF)购自Sigma公司;H2O2购自国药集团化学试剂有限公司;过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒均购自南京建成生物科技有限公司;动物细胞裂解液购自TIANDZ公司;蛋白酶抑制剂(PMSF)、PBS、ROS、LDH试剂盒均购自上海碧云天生物技术有限公司。
完全培养基:DMEM/F12+6% FBS+1%双抗+0.1% EGF。
终止培养基:DMEM/F12+10% FBS。
H2O2工作液:取10 μL H2O2原始液(10 mol/L)加入990 μL超纯水配制成100 mmol/L H2O2母液,分别取35、43、46、49、52、55 μL H2O2母液用超纯水配制成100 μL的H2O2储备液;取各H2O2储备液100 μL添加9 900 μL DMEM/F12培养基稀释至350、430、460、490、520、550 μmol/L备用。
1.2 方法
1.2.1 H2O2处理浓度和时间的筛选 取培养24 h后处于对数生长期的GMEC,按每孔3.8×103个细胞接种于96孔板中,置于37 ℃、5% CO2培养箱中培养24 h。取出后设28个处理组,每个处理组设6个重复。采用7×4二因子完全随机试验设计,即第一因素为H2O2浓度:0(对照组)、350、430、460、490、520和550 μmol/L,第二因素为H2O2处理时间:8、11、14、17 h。每孔添加工作液100 μL后置于37 ℃、5% CO2培养箱内进行培养,培养至各时间点吸出培养液,用PBS清洗3遍。之后向每孔中加入10 μL CCK-8试剂及100 μL不含FBS的DMEM/F12培养基,放回培养箱孵育2 h显色。用酶标仪测定D450 nm值,并按照以下公式进行计算,根据存活率筛选H2O2处理浓度和时间。
GMEC相对存活率(%)=测定组D450 nm/对照组D450 nm×100%
1.2.2 H2O2处理对LDH活性的影响 筛选出细胞存活率在70%左右时H2O2处理浓度与时间后,取培养24 h后处于对数生长期的细胞按每孔1.3×105个细胞接种于6孔板中,置于培养箱中培养24 h。 取出后设24个处理组,每个处理组设3个重复。 设H2O2浓度为0、350、430、460、490、520 μmol/L,设作用时间为4、6、8、10 h。每孔添加工作液3 mL后置于37 ℃、5% CO2培养箱内进行培养,培养至各时间点后吸出上清液,按照试剂盒说明书测定上清液中LDH活性。
1.2.3 H2O2处理对ROS含量的影响 1.2.2中取上清后的细胞经PBS清洗3次后,按照说明书测定细胞内ROS含量,通过荧光酶标仪在488 nm激发波长,525 nm发射波长下进行测定,结果以相对荧光强度表示。
1.2.4 H2O2处理对细胞抗氧化标志物的影响 1.2.2中取上清后的细胞用PBS清洗3次后,每孔加入500 μL细胞裂解液与5 μL蛋白酶抑制剂,冰浴状态下裂解30 min后用细胞刮刀刮净孔底,将裂解液收集至1.5 mL离心管中做好标记,1 000 r/min离心5 min,取上清备用。 按照试剂盒说明书分别检测细胞中MDA含量、GSH-Px活性及上清液中SOD、CAT活性和T-AOC。
通过抗氧化标志物的水平进一步确定H2O2最适处理浓度与处理时间。
1.3 数据统计分析
用SPSS 24.0统计软件进行单因素方差分析(One-Way ANOVA),采用Duncan氏法进行组间多重比较,主体间效应方式采用单变量线性分析。结果以平均值±标准误表示,P<0.05表示差异显著。
2 结 果
2.1 H2O2处理对细胞存活率的影响
由表1可知,当处理时间为8、11、14、17 h时,GEMC存活率随H2O2浓度的升高呈下降趋势。 H2O2处理8 h时,350、430、460 μmol/L 3个浓度下的细胞存活率分别为64.6%、72.9%、66.2%,较对照组显著降低(P<0.05),H2O2浓度>460 μmol/L 的处理组细胞存活率已降至60%以下。当处理时间超过8 h后,各浓度处理下的细胞存活率均低于60%,与本试验70%的预期存活率有明显差距。因此,后续试验所用H2O2浓度设为350、430、460、490、520 μmol/L,处理时间设为4、6、8、10 h。
2.2 H2O2处理对LDH活性的影响
由表2可知,培养液中LDH活性随H2O2处理时间的延长呈持续增加的趋势,在4 h时除430 μmol/L处理组外,各浓度处理下LDH活性均显著高于对照组(P<0.05);与对照组相比,6~10 h各处理组LDH活性均显著升高(P<0.05),且H2O2浓度越大处理时间越长,变化就越明显,其中430 μmol/L处理组在8 h时的LDH活性较4 h有显著提高(P<0.05),>430 μmol/L浓度的处理组在6 h时LDH活性即显著高于4 h时的LDH活性(P<0.05)。
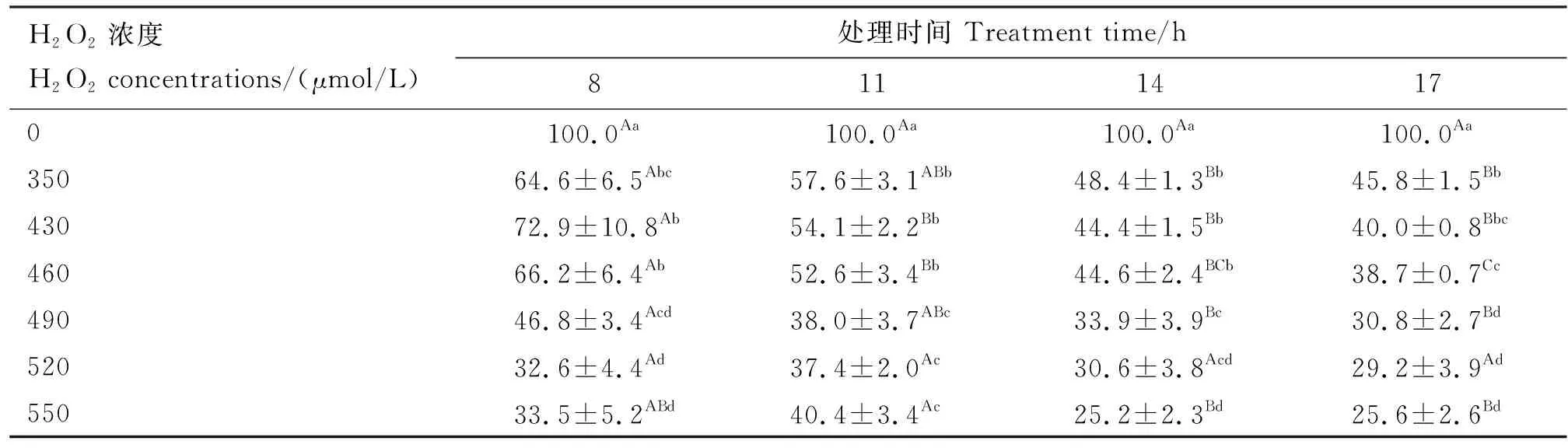
表1 各组GMEC存活率
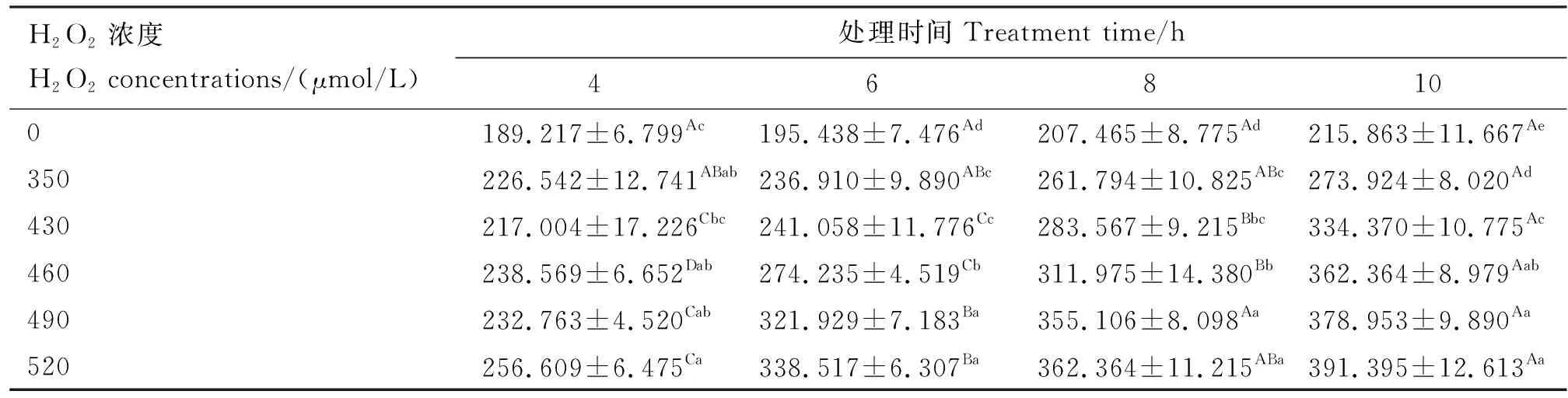
表2 各组LDH活性
2.3 H2O2处理对ROS含量的影响
由表3可知,细胞内ROS含量随H2O2处理时间的增加趋势,4 h时各处理浓度ROS含量无明显变化;6 h时,各处理浓度下GMEC内ROS的含量较对照组显著升高(P<0.05);8 h时各处理浓度下GMEC内ROS的含量较对照组均有显著升高(P<0.05),同时各浓度处理组ROS含量较6 h均显著升高(P<0.05),说明8 h为ROS含量变化的转折时间点,此时430 μmol/L处理组ROS相对含量达到168.3%,且在8 h时各处理组ROS含量趋于稳定。
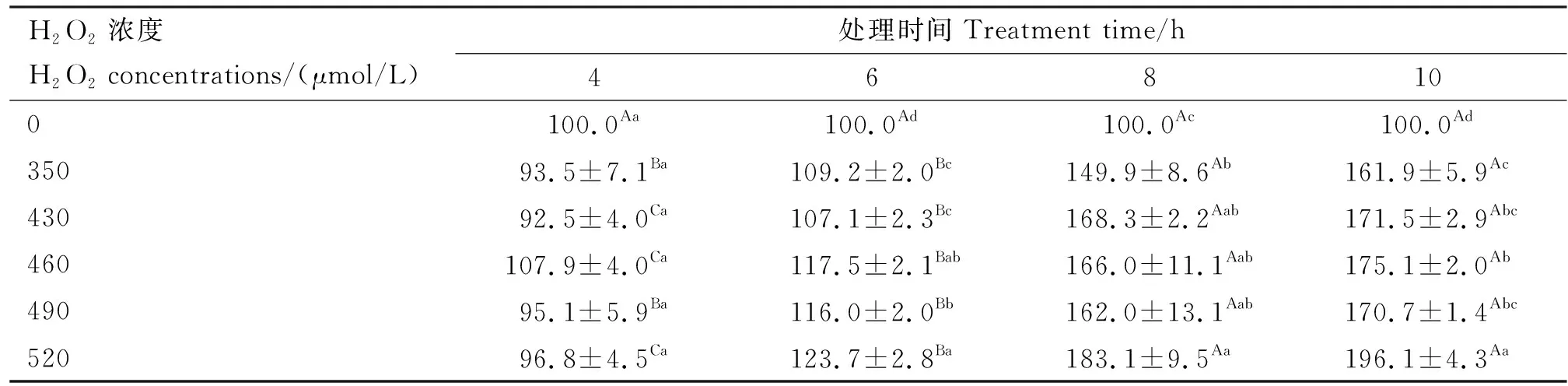
表3 各组ROS含量
2.4 H2O2处理对抗氧化标志物活性的影响
由表4和5可知,CAT活性和T-AOC随H2O2处理时间的延长呈先升后降再上升的整体趋势。在6 h时,与4 h相比除430μmol/L处理组CAT活性显著降低外(P<0.05),各处理组CAT活性和T-AOC均出现了升高的现象,且490、520 μmol/L处理组T-AOC较对照组有显著的升高(P<0.05)。8 h时各处理组CAT活性和T-AOC较6 h明显下降,且430、520 μmol/L处理组的CAT活性和T-AOC较6 h均显著降低(P<0.05),说明处理8 h为CAT活性和T-AOC变化的转折时间点,此时350、430 μmol/L处理组CAT活性和T-AOC较对照组均显著降低(P<0.05)。然而在10 h时除460、490、520 μmol/L处理组CAT活性比8 h降低外,其余各处理组CAT活性和T-AOC较8 h明显上升。
由表6和7可知,SOD和GSH-Px活性随H2O2处理时间的延长呈下降的趋势。4 h时460 μmol/L处理组SOD和GSH-Px活性较对照组均显著降低(P<0.05);6 h时除350、460 μmol/L处理组SOD活性变化不明显外,各处理组SOD和GSH-Px活性较对照组均显著降低(P<0.05)。在8 h时除350 μmol/L处理SOD活性变化不明显外,各处理组SOD和GSH-Px活性较对照组均显著降低(P<0.05),此时430 μmol/L处理组SOD活性较4 h显著降低(P<0.05),GSH-Px活性较6 h显著降低(P<0.05)。 10 h时各处理组SOD和GSH-Px活性较对照组均显著降低(P<0.05)。

表4 各组CAT活性
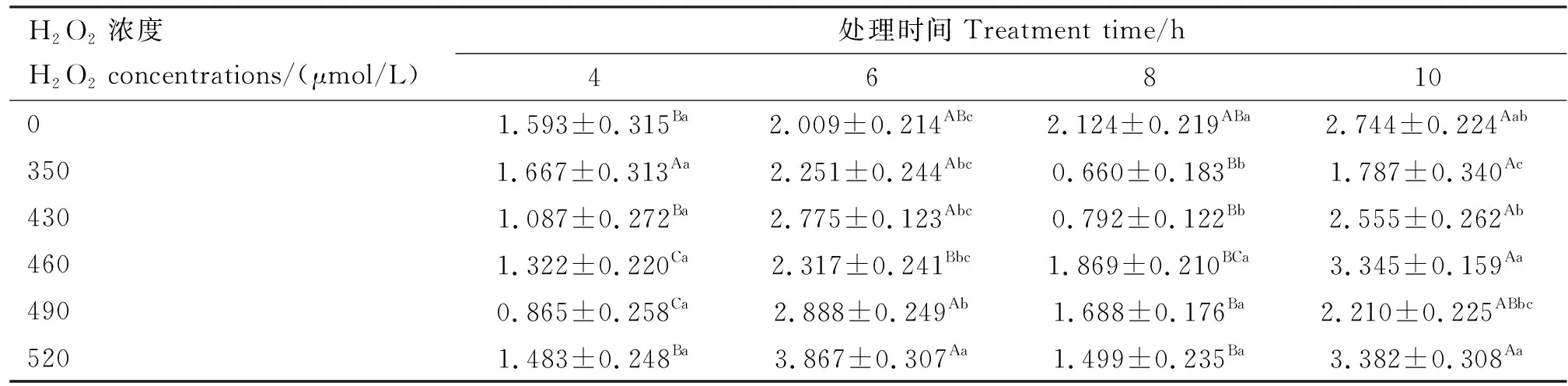
表5 各组T-AOC活性

表6 各组SOD活性

表7 各组GSH-Px含量
由表8可知,MDA含量随H2O2处理时间的延长呈先降后升的整体趋势。6 h时除350 μmol/L处理组外,MDA含量较4 h时均出现明显降低。 8 h时430 μmol/L处理组较6 h明显上升,且430、490、520 μmol/L处理组MDA含量较对照组显著提高(P<0.05)。10 h时各处理组MDA含量均较对照组显著提高(P<0.05),此时350 μmol/L处理组较8 h显著提高(P<0.05),430 μmol/L处理组较6 h显著提高(P<0.05)。
由表9可知,T-AOC主要受处理时间影响(P<0.05);MDA含量主要受处理浓度影响(P<0.05);CAT活性既受处理时间又受处理浓度影响(P<0.05);细胞存活率、SOD、GSH-Px、LDH活性和ROS含量既受处理时间又受处理浓度影响(P<0.05),同时还受到两种因素的交互影响(P<0.05)。

表8 各组MDA含量

表9 处理时间和浓度的主体效应和相互效应对各指标的影响

续表
3 讨 论
在构建氧化应激模型时,细胞存活率通常在70%左右,降低至50%时会出现不可逆的严重损伤[16];高于70%则说明细胞状态良好,氧化后没有产生较为明显的损伤;低于60%则说明细胞开始大量死亡并逐渐出现不可逆的氧化损伤,不利于试验的进一步进行[17-18]。本试验在构建损伤模型时,由于初始处理时间8 h的设定跨度过大,导致所有处理浓度下GMEC的存活率均低于70%,并且随着处理时间的延长损伤程度逐渐加重,不符合建立模型的要求。因此,在处理时间和浓度上做出了一些调整,重新设定损伤时间为4、6、8、10 h,并去除较大的550 μmol/L处理浓度,防止出现不可逆的严重损伤以便后续试验的进行。
由于培养液中添加不同浓度的H2O2导致外源ROS大量进入细胞,ROS作为氧自由基在体内发挥着重要的作用,既可以作为第二信使诱导并维持癌细胞的致癌表型,还可以诱导细胞衰老和凋亡[19]。正常代谢产生的ROS会被细胞内抗氧化蛋白所消耗[20],然而在氧化应激状态下,大量产生的ROS对细胞DNA、蛋白质等大分子物质造成损伤,从而影响细胞正常生理功能甚至引发凋亡[21]。在这种情况下,ROS可以直接或间接作为凋亡信号通过BH3(Bcl-2 homology domain 3-only)蛋白引起Bax(Bcl-2-asslciated protein X)蛋白移位至线粒体外膜并改变其通透性,使线粒体内的促凋亡因子释放到细胞质内引发凋亡[22]。LDH作为一种存在于细胞质中的酶,正常情况下不会分泌到胞外,只有在细胞膜受损或细胞凋亡的情况下才会释放到细胞外[23],因此培养液中LDH活性常被用来反映细胞凋亡情况[24]。本研究结果显示,GMEC内ROS含量在4 h时各处理组无明显变化,在6~8 h时变化幅度较4~6 h时更大,说明4~6 h时产生的ROS较少,可能是被某些抗氧化酶消耗掉一部分;而培养液中LDH含量从4 h开始显著升高,证明ROS含量一旦高于正常水平就可引发细胞凋亡。
抗氧化酶系统作为保护机体免受氧化损伤的屏障之一,主要由CAT、SOD和GSH-Px等多种抗氧化酶组成[25]。T-AOC可以反映机体内抗氧化物质对自由基的清除能力,以及各种抗氧化酶之间的协同程度,是评价机体抗氧化能力的重要指标[26]。MDA作为自由基在机体内发生脂质过氧化的终产物,不仅会影响抗氧化酶的活性,还会造成线粒体膜损伤[27],因此也可作为判断细胞损伤程度的条件之一。当氧化应激发生时,机体的抗氧化酶系统已存在较大的损伤或不足,因此人们常用黄酮类(如花青素)等一系列抗氧化活性物质来提高机体的抗氧化能力[28]。海南紫大薯块茎含有大量且种类丰富的花青素及膳食纤维等活性成分[29],使其在开发成为特色畜禽饲料方面具有巨大的潜力,Han等[30]研究发现紫大薯花青素可以显著提高小鼠肝脏中SOD和GSH-Px的mRNA表达量。因此本试验通过对过氧化产物及抗氧化能力2个方面进行评定,能够较完整地反映细胞的损伤程度,也为后续探究海南紫大薯花青素对氧化损伤的保护能力提供模型基础。
本研究结果显示,在不同浓度H2O2处理下,GMEC的CAT活性和T-AOC在4~6 h出现了升高的现象,与此同时MDA含量短暂降低,且ROS含量增长缓慢。这可能是由于在H2O2的刺激下,细胞内部有关抗氧化的基因或蛋白被激活,通过调控核转录因子2-抗氧化反应元件(Nrf2-ARE)抗氧化机制[31],增强CAT活性和T-AOC来应对受到的刺激使细胞内ROS含量保持相对稳定从而降低MDA含量,这与乔娜等[32]对小鼠精原细胞氧化损伤的研究中CAT、T-AOC和MDA的变化趋势是一致的。由于刺激时间逐渐加长,刺激程度保持稳定,导致细胞无法长期有效地应对氧化应激从而造成不可逆的损伤。因此CAT活性和T-AOC在6~8 h明显降低,与本研究中主效应分析结果显著受处理时间影响的结果相一致。与此同时,细胞外LDH活性仍显著升高,证明这些有限的保护机制无法阻止细胞凋亡。随着H2O2处理浓度的增加,ROS的产量也逐渐增加,SOD和GSH-Px作为清除ROS的重要抗氧化酶在活性降低时可造成ROS大量堆积,从而引起脂质过氧化,使MDA的含量增加。本试验结果表明,各H2O2浓度在不同时间的变化不明显,而相同时间下H2O2浓度越高MDA含量增加越显著,这与王吉等[33]在对猪肾细胞氧化损伤的研究中得出的MDA含量变化与单宁酸添加浓度呈正相关的结果一致,但其中具体的调控机制以及大分子物质的变化情况还需要进一步研究。
4 结 论
用430 μmol/L H2O2处理GMEC 8 h,细胞存活率降至72.9%,细胞内ROS和MDA含量均显著升高,GSH-Px活性显著降低,培养液中LDH活性显著升高,CAT和SOD活性显著降低,T-AOC活性明显降低。表明本研究利用H2O2成功建立GMEC氧化损伤模型,适宜浓度为430 μmol/L,作用时间为8 h。
