布鲁氏菌分泌蛋白BMCO基因缺失株的构建及生物学特性研究
2022-05-31邱润辉关飞虎王梓行朱德馨魏春燕霍明凯孙志华
邱润辉,关飞虎,王梓行,郭 嘉,朱德馨,张 伟,魏春燕,霍明凯,孙志华,2,3,张 辉,2,3
(1.石河子大学动物科技学院,石河子 832000;2.新疆生产建设兵团动物疾病防控重点实验室,石河子 832000;3.动物健康养殖国家国际联合研究中心,石河子 832000)
细菌分泌系统是一类将细菌合成的蛋白质转运到细胞外环境或宿主体内的系统,其本质是存在于细菌细胞膜上的蛋白质复合体。根据分泌系统特定的结构、组成和活性可将其分为9种不同的类型[1]。测序分析表明,布鲁氏菌没有Ⅰ、Ⅱ、Ⅲ型分泌系统,具有sec依赖和sec非依赖的蛋白和鞭毛特异性的Ⅲ型分泌系统,以及Ⅳ、Ⅴ、Ⅵ型分泌系统[2]。布鲁氏菌的分泌系统是布鲁氏菌重要的毒力因子,在固有免疫应答反应中,布鲁氏菌可以通过分泌蛋白干扰宿主细胞免疫信号通路、降低宿主细胞的免疫反应、抵御宿主细胞的杀菌功能、促进布鲁氏菌的胞内寄生[3-4]。
多铜氧化酶(MCO)又称为蓝色氧化酶,是一种含铜的糖蛋白,不易钝化,主要由酚类化合物和铜离子构成[5]。多铜氧化酶家族包括漆酶、亚铁氧化蛋白、亚铜氧化酶、金属氧化酶以及铜蓝蛋白等,兼具氧化性和还原性,参与生命活动过程中的多种代谢途径[6]。多铜氧化酶对于许多致病菌具有重要的免疫学意义,当结核分枝杆菌感染人单核细胞THP-1后,黄嘌呤-黄嘌呤氧化酶系统被激活,生成大量活性氧(ROS),发生活性氧应激,对结核分枝杆菌进行杀伤。然而结核分枝杆菌可以通过分泌多铜氧化酶(MCO)清除细胞内的超氧阴离子,降低被感染细胞内活性氧含量,提高结核杆菌的胞内生存能力[7-8]。
布鲁氏菌的多铜氧化酶(BMCO)是最近通过亚细胞定位分析和β内酰胺酶易位效应分子报告系统(TEM-1)新发现的一种新的布鲁氏菌分泌蛋白,但是关于BMCO生物学功能的研究还鲜有报道[9]。本研究拟通过构建牛种布鲁氏菌S2308的BMCO基因缺失株,对BMCO蛋白进行初步生物信息学分析,并研究缺失株的生长特点和胞内生存能力,以期为后续探究布鲁氏菌分泌蛋白BMCO的生物学功能奠定基础。
1 材料与方法
1.1 材料
牛种布鲁氏菌S2308、大肠杆菌DH5α感受态细胞、PUC19K载体、pBBR1MCS-4-BMCO重组质粒均由新疆生产建设兵团动物疾病防控重点实验室实验室保存;pMD19-T载体、T4 DNA连接酶、DNA Maker、2×PCR Mix均购自TaKaRa公司;琼脂糖凝胶回收试剂盒、高纯度质粒小提试剂盒均购自天根生化科技(北京)有限公司;DMEM细胞培养液、胎牛血清均购自Gibco公司;布鲁氏菌液体培养基和布鲁氏菌固体培养基均购自BD公司;氨苄青霉素和卡那霉素均购自Sigma公司。
1.2 方法
1.2.1 引物设计与合成 于GenBank中搜索卡那霉素抗性基因(登录号:M77789.2)和牛种布鲁氏菌S2308的BMCO基因(登录号:CP046721.1)的上、下游同源臂基因,通过Primer Premier 6.0设计BMCO基因的上、下游同源臂和Kan基因引物,引物序列见表1。引物均由生工生物工程(上海)股份有限公司合成。

表1 引物信息
1.2.2BMCO基因上、下游同源臂的扩增 以牛种布鲁氏菌S2308 85 ℃灭活60 min的菌液作为模板,分别以BMCO-N和BMCO-C引物扩增BMCO基因的上、下游同源臂。PCR扩增体系25 μL:模板2 μL,上、下游引物各0.4 μL,Mix 12.5 μL,ddH2O 9.7 μL。PCR反应条件:95 ℃预变性5 min;94 ℃变性40 s,57 ℃退火1 min,72 ℃延伸90 s,共30个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物以1.0%琼脂糖凝胶电泳检测,目的片段利用琼脂糖凝胶回收试剂盒进行回收。
1.2.3Kan基因的扩增 以PUC19K质粒作为模板,Kan-F、Kan-R为引物扩增Kan抗性基因。PCR反应体系同1.2.2,PCR反应条件:95 ℃预变性5 min;94 ℃变性40 s,58 ℃退火40 s,72 ℃延伸80 s,共30个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物以1.0%琼脂糖凝胶电泳检测,目的片段利用琼脂糖凝胶回收试剂盒进行回收。
1.2.4BMCO基因上、下游同源臂和Kan抗性基因的融合 采用巢式PCR法,第一轮PCR将BMCO-N基因、Kan抗性基因、BMCO-C基因按照比1∶1∶1混合后进行融合,PCR反应体系25 μL:DNA模板5 μL,Mix 12.5 μL,ddH2O 7.5μL。反应条件:95 ℃预变性5 min;94 ℃变性40 s,63.8 ℃退火40 s,72 ℃延伸60 s,10个循环;72 ℃再延伸10 min;4 ℃保存。第二轮PCR以第一轮PCR扩增产物作为模板,以BMCO-N-F/BMCO-C-R为引物。 PCR反应体系同1.2.2。 PCR反应条件:95 ℃预变性5 min;94 ℃变性40 s,58 ℃退火90 s,72 ℃延伸80 s,共30个循环;72 ℃延伸10 min;4 ℃保存。PCR扩增产物以1.0%琼脂糖凝胶电泳检测,鉴定正确的PCR产物使用琼脂糖凝胶回收试剂盒进行回收。
1.2.5 重组质粒的构建及鉴定 将获得的融合片段与pMD19-T载体质粒相连接,构建pMD19-T-BMCO-Kan的重组质粒。重组质粒转化大肠杆菌DH5α感受态细胞后,涂布于氨苄、卡那霉素抗性的LB固体培养基上,筛选阳性菌落,以BMCO-N-F和BMCO-C-R为引物进行菌液PCR检测,阳性菌液交由生工生物工程(上海)股份有限公司进行基因测序鉴定。
1.2.6 布鲁氏菌BMCO基因缺失株和回补株的构建及筛选 培养测序结果完全正确的菌液,提取质粒后电转至牛种布鲁氏菌S2308感受态细胞中,涂布于含有卡那霉素的布鲁氏菌固体培养基上。37 ℃、190 r/min培养48 h后,挑取阳性菌落进行连续10代的培养,对第10代菌落以BMCO-F、BMCO-R、BMCO-N-F、BMCO-C-R、Kan-N、Kan-R为引物进行PCR鉴定,鉴定正确的即为BMCO基因缺失株(S2308ΔBMCO)。 将pBBR1MCS-4-BMCO质粒电转至鉴定结果正确的BMCO基因缺失的菌株中,涂布于含有氨苄霉素的布鲁氏菌固体培养基上。挑取阳性菌落,经培养筛选后以BMCO-F、BMCO-C为引物进行PCR鉴定,鉴定正确的即为BMCO基因回补株(ΔBMCO::BMCOS2308)。
1.2.7 S2308和S2308ΔBMCO生长曲线的测定 分别挑选S2308、S2308ΔBMCO单克隆菌落于布鲁氏菌液体培养基中,190 r/min、37 ℃培养至D600 nm值为0.8,吸取培养液于新鲜的布鲁氏菌液体培养基将各试验组中菌液调至D600 nm值为0.1后继续在摇床培养。之后每2 h检测菌液D600 nm值,直至各菌株培养至平台期,并根据时间和D600 nm值绘制牛种布鲁氏菌S2308和S2308ΔBMCO的生长曲线图。
1.2.8 S2308、S2308ΔBMCO和ΔBMCO::BMCOS2308的胞内存活试验 将培养的小鼠巨噬细胞RAW264.7接种于6孔板中,1×106/孔,培养至贴壁形成单层细胞。将处于对数生长期的牛种布鲁氏菌S2308、S2308ΔBMCO和ΔBMCO::BMCOS2308以100的感染复数(MOI)侵染细胞,37 ℃、5% CO2培养箱内孵育45 min。PBS清洗3次,加入含有2.5%庆大霉素的DMEM继续孵育45 min。 PBS清洗3次,加入含10% FBS的DMEM在0、4、12、24、48 h后弃去培养基,PBS清洗3次后用0.01% Trition X-100裂解细胞,释放出胞内菌,稀释100倍后涂布于布鲁氏菌固体培养基上,对其进行计数。
1.2.9 布鲁氏菌分泌蛋白BMCO的生物信息学分析 运用ProtParam在线软件(https:∥web.expasy.org/protparam/)对蛋白理化性质进行分析;采用ProtScale在线软件(https:∥web.expasy.org/protscale/)进行亲/疏水性分析;采用SignalP 4.1在线软件(http:∥www.cbs.dtu.dk/services/SignalP-4.1)进行信号肽分析;通过PSORTⅡ在线程序(https:∥www.genscript.com/psort.html)进行亚细胞定位预测;采用SOPMA在线软件(https:∥npsa-prabi.ibcp.fr/cgi-bin/npsa_automat)进行二级结构预测;采用SWISS-MODEL在线软件(https:∥swissmodel.expasy.org)进行三级结构预测。
1.3 统计学分析
每个试验均重复5次,结果用平均值±标准差表示。采用GraphPad-Prism 8.0软件进行数据处理,两组间平均值进行t检验。 *表示差异显著(P<0.05);**表示差异极显著(P<0.01)。
2 结 果
2.1 目的基因的扩增
以牛种布鲁氏菌S2308和PUC19K质粒作为模板,利用PCR反应分别对BMCO基因的上、下游同源臂和Kan基因进行特异性扩增。结果显示,扩增产物分别为522、539和1 054 bp的特异性条带(图1),与预期片段大小相符,表明扩增成功。
2.2 BMCO基因的上、下游同源臂、Kan抗性基因的融合
将BMCO基因的上、下游同源臂和Kan基因3个片段按照浓度1∶1∶1的比例混合进行融合PCR,结果显示,融合后片段大小为2 115 bp(图2),与预期大小相符,表明扩增成功。
2.3 重组质粒的构建和鉴定
重组质粒pMD19-T-BMCO-Kan经PCR检测获得大小为2 115 bp的特异性条带(图3),回收产物经测序分析和序列比对后发现与预期结果一致,说明pMD19-T-BMCO-Kan重组质粒构建成功。

A,BMCO基因上游同源臂;B,BMCO基因下游同源臂;C, Kan基因A,BMCO gene upstream homologous arm;B,BMCO gene downstream homologous arm;C,Kan gene图1 目的基因的扩增Fig.1 Amplification of target genes

M,Super DNA Marker;1,融合后的扩增产物;2,阴性对照M,Super DNA Marker;1,Amplification products of fusion;2,Negative control图2 BMCO基因上、下游同源臂和Kan抗性基因的融合Fig.2 Fusion of BMCO gene upstream and downstream homologous arms and Kan resistance gene
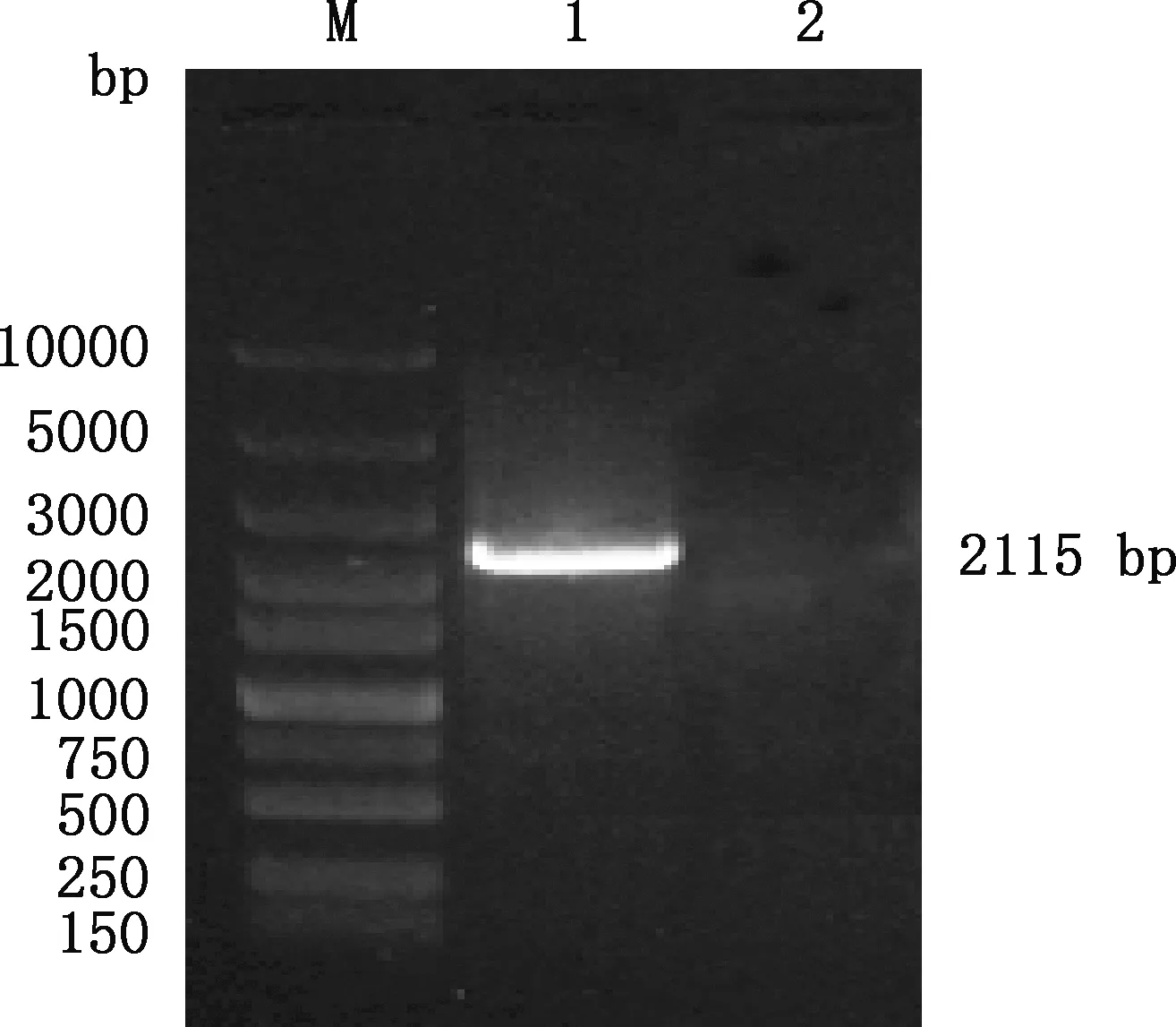
M,Super DNA Marker;1,以BMCO-N-F和BMCO-C-R为引物的菌液PCR产物;2,阴性对照M,Super DNA Marker;1,PCR products of bacterial liquid with BMCO-N-F and BMCO-C-R primers;2,Negative control图3 重组质粒的鉴定Fig.3 Identification of recombinant plasmid
2.4 布鲁氏菌BMCO基因缺失株及回补株的构建及筛选
对第10代阳性菌落进行PCR检测,结果表明,以BMCO为特异性引物,缺失株中不能检测到BMCO基因的特异性条带,BMCO-N-F、BMCO-C-R和Kan基因引物分别检测出现特异性条带大小分别为2 115和1 054 bp(图4A),和预期结果相符,说明成功构建可以稳定遗传的BMCO基因缺失株,即S2308ΔBMCO。将pBBR1MCS-4-BMCO电转至S2308ΔBMCO缺失株,经培养,使用特异性引物(BMCO)进行检测,结果获得特异性大小为1 605 bp的目标条带(图4B),和预期结果相符,表明S2308ΔBMCO的回补株构建成功,即为ΔBMCO::BMCOS2308。
2.5 S2308和S2308ΔBMCO的生长曲线
由图5可知,缺失株S2308ΔBMCO和亲本株S2308的生长趋势相同,说明BMCO基因缺失并不能影响布鲁氏菌的生长。
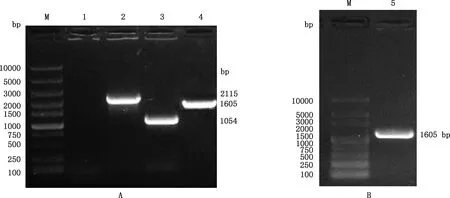
M,Super DNA Marker;1,以BMCO特异性引物扩增S2308ΔBMCO的PCR产物;2,以BMCO外部引物扩增S2308ΔBMCO的PCR产物;3,以Kan基因特异性引物扩增S2308ΔBMCO的PCR产物;4,以BMCO特异性引物扩增S2308的PCR产物;5,以BMCO特异性引物扩增ΔBMCO::BMCOS2308的PCR产物M,Super DNA Marker;1,Amplification of PCR products of S2308ΔBMCO by BMCO specific primers;2,Amplification of PCR products of S2308ΔBMCO by BMCO external primers;3,Amplification of PCR products of S2308ΔBMCO by Kan gene specific primers;4,Amplification of PCR products of S2308 by BMCO specific primers;5,Amplification of PCR products of ΔBMCO::BMCOS2308 by BMCO specific primers图4 布鲁氏菌BMCO基因缺失株(A)及回补株(B)的构建及筛选Fig.4 Construction and screening of BMCO gene deletion strain (A) and complementary strain (B) of Brucella

图5 布鲁氏菌S2308和S2308ΔBMCO株的生长曲线Fig.5 Growth curve of S2308 and S2308ΔBMCO strains of Brucella
2.6 S2308和S2308ΔBMCO的胞内生存能力
以S2308、S2308ΔBMCO和ΔBMCO::BMCOS2308株侵染小鼠巨噬细胞RAW264.7, 统计布鲁氏菌在胞内的生存情况,结果显示,随着时间的延长,S2308、S2308ΔBMCO和ΔBMCO::BMCOS2308株在胞内的数量总体都呈现上升趋势。与S2308株相比,S2308ΔBMCO株的胞内生存能力均极显著降低(P<0.01)(图6)。
2.7 布鲁氏菌分泌蛋白BMCO的生物信息学分析
预测结果表明,BMCO蛋白共含有1 605个氨基酸残基,主要由Ala(11.6%)、Gly(9.2%)和Leu(9.0%)构成(图7)。疏水区域远大于亲水区域,属于疏水蛋白(图8)。C、Y、S的最大值分别为0.131、0.300、0.851,S-mean的值为0.730,D值为0.532,信号肽主要集中在前20位氨基酸之间(图9)。亚细胞定位结果显示,BMCO位于细胞质的可能性最大,为33.3%(图10)。对BMCO的二级结构预测表明,该蛋白内含有大量无规则卷曲、延伸链和α-螺旋,分别占比为48.5%、26.03% 和17.04%(图11),三级结构预测结果(图12)与二级结构一致,预示BMCO可能有许多功能位点。

与S2308株相比,*,差异显著(P<0.05);**,差异极显著(P<0.01);ns,差异不显著(P>0.05)Compared with S2308 strain,*,Significant difference (P<0.05);**,Extremely significant difference (P<0.01);ns,No significant difference (P>0.05)图6 布鲁氏菌S2308、S2308ΔBMCO和ΔBMCO::BMCOS2308株的胞内生存状况Fig.6 Intracellular survival of S2308,S2308ΔBMCO and ΔBMCO::BMCOS2308 strains of Brucella
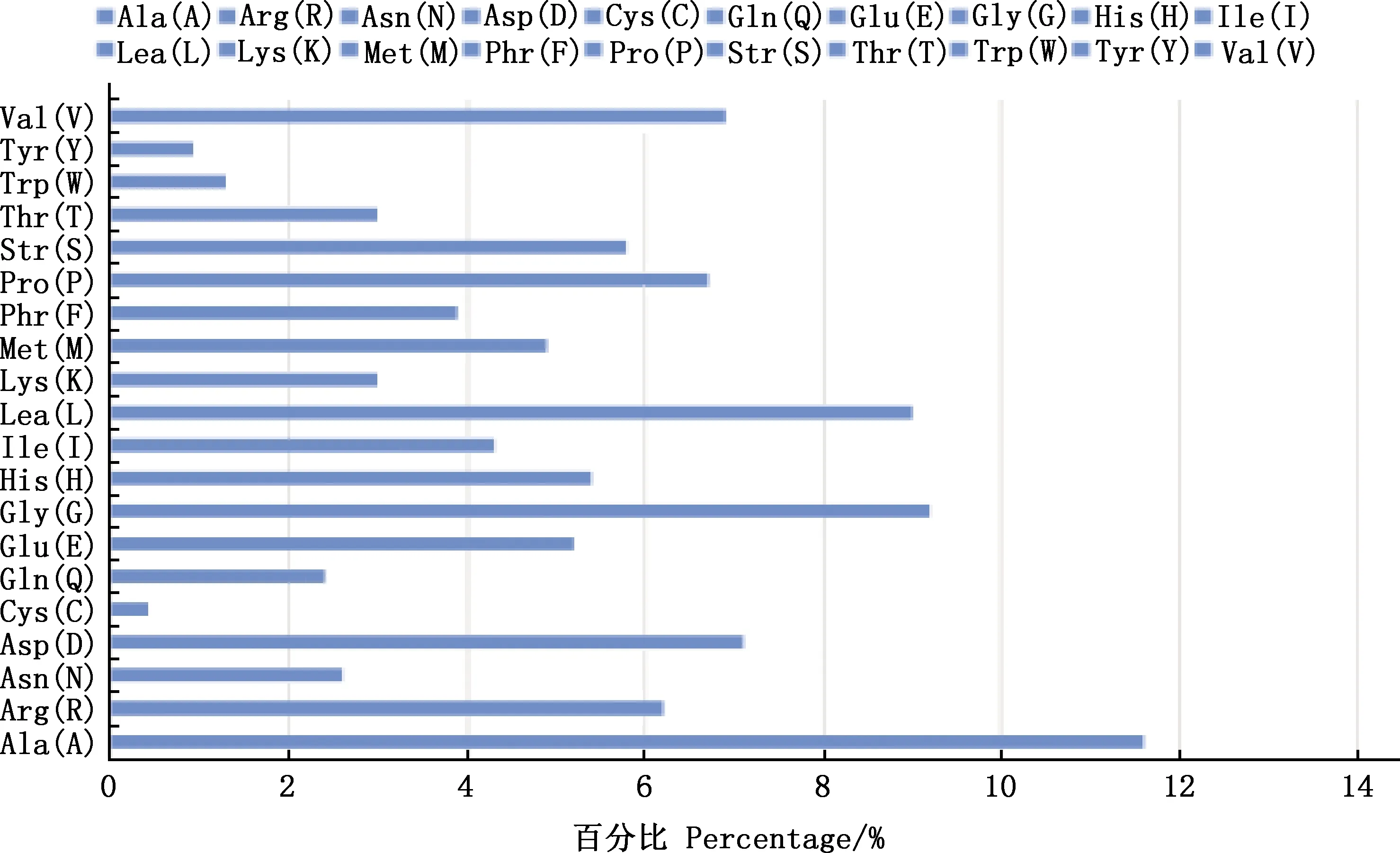
图7 布鲁氏菌BMCO蛋白氨基酸组成Fig.7 Amino acid composition of BMCO protein of Brucella

图8 布鲁氏菌BMCO蛋白亲/疏水性分析Fig.8 Hydrophilicity and hydrophobicity of BMCO protein of Brucella
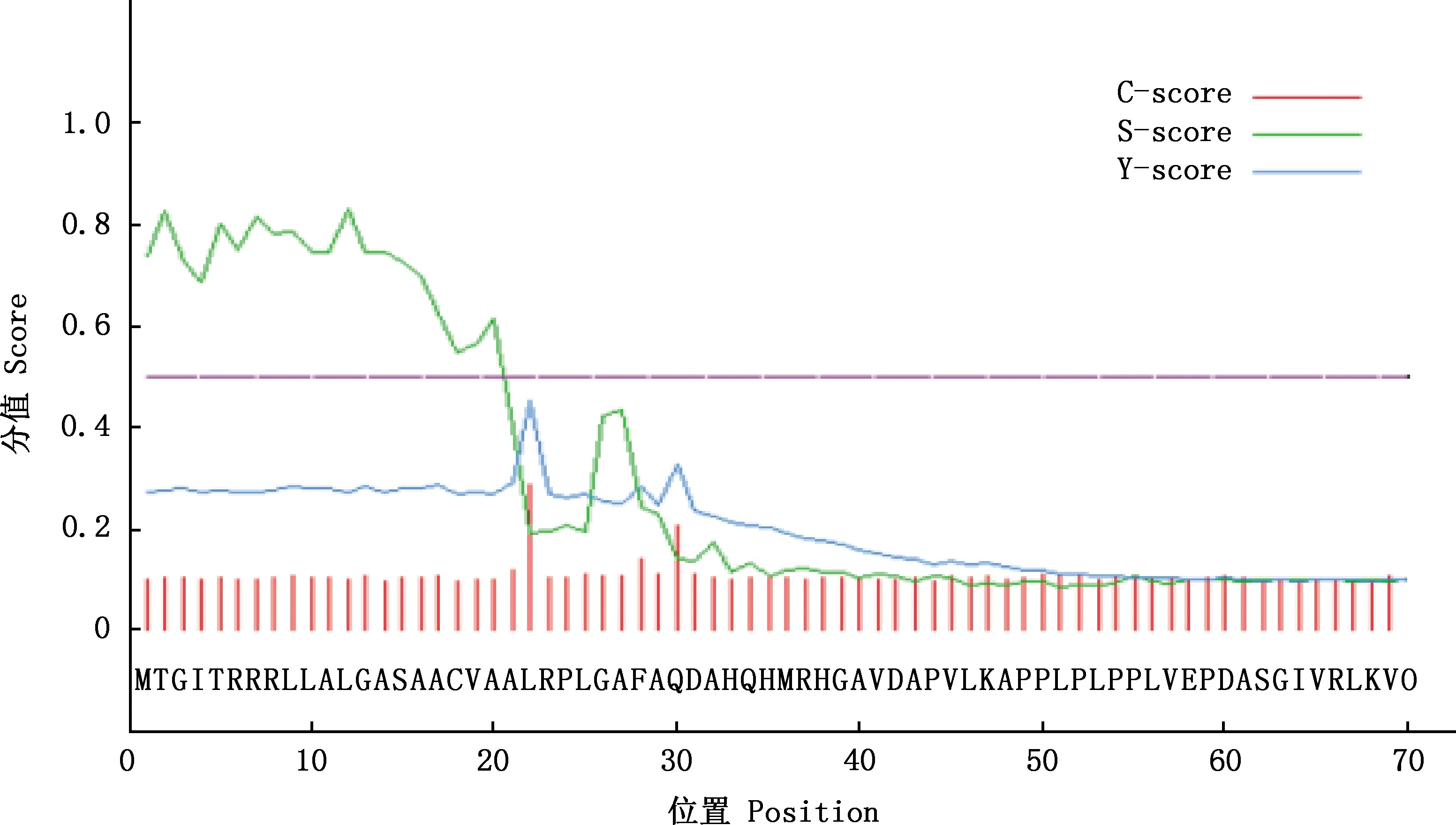
图9 布鲁氏菌BMCO信号肽分析Fig.9 Signal peptide analysis of BMCO protein of Brucella
3 讨 论
当病原体进入机体后,首先发挥作用的是固有免疫系统。固有免疫系统内的溶菌酶、甘露糖结合凝集素等非特异性效应分子会对病原体进行初步识别。之后病原相关分子模式(PAMP)经模式识别受体(PRR)识别,激发信号级联传导,活化效应细胞发生炎症反应,对病原微生物进行清除。适应性免疫应答在最后被激活,当病原体固有免疫不能有效清除病原体时,残存的病原体会被初始T、B淋巴细胞识别,继而大量克隆分化为效应细胞实现免疫应答功能[10-11]。然而,布鲁氏菌在感染小鼠后,不能引起多种效应免疫细胞的积聚,Toll样受体(TLR)的识别能力降低,补体不能大量诱导促炎性细胞产生,这说明布鲁氏菌已经进化出来一系列复杂的分子机制来逃逸宿主的免疫应答机制,因此阐明布鲁氏菌是如何逃避免疫应答的机制就变成了国内外学者的研究热点[12-13]。
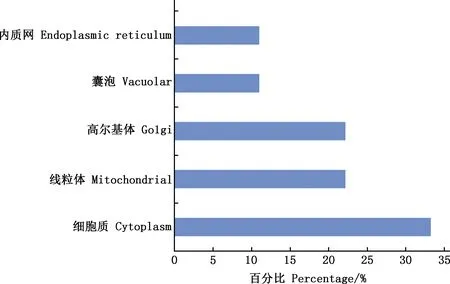
图10 布鲁氏菌BMCO蛋白亚细胞定位预测Fig.10 Prediction of subcellular localization of BMCO protein of Brucella
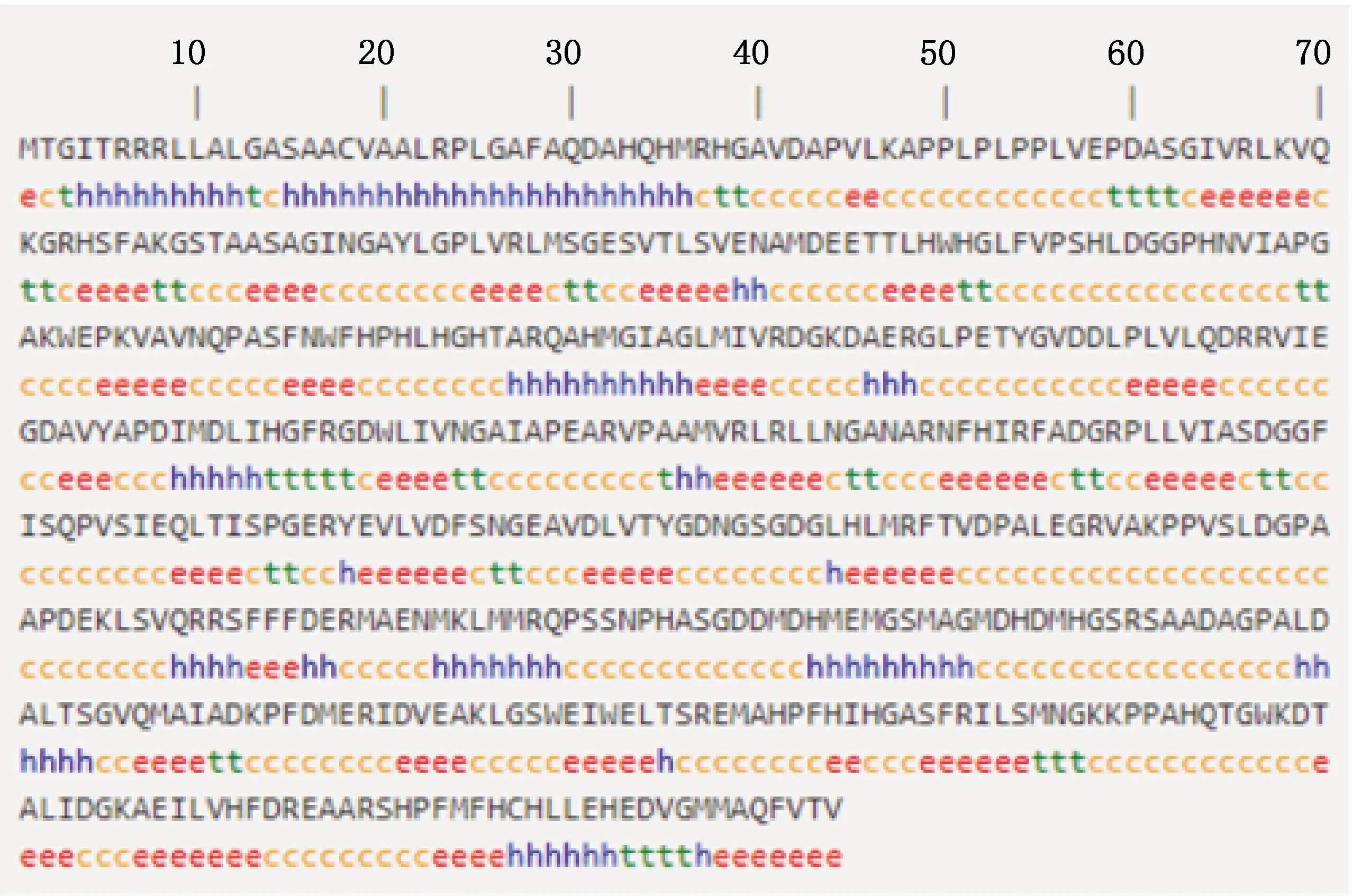
h,α-螺旋;e,延伸链;t,β-转角;c,无规则卷曲h,Alpha helix;e,Extended chain;t,Beta turn;c,Random coil图11 布鲁氏菌BMCO蛋白二级结构预测Fig.11 Secondary structure prediction of BMCO protein of Brucella

图12 布鲁氏菌BMCO蛋白三级结构预测Fig.12 Tertiary structure prediction of BMCO protein of Brucella
布鲁氏菌的分泌蛋白就是其免疫逃逸的重要手段之一。作为典型的胞内寄生菌,布鲁氏菌通常定居在由质膜形成的内噬体中,并利用特有的分泌系统分泌效应蛋白,效应蛋白对于调节宿主细胞的分泌过程、改变胞内囊泡的转运途径、抑制宿主细胞免疫应答,帮助布鲁氏菌在细胞内的持续性感染具有重要意义[14-15]。目前有许多关于布鲁氏菌分泌蛋白的报道,如VCEC可以激活未折叠蛋白反应(UPR),导致内质网应激并诱发促炎反应[16-17];BtpA可以抑制树突状细胞的成熟,破坏TLR的信号传递,降低核因子激活的B细胞的κ-轻链(NF-κB)信号通路活性[18-19];BspB和BspF分别定位于内质网和血浆膜,它们可以抑制宿主细胞蛋白分泌途径,增强布鲁氏菌的胞内复制能力[20];BPE123可以通过与宿主细胞中的细胞纤毛内转运蛋白(IFT20)相互作用调节宿主细胞自噬功能[21]。由此可见,研究布鲁氏菌的分泌蛋白对于理解布鲁氏菌免疫逃逸和胞内寄生机制具有重要意义。BMCO是在布鲁氏菌上新发现的一种分泌蛋白,目前对于该蛋白功能的报道较少[9,22]。本试验中,通过构建布鲁氏菌S2308的BMCO基因缺失株发现,BMCO基因缺失对布鲁氏菌的生长速度并无明显的影响,但其胞内生存能力显著降低。为了进一步探究分泌蛋白BMCO的生物学功能,对该蛋白进行初步的生物信息学分析,表明该蛋白为疏水性蛋白,可能定位于宿主细胞的细胞质中,内含有大量的无规则卷曲、α-螺旋和延伸链,这预示着BMCO可能具有多个功能位点,推测BMCO可能与宿主细胞内的某蛋白发生相互作用,继而影响宿主细胞的免疫学功能,提高布鲁氏菌的胞内生存能力。
MCO在大肠杆菌中定位于胞质中,主要受到铜离子浓度的调控。当细胞中铜离子浓度增加后,MCO表达发生上调,并且能将高毒性的Cu+氧化成低毒性的Cu2+,以克服宿主细胞内过量铜离子的毒性作用,提高大肠杆菌在胞内的生存能力[23-24]。MCO的缺失显著降低了结核分枝杆菌的胞内生存能力,提高了宿主细胞内活性氧应激水平[8]。吴同垒[9]发现,布鲁氏菌分泌蛋白BMCO和大肠杆菌、结核分枝杆菌中的MCO具有一定的相似性,其C-端都具有蛋白活性的结合位点。推测布鲁氏菌分泌蛋白BMCO也参与了克服宿主细胞应激内环境的调控机制,具体机制仍有待研究。
4 结 论
布鲁氏菌分泌蛋白BMCO可能具有多个功能位点,布鲁氏菌BMCO基因缺失株体外培养条件下与亲本株生长趋势相似;但该缺失株在小鼠单核巨噬细胞RAW264.4内的存活能力显著降低,这为未来研究布鲁氏菌分泌蛋白BMCO的生物学功能奠定了基础。
